探高考试题思路 寻高考命题规律
图片预览









文档简介
课件44张PPT。探高考试题思路 寻高考
命题规律
江西省高安中学 黄爱华 全国Ⅰ卷 (2007-2009)三年大题情况分析2009年全国高考理综(全国卷I)化学试题
1.凸显了“重视基础,联系课改,呈出综合,体现创新”等特点。
2.继续贯彻“稳中求美,稳中求改”的原则。
3.最为突出的特点之一就是强调了学科的基础性。
4.具有情景真实,知识整体性,思维探究性,难度有序性。
5. 是近几年最成功的一份试卷。
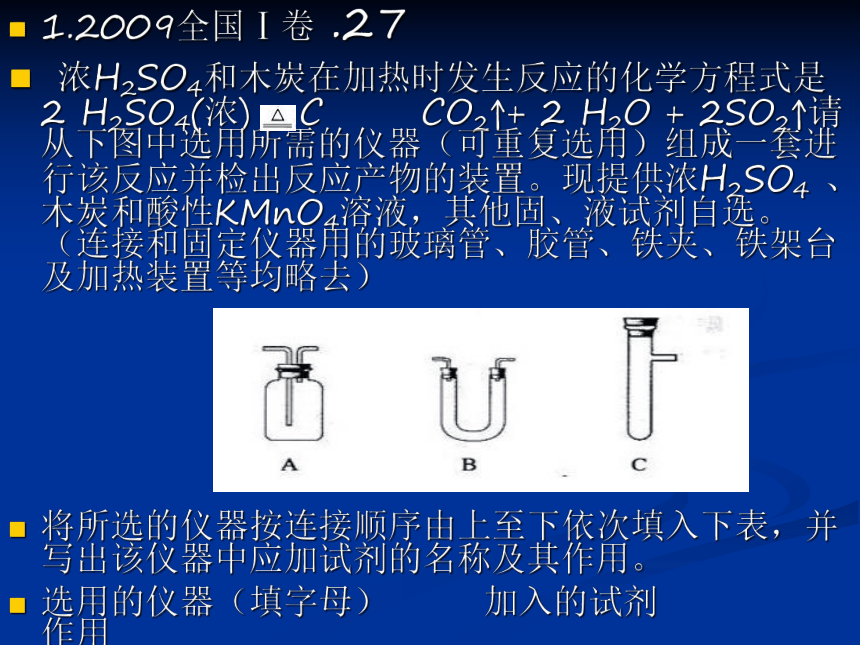
2 0 0 9 年1.2009全国Ⅰ卷 .27
浓H2SO4和木炭在加热时发生反应的化学方程式是2 H2SO4(浓) + C CO2↑+ 2 H2O + 2SO2↑请从下图中选用所需的仪器(可重复选用)组成一套进行该反应并检出反应产物的装置。现提供浓H2SO4 、木炭和酸性KMnO4溶液,其他固、液试剂自选。(连接和固定仪器用的玻璃管、胶管、铁夹、铁架台及加热装置等均略去)
将所选的仪器按连接顺序由上至下依次填入下表,并写出该仪器中应加试剂的名称及其作用。
选用的仪器(填字母) 加入的试剂 作用2.2009全国1卷28.
下图所示装置中,甲、乙、丙三个烧杯依次分别盛放100g 5.00%的NaOH溶液、足量的CuSO4溶液和100g 10.00%的K2SO4溶液,电极均为石墨电极。
接通电源,经过一段时间后,测得丙中
K2SO4浓度为10.47%,乙中c电极质量增
加。据此回答问题:
①电源的N端为 极;
②电极b上发生的电极反应为 ;
③列式计算电极b上生成的气体在标准状
态下的体积: ;
④电极c的质量变化是 g;
⑤电解前后各溶液的酸、碱性大小是否发生变化,简述其原因:
甲溶液 ;
乙溶液 ;
丙溶液 ;
(2)如果电解过程中铜全部析出,此时电解能否继续进行,为什么?
3.2009全国I卷29.
已知周期表中,元素Q、R、W、Y与元素X相邻。Y的最高化合价氧化物的水化物是强酸。回答下列问题:
(1)W与Q可以形成一种高温结构陶瓷材料。W的氯化物分子呈正四面体结构,W的氧化物的晶体类型是 ;
(2)Q的具有相同化合价且可以相互转变的氧化物是 ;
(3)R和Y形成的二元化合物中,R呈现最高化合价的化合物的化学式是 ;
(4)这5个元素的氢化物分子中,①立体结构类型相同的氢化物的沸点从高到低排列次序是(填化学式) ,其原因是
;
②电子总数相同的氢化物的化学式和立体结构分别是
;
(5)W和Q所形成的结构陶瓷材料的一种合成方法如下:W的氯化物与Q的氢化物加热反应,生成化合物W(QH2)4和HCl气体;W(QH2)4在高温下分解生成Q的氢化物和该陶瓷材料。上述相关反应的化学方程式(各物质用化学式表示)是 。4.2009全国Ⅰ卷 .30 化合物H是一种香料,存在于金橘中,可用如下路线合成:
已知:
R-CH=CH2(i)B2H6(ii)
H2O2/OH- R-CH2CH2OH(B2 H6为乙硼烷)
回答下列问题:(1)11.2L(标准状况)的烃A在氧气中充分燃烧可以产生88 g CO2和45 g H-2-O。
A的分子式是__
(2)B和C均为一氯代烃,它们的名称(系统命名)分别为_____;
(3)在催化剂存在下1 mol F与2 mol H-2反应,生成3-苯基-1-丙醇。F的结构简式是__
(4)反应①的反应类型是____;(5)反应②的化学方程式为______
(6)写出所有与G具有相同官能团的G的芳香类同分异构体的结构简式:_______
2 0 0 8 年
5.2008(全国Ⅰ卷) 26.
实验室可由软锰矿(主要成分为MnO2)制备KMnO4,方法如下:软锰矿和过量的固体KOH和ClO3在高温下反应,生成锰酸钾(K2MnO4)和KCl;用水溶解,滤去残渣,滤液酸化后,K2MnO4转变为MnO2和KMnO4;滤去MnO2沉淀,浓缩溶液,结晶得到深紫色的针状KMnO4。试回答:
(1)软锰矿制备K2MnO4的化学方程式是 ;
(2) K2MnO4制备 KMnO4的离子方程式是
;
(3)若用2.5g软锰矿(含MnO2 80%)进行上述实验,计算 KMnO4的理论产量:
(4) KMnO4能与热的经硫酸酸化的Na2C2O4反应,生成Mn2+和CO2,该反应的化学方程式是 ;
(5)上述制得的 KMnO4产品0.165g,恰好与0.335g纯Na2C2O4反应。计算该KMnO4的纯度。6.2008(全国Ⅰ卷) 27.
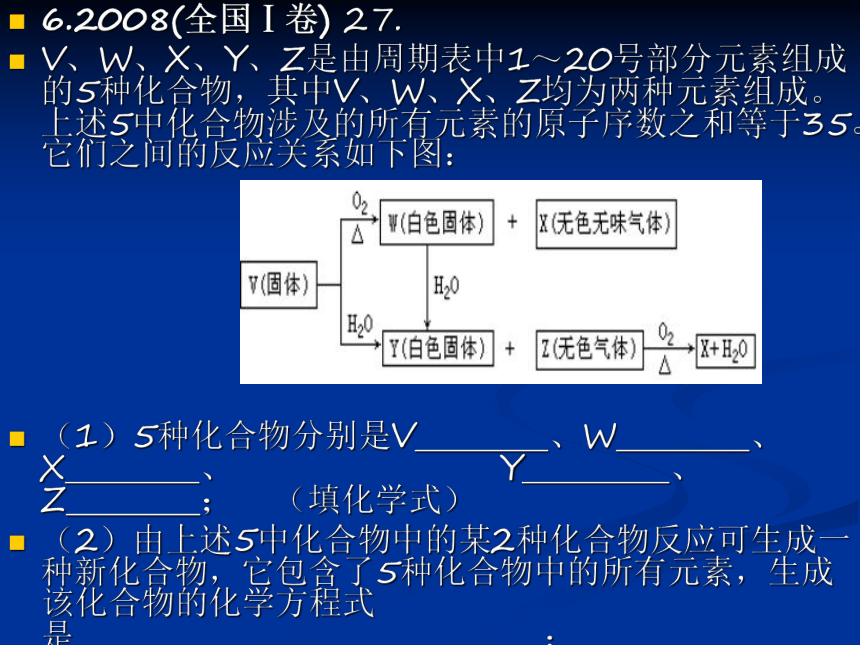
V、W、X、Y、Z是由周期表中1~20号部分元素组成的5种化合物,其中V、W、X、Z均为两种元素组成。上述5中化合物涉及的所有元素的原子序数之和等于35。它们之间的反应关系如下图:
(1)5种化合物分别是V 、W 、X 、 Y 、 Z ; (填化学式)
(2)由上述5中化合物中的某2种化合物反应可生成一种新化合物,它包含了5种化合物中的所有元素,生成该化合物的化学方程式是 ;
(3)V的电子式是 。7.2008(全国Ⅰ卷) 28.
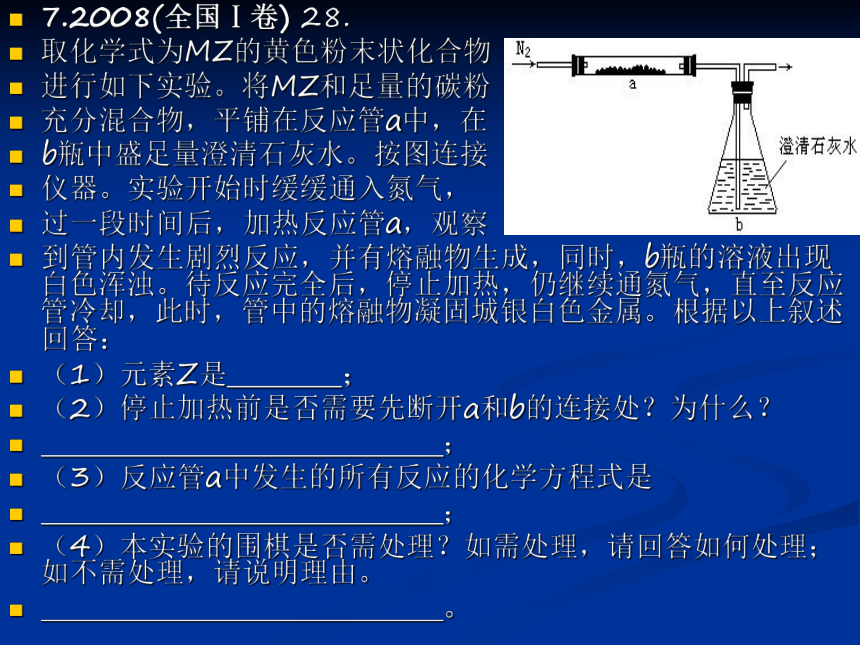
取化学式为MZ的黄色粉末状化合物
进行如下实验。将MZ和足量的碳粉
充分混合物,平铺在反应管a中,在
b瓶中盛足量澄清石灰水。按图连接
仪器。实验开始时缓缓通入氮气,
过一段时间后,加热反应管a,观察
到管内发生剧烈反应,并有熔融物生成,同时,b瓶的溶液出现白色浑浊。待反应完全后,停止加热,仍继续通氮气,直至反应管冷却,此时,管中的熔融物凝固城银白色金属。根据以上叙述回答:
(1)元素Z是 ;
(2)停止加热前是否需要先断开a和b的连接处?为什么?
;
(3)反应管a中发生的所有反应的化学方程式是
;
(4)本实验的围棋是否需处理?如需处理,请回答如何处理;如不需处理,请说明理由。
。8.2008(全国Ⅰ卷) 29.
A、B、C、D、E、F和G都是有机化合物,它们的关系如下图所示:
(1)化合物C的分子式是C7H8O,C遇到FeCl3溶液显示紫色,C与溴水反应生成的一溴代物只有两种,则C的结构简式为 ;
(2)D为一直链化合物,其相对分子质量比化合物C的小20,它能跟NaHCO3反应放出CO2,则D分子式为 ,D具有的官能团是 ;
(3)反应①的化学方程式是 ;
(4)芳香化合物B是与A具有相同官能团的A的同分异构体,通过反应②化合物B能生成E和F,F可能的结构简式是 ;
(5)E可能的结构简式是 。
2 0 0 7 年
9.(2007年理综卷I).26
W、X、Y和Z都是周期表中前20号元素,已知:
①W的阳离子和Y的阴离子具有相同的核外电子排布,且能形成组成为WY的化合物;
②Y和Z属同族元素,它们能形成两种常见化合物;
③X和Z属同一周期元素,它们能形成两种气态化合物;
④W和X能形成组成为WX2的化合物;
⑤X和Y不在同一周期,它们能形成组成为XY2的化合物。
请回答:
(1)W元素是________;Z元素是_________。
(2)化合物WY和WX2的化学式分别是__________和___________。
(3)Y和Z形成的两种常见化合物的分子式是_________和_________。
(4)写出X和Z形成的一种气态化合物跟WZ反应的化学方程式___________________。10. (2007年理综卷I)27
A、B、C、D、E均为可溶于水的固体,组成它们的离子有
阳离子Na+、Mg2+、Al3+、Ba2+
阴离子OH—、Cl—、CO32—、SO42—、HSO4—、
分别取它们的水溶液进行实验,结果如下:
①A溶液与B溶液反应生成白色沉淀,沉淀可溶于E溶液;
②A溶液与C溶液反应生成白色沉淀,沉淀可溶于E溶液;
③A溶液与D溶液反应生成白色沉淀,沉淀可溶于盐酸;
④B溶液与适量D溶液反应生成白色沉淀,加入过量D溶液,沉淀量减小,但不消失。
据此推断它们是A__________;B___________;C__________;D___________;E___________。
11.(2007年理综卷I)28水蒸气通过灼热的焦碳后,流出气体的主要成分是CO和H2,还有CO2和水蒸气等。请用下图中提供的仪器,选择必要的试剂,设计一个实验,证明上述混合气中有CO和H2。(加热装置和导管等在图中略去)水和沸石
回答下列问题:
(1)盛浓H2SO4的装置用途是____,
盛NaOH溶液的装置用途是____。
(2)仪器B中需加入试剂的名称(或
化学式)是____,所发生反应的化
学方程式是_____。
(3)仪器C中需加入试剂的名称(或化学式)是____,其目的_______。
(4)按气流方向连接各仪器,用字母表示接口的连接顺序:g—ab—_______。
(5)能证明混合气中含有CO的实验依据是_____。
(6)能证明混合气中含有H2的实验依据是_______。`12. (2007年理综卷I)29
下图中A、B、C、D、E、F、G均为有机化合物。
根据上图回答问题:
(1)D的化学名称是______。
(2)反应③的化学方程式是_______
(有机物须用结构简式表示)
(3)B的分子式是_________。A的结构简式是______。反应①的反应类型是_______。
(4)符合下列3个条件的B的同分异构体的数目有_______个。
①含有邻二取代苯环结构;②与B有相同官能团;③不与FeCl3溶液发生显色反应。
写出其中任意一个同分异构体的结构简式________。
(5)G是重要的工业原料,用化学方程式表示G的一种重要的工业用途。_______。
2 0 0 6 年
13.(2006·全国.26)
X、Y、Z和W代表原子序数依次增大的四种短周期元素,它们满足以下条件:
①元素周期表中,Z与Y相邻,Z与W也相邻;
②Y、Z和W三种元素的原子最外层电子数之和为17。
请填空:
⑴Y、Z和W三种元素是否位于同一周期(填“是”或“否”): ,理由是 ;
⑵Y是 ,Z是 ,W是 ;
⑶X、Y、Z和W可组成一化合物,其原子个数之比为8:2:4:1。写出该化合物的名称及化学式 。14.(2006·全国.27)
置换反应的通式可以表示为:
单质⑴+化合物⑴===化合物⑵+单质⑵
请写出满足以下要求的3个置换反应的化学方程式:
①所涉及的元素的原子序数都小于20;
②6种单质分属于6个不同的主族。15.(2006·全国.28)在呼吸面具和潜水艇中可用过氧化钠作为供氧剂。请选用适当的化学试剂和实验用品,用下图中的实验装置进行实验,证明过氧化钠可作供氧剂。
⑴A是制取CO2的装置。写出A中发生反应的化学方程式 。
⑵填写表中空格
⑶写出过氧化钠与二氧化碳反应的化学方程式 。
⑷试管F中收集满气体后,下一步实验操作是: 。解答:⑴CaCO3+2HCl===CaCl2+CO2↑+H2O
⑵)
⑶2Na2O2+2CO2===2Na2CO3+O2
⑷把E中的导管移出水面,关闭分液漏斗活塞,用拇指堵住试管口,取出试管,立即把带有火星的木条伸入试管口内,木条复燃,证明试管中收集的气体是氧气。
16.(2006·全国)29.(21分)
萨罗(Salol)是一种消毒剂,它的分子式为C13H10O3,其分子模型如下图所示(图中球与球之间的连线代表化学键,如单键、双键等);
⑴根据右图模型写出萨罗的结构简式: 。
⑵萨罗经水解、分离、提纯可得到纯净的苯酚和水杨酸(邻羟基苯甲酸)。请设计一个方案,说明苯酚、碳酸、水杨酸的酸性依次增强(用化学方程式表示)。
⑶同时符合下列四个要求的水杨本的同分异构体共有 。
①含有苯环
②能发生银镜反应,不能发生水解反应;
③在稀NaOH溶液中,1 mol该同分异构体能与2 molNaOH发生反应;
④只能生成两种一氯代产物。
⑷从⑶确定的同分异构体中任选一种,指定为下列框图中的A。
写出下列四个反应的化学方程式(有机物用结构简式表示),并指出相应的反应类型。
①A→B 。反应类型: 。
②B+D→E 。反应类型: 。
⑸现有水杨酸和苯酚的混合物,它们的物质的量之和为n mol。该混合物完全燃烧消耗a L O2,并生成b g H2O和c L CO2(气体体积均为标准状况下的体积)。
①分别写出水杨酸和苯酚完全燃烧的化学方程式(有机物可用分子式表示)。
②设混合物中水杨酸的物质的量为x mol,列出x 的计算式。
2 0 0 5 年
17.(2005·全国.26)
已知A、B、C、D为气体,E、F为固体,G是氯化钙,它们之间的转换关系如下图如示:
(1)D的化学式(分子式)是 ,E的化学式(分子式)是
(2)A和B反应生成C的化学方程式是
(3)E和F反应生成D、H和G的化学主程式是 18.(2005·全国)27.(15分)甲、乙、丙、丁为前三周期元素形成的微粒,它们的电子总数相等。已知甲、乙、丙为双原子分子或负二价双原子阴离子,丁为原子。
(1) 丙与钙离子组成的离子化合物跟水反应产生一种可燃性气体,反应的化学方程式是 。
(2) 乙在高温时是一种还原剂,请用化学方程式表示它在工业上的一种重要用途: 。
(3) 在一定条件下,甲与O2反应的化学方程式是 。
(4) 丁的元素符号是 ,它的原子结构示意图为 。
(5) 丁的氧化物的晶体结构与 的晶体结构相似。19.( 2005·全国.28)已知某纯碱试样中含有NaCl杂质,为测定试样中纯碱的质量分数,可用下图中的装置进行实验。
主要实验步骤如下:
① 按图组装仪器,并检查装置的气密性
② 将a g试样放入锥形瓶中,加适量蒸馏水溶解,得到试样溶液
③ 称量盛有碱石灰的U型管的质量,得到b g
④ 从分液漏斗滴入6 mol·L?1的硫酸,直到不再产生气体时为止
⑤ 从导管A处缓缓鼓入一定量的空气
⑥ 再次称量盛有碱石灰的U型管的质量,得到c g
⑦ 重复步骤⑤和⑥的操作,直到U型管的质量基本不变,为d g
请填空和回答问题:
(1) 在用托盘天平称量样品时,如果天平的指针向左偏转,说明 。
(2) 装置中干燥管B的作用是 。
(3) 如果将分液漏斗中的硫酸换成浓度相同的盐酸,测试的结果 (填偏高、偏低或不变)。
(4) 步骤⑤的目的是 。
(5) 步骤⑦的目的是 。
(6) 该试样中纯碱的质量分数的计算式为 。
(7) 还可以用其他实验方法测定试样中纯碱的质量分数。请简述一种不同的实验方法20.(2005·全国)29.苏丹红一号(sudanⅠ)是一种偶氮染料,不能作为食品添加剂使用。它是由苯胺和2—萘酚为主要原料制备的,它们的结构简式如下所示:
(苏丹红一号) (苯胺) (2—萘酚)
(1) 苏丹红一号的化学式(分子式)为 。
(2) 在下面化合物(A)~(D)中,与2—萘酚互为同分异构体的有(填字母代号) 。
(提示: 可表示为 )
(A) (B) (C) (D)
(3) 上述化合物(C)含有的官能团是 。
(4) 在适当的条件下,2—萘酚经反应可得到芳香化合物E(C8H6O4),1 mol E与适量的碳酸氢钠溶液反应可放出二氧化碳44.8 L(标准状况),E与溴在有催化剂存在时反应只能生成两种一溴取代物,两种一溴取代物的结构简式分别是 ,E与碳酸氢钠反应的化学方程式是 。
(5) 若将E与足量乙醇在浓硫酸作用下加热,可以生成一个化学式(分子式)为C12H14O4的新化合物,该反应的化学方程式是 ,反应类型是 。
2 0 0 4 年
21.(2004·全国.26)某有机物A的结构简式如下:
(1)A的分子式是 。
(2)A在NaOH水溶液中加热反应得到B和C,C是芳香族化合物。
B和C的结构简式是B:________________ C: 。该反应属于 反应。
(3)室温下,C用稀盐酸酸化得到E,E的结构简式是 。
(4)在下列物质中,不能与E发生化学反应的是(填写序号) 。
①浓H2SO4和浓HNO3的混合液 ②CH3CH2OH(酸催化)
③CH3CH2CH2CH3 ④Na ⑤CH3COOH(酸催化)
(5)写出同时符合下列两项要求的E的所有同分异构体的结构简式。
①化合物是1,3,5,-三取代苯
②苯环上的三个取代基分别是甲基、羟基和含有 结构的基团。22.(2004·全国卷I.27) 电解原理在化学工业
中有广泛应用。右图表示一个电解池,装
有电解液a;X、Y是两块电极板,通过导
线与直流电源相连。请回答以下问题:
(1)若X、Y都是惰性电极,a是饱和NaCl
溶液,实验开始时,同时在两边各滴入几滴
酚酞试液,则
①电解池中X极上的电极反应式为 。在X极附近观察到的现象是 。
②Y电极上的电极反应式为 ,检验该电极反应产物的方法是 。
(2)如要用电解方法精炼粗铜,电解液a选用CuSO4溶液
①X的电极材料是 ,电极反应式为 。
②Y电极的材料是 ,电极反应式为 。(说明:杂质发生的电极反应不必写出)23.(2004·全国卷I.28)
有A、B、C、D、E、F、G7瓶
不同物质的溶液,它们各是
Na2CO3、Na2SO4、KCl、
AgNO3、MgCl2、Ca(NO3)2
和Ba(OH)2溶液中的一种。
为了鉴别,各取少量溶液进
行两两混合,实验结果如表所
示。表中“↓”表示生成的沉淀
或微溶化合物,“-”表示观察不到明显变化。试回答下面问题。
(1)A的化学式是 ,G的化学式是 。判断理由是 。
(2)写出其余几种物质的化学式。B: ,C: ,D: ,E: ,F: 。24.(2004·全国)29.(16分)恒温下,将a molN2与b mol H2的混合气体通入一个固定容积的密闭容器中,发生如下反应:
N2(g)+3H2(g) 2NH3(g)
(1)若反应进行到某时刻t时,nt(N2)=13 mol,nt(NH3)=6 mol,计算a的值。
(2)反应达平衡时,混合气体的体积为716.8L(标况下),其中NH3的含量(体积分数)为25%。计算平衡时NH3的物质的量。
(3)原混合气体与平衡混合气体的总物质的量之比(写最简整数比,下同),n(始):n(平)= 。
(4)原混合气体中,a:b= 。
(5)达到平衡时,N2和H2的转化率之比,α(N2): α(H2)= 。
(6)平衡混合气体中,n(N2):n(H2): n(NH3)= 。
2 0 0 3 年
25. (2003全国.30) (13分)根据图示填空
(1)化合物A含有的官能团是 。
(2)1mol A与2mo H2反应生成1moE,其反应方程式是 。
(3)与A具有相同官能团的A的同分异构体的结构简式是 。
(4)B在酸性条件下与Br2反应得到D,D的结构简式是 。
(5)F的结构简式是 。由E生成F的反应类型是 。26.(2003·全国卷)31.(13分)A、B、C是短周期ⅠA和ⅡA族元素的碳酸盐,它们的质量分别为 mA、mB、mC,与足量盐酸完全反应,消耗盐酸的物质的量分别为nA(HCl)、nB(HCl)、nC(HCl)。
已知:。mA=mB+mC,nA(HCl)=nB(HCl)+ nC(HCl)。请填空:
(1)写出短周期ⅠA和ⅡA族元素形成的所有碳酸盐的名称:
(2)若以MA、MB和MC分别表示A、B、C的相对分子质量,试写出MA、MB和MC三者的相互关系式 。
(3)A的正确选择有 种,其化学式为: 。
(4)若A和B为ⅡA族元素的碳酸盐,C为ⅠA族元素的碳酸盐,则A、B、C的化学式依次是 ,mB︰mC=1︰ 。(保留2位小数)27.(2003·全国卷)32.(11分)
X、Y、Z是短周期元素的三种常见氧化物。X跟水反应后可生成一种具有还原性的不稳定的二元酸,该酸的化学式是 ;Y和X的组成元素相同,Y的化学式是 ;1mol Z在加热时跟水反应的产物需要用6mol的氢氧化钠才能完全中和,Z的化学式是 ,其中和产物的化学式是 。在一定条件下,Y可以跟非金属单质A反应生成X和Z,其反应的化学方程式是 。 28.(2003·全国.33)用下面两种方法可以制得白色的Fe(OH)2沉淀。
方法一:用不含Fe3+的FeSO4溶液与用不含O2的蒸馏水配制的NaOH溶液反应制备。
(1)用硫酸亚铁晶体配制上述FeSO4溶液时还需加入 。
(2)除去蒸馏水中溶解的O2常采用 的方法。
(3)生成白色Fe(OH)2沉淀的操作是用长滴管吸取不含O2的NaOH溶液,插入FeSO4溶液液面下,再挤出NaOH溶液。这样操作的理由是 。
方法二:
在如图装置中,用NaOH溶液、铁屑、稀H2SO4等试剂制备。
(1)在试管Ⅰ里加入的试剂是 。
(2)在试管Ⅱ里加入的试剂是 。
(3)为了制得白色Fe(OH)2沉淀,在试管Ⅰ和Ⅱ中加入试剂,打开止水夹,塞紧塞子后的实验步骤是 。
(4)这样生成的Fe(OH)2沉淀能较长时间保持白色,其理由是 。
2 0 0 2 年
29(2002·全国)23.如图所示:
淀粉水解可产生某有机化合
物A,A在不同的氧化剂作用
下,可以生成B(C6H12O7)
或C(C6H10O8),B和C都
不能发生银镜反应。A、B、C都可以被强还原剂还原成为D(C6H14O6),B脱水可得到五元环的酯类化合物E或六元环的酯类化合物F。已知,相关物质被氧化的难易次序是:
RCHO最易,R—CH2OH次之, 最难。
请在下列空格中填写A、B、C、D、E、F的结构简式。
A: B: C:
D: E: F: 30.(2002·全国I卷.24)
在25℃,101kPa条件下,将15 L O2通入10 L CO和H2的混合气中,使其完全燃烧,干燥后,恢复至原来的温度和压强。
(1)若剩余气体的体积是15L,则原CO和H2的混合气中
V(CO)= L, V(H2)= L。
(2)若剩余气体的体积为a L,则原CO和H2的混合气中
V(CO)︰V(H2)= 。
(3)若剩余气体的体积为aL,则a的取值范围是 。31.(2002·全国.25)
已知:
①A、B、C、D四种物质均含元素X,有的还可能含有元素Y、Z。元素Y、X、Z的原子序数依次递增。
②X在A、B、C、D中都不呈现它的最高化合价。
③室温下单质A与某种常见一元强碱溶液反应,可得到B和C。
④化合物D受热催化分解,可制得元素Y的单质。
(1)元素X是 ,Z是 。
(2)写出③中反应的化学方程式: 。
(3)写出④中反应的化学方程式: 。 32.(2002·全国.28)制取氨气并完成喷泉实验(图中夹持装置均已略去)。
(1)写出实验室制取氨气前化学方程式: 。
(2)收集氨气应使用 法,要得到干燥的氨气可选用 做干燥剂。
(3)用图1装置进行喷泉实验,上部烧瓶已装满干燥氨气,引发水上喷的操作是 。该实验的原理是 。
(4)如果只提供如图2的装置,请说明引发喷泉的方法。 关键词
1.2006年高考新热点——置换反应。
2.2006命题热点——Na2O2 。
3.2007年北京、重庆、山东卷不约而同地从识 图跨跃到绘图。
4.2006年最大特点是通过创新试题的设计形式 来考查能力。
5.工艺流程题——2007年高考化学试题的新亮 点。
6.2008年实验探究型“小实验”题在考题中悄然增多。
7.2009年高考聚焦信息型化学方程式的书写。
8.2009年工艺流程题遍地开花。
命题规律
江西省高安中学 黄爱华 全国Ⅰ卷 (2007-2009)三年大题情况分析2009年全国高考理综(全国卷I)化学试题
1.凸显了“重视基础,联系课改,呈出综合,体现创新”等特点。
2.继续贯彻“稳中求美,稳中求改”的原则。
3.最为突出的特点之一就是强调了学科的基础性。
4.具有情景真实,知识整体性,思维探究性,难度有序性。
5. 是近几年最成功的一份试卷。
2 0 0 9 年1.2009全国Ⅰ卷 .27
浓H2SO4和木炭在加热时发生反应的化学方程式是2 H2SO4(浓) + C CO2↑+ 2 H2O + 2SO2↑请从下图中选用所需的仪器(可重复选用)组成一套进行该反应并检出反应产物的装置。现提供浓H2SO4 、木炭和酸性KMnO4溶液,其他固、液试剂自选。(连接和固定仪器用的玻璃管、胶管、铁夹、铁架台及加热装置等均略去)
将所选的仪器按连接顺序由上至下依次填入下表,并写出该仪器中应加试剂的名称及其作用。
选用的仪器(填字母) 加入的试剂 作用2.2009全国1卷28.
下图所示装置中,甲、乙、丙三个烧杯依次分别盛放100g 5.00%的NaOH溶液、足量的CuSO4溶液和100g 10.00%的K2SO4溶液,电极均为石墨电极。
接通电源,经过一段时间后,测得丙中
K2SO4浓度为10.47%,乙中c电极质量增
加。据此回答问题:
①电源的N端为 极;
②电极b上发生的电极反应为 ;
③列式计算电极b上生成的气体在标准状
态下的体积: ;
④电极c的质量变化是 g;
⑤电解前后各溶液的酸、碱性大小是否发生变化,简述其原因:
甲溶液 ;
乙溶液 ;
丙溶液 ;
(2)如果电解过程中铜全部析出,此时电解能否继续进行,为什么?
3.2009全国I卷29.
已知周期表中,元素Q、R、W、Y与元素X相邻。Y的最高化合价氧化物的水化物是强酸。回答下列问题:
(1)W与Q可以形成一种高温结构陶瓷材料。W的氯化物分子呈正四面体结构,W的氧化物的晶体类型是 ;
(2)Q的具有相同化合价且可以相互转变的氧化物是 ;
(3)R和Y形成的二元化合物中,R呈现最高化合价的化合物的化学式是 ;
(4)这5个元素的氢化物分子中,①立体结构类型相同的氢化物的沸点从高到低排列次序是(填化学式) ,其原因是
;
②电子总数相同的氢化物的化学式和立体结构分别是
;
(5)W和Q所形成的结构陶瓷材料的一种合成方法如下:W的氯化物与Q的氢化物加热反应,生成化合物W(QH2)4和HCl气体;W(QH2)4在高温下分解生成Q的氢化物和该陶瓷材料。上述相关反应的化学方程式(各物质用化学式表示)是 。4.2009全国Ⅰ卷 .30 化合物H是一种香料,存在于金橘中,可用如下路线合成:
已知:
R-CH=CH2(i)B2H6(ii)
H2O2/OH- R-CH2CH2OH(B2 H6为乙硼烷)
回答下列问题:(1)11.2L(标准状况)的烃A在氧气中充分燃烧可以产生88 g CO2和45 g H-2-O。
A的分子式是__
(2)B和C均为一氯代烃,它们的名称(系统命名)分别为_____;
(3)在催化剂存在下1 mol F与2 mol H-2反应,生成3-苯基-1-丙醇。F的结构简式是__
(4)反应①的反应类型是____;(5)反应②的化学方程式为______
(6)写出所有与G具有相同官能团的G的芳香类同分异构体的结构简式:_______
2 0 0 8 年
5.2008(全国Ⅰ卷) 26.
实验室可由软锰矿(主要成分为MnO2)制备KMnO4,方法如下:软锰矿和过量的固体KOH和ClO3在高温下反应,生成锰酸钾(K2MnO4)和KCl;用水溶解,滤去残渣,滤液酸化后,K2MnO4转变为MnO2和KMnO4;滤去MnO2沉淀,浓缩溶液,结晶得到深紫色的针状KMnO4。试回答:
(1)软锰矿制备K2MnO4的化学方程式是 ;
(2) K2MnO4制备 KMnO4的离子方程式是
;
(3)若用2.5g软锰矿(含MnO2 80%)进行上述实验,计算 KMnO4的理论产量:
(4) KMnO4能与热的经硫酸酸化的Na2C2O4反应,生成Mn2+和CO2,该反应的化学方程式是 ;
(5)上述制得的 KMnO4产品0.165g,恰好与0.335g纯Na2C2O4反应。计算该KMnO4的纯度。6.2008(全国Ⅰ卷) 27.
V、W、X、Y、Z是由周期表中1~20号部分元素组成的5种化合物,其中V、W、X、Z均为两种元素组成。上述5中化合物涉及的所有元素的原子序数之和等于35。它们之间的反应关系如下图:
(1)5种化合物分别是V 、W 、X 、 Y 、 Z ; (填化学式)
(2)由上述5中化合物中的某2种化合物反应可生成一种新化合物,它包含了5种化合物中的所有元素,生成该化合物的化学方程式是 ;
(3)V的电子式是 。7.2008(全国Ⅰ卷) 28.
取化学式为MZ的黄色粉末状化合物
进行如下实验。将MZ和足量的碳粉
充分混合物,平铺在反应管a中,在
b瓶中盛足量澄清石灰水。按图连接
仪器。实验开始时缓缓通入氮气,
过一段时间后,加热反应管a,观察
到管内发生剧烈反应,并有熔融物生成,同时,b瓶的溶液出现白色浑浊。待反应完全后,停止加热,仍继续通氮气,直至反应管冷却,此时,管中的熔融物凝固城银白色金属。根据以上叙述回答:
(1)元素Z是 ;
(2)停止加热前是否需要先断开a和b的连接处?为什么?
;
(3)反应管a中发生的所有反应的化学方程式是
;
(4)本实验的围棋是否需处理?如需处理,请回答如何处理;如不需处理,请说明理由。
。8.2008(全国Ⅰ卷) 29.
A、B、C、D、E、F和G都是有机化合物,它们的关系如下图所示:
(1)化合物C的分子式是C7H8O,C遇到FeCl3溶液显示紫色,C与溴水反应生成的一溴代物只有两种,则C的结构简式为 ;
(2)D为一直链化合物,其相对分子质量比化合物C的小20,它能跟NaHCO3反应放出CO2,则D分子式为 ,D具有的官能团是 ;
(3)反应①的化学方程式是 ;
(4)芳香化合物B是与A具有相同官能团的A的同分异构体,通过反应②化合物B能生成E和F,F可能的结构简式是 ;
(5)E可能的结构简式是 。
2 0 0 7 年
9.(2007年理综卷I).26
W、X、Y和Z都是周期表中前20号元素,已知:
①W的阳离子和Y的阴离子具有相同的核外电子排布,且能形成组成为WY的化合物;
②Y和Z属同族元素,它们能形成两种常见化合物;
③X和Z属同一周期元素,它们能形成两种气态化合物;
④W和X能形成组成为WX2的化合物;
⑤X和Y不在同一周期,它们能形成组成为XY2的化合物。
请回答:
(1)W元素是________;Z元素是_________。
(2)化合物WY和WX2的化学式分别是__________和___________。
(3)Y和Z形成的两种常见化合物的分子式是_________和_________。
(4)写出X和Z形成的一种气态化合物跟WZ反应的化学方程式___________________。10. (2007年理综卷I)27
A、B、C、D、E均为可溶于水的固体,组成它们的离子有
阳离子Na+、Mg2+、Al3+、Ba2+
阴离子OH—、Cl—、CO32—、SO42—、HSO4—、
分别取它们的水溶液进行实验,结果如下:
①A溶液与B溶液反应生成白色沉淀,沉淀可溶于E溶液;
②A溶液与C溶液反应生成白色沉淀,沉淀可溶于E溶液;
③A溶液与D溶液反应生成白色沉淀,沉淀可溶于盐酸;
④B溶液与适量D溶液反应生成白色沉淀,加入过量D溶液,沉淀量减小,但不消失。
据此推断它们是A__________;B___________;C__________;D___________;E___________。
11.(2007年理综卷I)28水蒸气通过灼热的焦碳后,流出气体的主要成分是CO和H2,还有CO2和水蒸气等。请用下图中提供的仪器,选择必要的试剂,设计一个实验,证明上述混合气中有CO和H2。(加热装置和导管等在图中略去)水和沸石
回答下列问题:
(1)盛浓H2SO4的装置用途是____,
盛NaOH溶液的装置用途是____。
(2)仪器B中需加入试剂的名称(或
化学式)是____,所发生反应的化
学方程式是_____。
(3)仪器C中需加入试剂的名称(或化学式)是____,其目的_______。
(4)按气流方向连接各仪器,用字母表示接口的连接顺序:g—ab—_______。
(5)能证明混合气中含有CO的实验依据是_____。
(6)能证明混合气中含有H2的实验依据是_______。`12. (2007年理综卷I)29
下图中A、B、C、D、E、F、G均为有机化合物。
根据上图回答问题:
(1)D的化学名称是______。
(2)反应③的化学方程式是_______
(有机物须用结构简式表示)
(3)B的分子式是_________。A的结构简式是______。反应①的反应类型是_______。
(4)符合下列3个条件的B的同分异构体的数目有_______个。
①含有邻二取代苯环结构;②与B有相同官能团;③不与FeCl3溶液发生显色反应。
写出其中任意一个同分异构体的结构简式________。
(5)G是重要的工业原料,用化学方程式表示G的一种重要的工业用途。_______。
2 0 0 6 年
13.(2006·全国.26)
X、Y、Z和W代表原子序数依次增大的四种短周期元素,它们满足以下条件:
①元素周期表中,Z与Y相邻,Z与W也相邻;
②Y、Z和W三种元素的原子最外层电子数之和为17。
请填空:
⑴Y、Z和W三种元素是否位于同一周期(填“是”或“否”): ,理由是 ;
⑵Y是 ,Z是 ,W是 ;
⑶X、Y、Z和W可组成一化合物,其原子个数之比为8:2:4:1。写出该化合物的名称及化学式 。14.(2006·全国.27)
置换反应的通式可以表示为:
单质⑴+化合物⑴===化合物⑵+单质⑵
请写出满足以下要求的3个置换反应的化学方程式:
①所涉及的元素的原子序数都小于20;
②6种单质分属于6个不同的主族。15.(2006·全国.28)在呼吸面具和潜水艇中可用过氧化钠作为供氧剂。请选用适当的化学试剂和实验用品,用下图中的实验装置进行实验,证明过氧化钠可作供氧剂。
⑴A是制取CO2的装置。写出A中发生反应的化学方程式 。
⑵填写表中空格
⑶写出过氧化钠与二氧化碳反应的化学方程式 。
⑷试管F中收集满气体后,下一步实验操作是: 。解答:⑴CaCO3+2HCl===CaCl2+CO2↑+H2O
⑵)
⑶2Na2O2+2CO2===2Na2CO3+O2
⑷把E中的导管移出水面,关闭分液漏斗活塞,用拇指堵住试管口,取出试管,立即把带有火星的木条伸入试管口内,木条复燃,证明试管中收集的气体是氧气。
16.(2006·全国)29.(21分)
萨罗(Salol)是一种消毒剂,它的分子式为C13H10O3,其分子模型如下图所示(图中球与球之间的连线代表化学键,如单键、双键等);
⑴根据右图模型写出萨罗的结构简式: 。
⑵萨罗经水解、分离、提纯可得到纯净的苯酚和水杨酸(邻羟基苯甲酸)。请设计一个方案,说明苯酚、碳酸、水杨酸的酸性依次增强(用化学方程式表示)。
⑶同时符合下列四个要求的水杨本的同分异构体共有 。
①含有苯环
②能发生银镜反应,不能发生水解反应;
③在稀NaOH溶液中,1 mol该同分异构体能与2 molNaOH发生反应;
④只能生成两种一氯代产物。
⑷从⑶确定的同分异构体中任选一种,指定为下列框图中的A。
写出下列四个反应的化学方程式(有机物用结构简式表示),并指出相应的反应类型。
①A→B 。反应类型: 。
②B+D→E 。反应类型: 。
⑸现有水杨酸和苯酚的混合物,它们的物质的量之和为n mol。该混合物完全燃烧消耗a L O2,并生成b g H2O和c L CO2(气体体积均为标准状况下的体积)。
①分别写出水杨酸和苯酚完全燃烧的化学方程式(有机物可用分子式表示)。
②设混合物中水杨酸的物质的量为x mol,列出x 的计算式。
2 0 0 5 年
17.(2005·全国.26)
已知A、B、C、D为气体,E、F为固体,G是氯化钙,它们之间的转换关系如下图如示:
(1)D的化学式(分子式)是 ,E的化学式(分子式)是
(2)A和B反应生成C的化学方程式是
(3)E和F反应生成D、H和G的化学主程式是 18.(2005·全国)27.(15分)甲、乙、丙、丁为前三周期元素形成的微粒,它们的电子总数相等。已知甲、乙、丙为双原子分子或负二价双原子阴离子,丁为原子。
(1) 丙与钙离子组成的离子化合物跟水反应产生一种可燃性气体,反应的化学方程式是 。
(2) 乙在高温时是一种还原剂,请用化学方程式表示它在工业上的一种重要用途: 。
(3) 在一定条件下,甲与O2反应的化学方程式是 。
(4) 丁的元素符号是 ,它的原子结构示意图为 。
(5) 丁的氧化物的晶体结构与 的晶体结构相似。19.( 2005·全国.28)已知某纯碱试样中含有NaCl杂质,为测定试样中纯碱的质量分数,可用下图中的装置进行实验。
主要实验步骤如下:
① 按图组装仪器,并检查装置的气密性
② 将a g试样放入锥形瓶中,加适量蒸馏水溶解,得到试样溶液
③ 称量盛有碱石灰的U型管的质量,得到b g
④ 从分液漏斗滴入6 mol·L?1的硫酸,直到不再产生气体时为止
⑤ 从导管A处缓缓鼓入一定量的空气
⑥ 再次称量盛有碱石灰的U型管的质量,得到c g
⑦ 重复步骤⑤和⑥的操作,直到U型管的质量基本不变,为d g
请填空和回答问题:
(1) 在用托盘天平称量样品时,如果天平的指针向左偏转,说明 。
(2) 装置中干燥管B的作用是 。
(3) 如果将分液漏斗中的硫酸换成浓度相同的盐酸,测试的结果 (填偏高、偏低或不变)。
(4) 步骤⑤的目的是 。
(5) 步骤⑦的目的是 。
(6) 该试样中纯碱的质量分数的计算式为 。
(7) 还可以用其他实验方法测定试样中纯碱的质量分数。请简述一种不同的实验方法20.(2005·全国)29.苏丹红一号(sudanⅠ)是一种偶氮染料,不能作为食品添加剂使用。它是由苯胺和2—萘酚为主要原料制备的,它们的结构简式如下所示:
(苏丹红一号) (苯胺) (2—萘酚)
(1) 苏丹红一号的化学式(分子式)为 。
(2) 在下面化合物(A)~(D)中,与2—萘酚互为同分异构体的有(填字母代号) 。
(提示: 可表示为 )
(A) (B) (C) (D)
(3) 上述化合物(C)含有的官能团是 。
(4) 在适当的条件下,2—萘酚经反应可得到芳香化合物E(C8H6O4),1 mol E与适量的碳酸氢钠溶液反应可放出二氧化碳44.8 L(标准状况),E与溴在有催化剂存在时反应只能生成两种一溴取代物,两种一溴取代物的结构简式分别是 ,E与碳酸氢钠反应的化学方程式是 。
(5) 若将E与足量乙醇在浓硫酸作用下加热,可以生成一个化学式(分子式)为C12H14O4的新化合物,该反应的化学方程式是 ,反应类型是 。
2 0 0 4 年
21.(2004·全国.26)某有机物A的结构简式如下:
(1)A的分子式是 。
(2)A在NaOH水溶液中加热反应得到B和C,C是芳香族化合物。
B和C的结构简式是B:________________ C: 。该反应属于 反应。
(3)室温下,C用稀盐酸酸化得到E,E的结构简式是 。
(4)在下列物质中,不能与E发生化学反应的是(填写序号) 。
①浓H2SO4和浓HNO3的混合液 ②CH3CH2OH(酸催化)
③CH3CH2CH2CH3 ④Na ⑤CH3COOH(酸催化)
(5)写出同时符合下列两项要求的E的所有同分异构体的结构简式。
①化合物是1,3,5,-三取代苯
②苯环上的三个取代基分别是甲基、羟基和含有 结构的基团。22.(2004·全国卷I.27) 电解原理在化学工业
中有广泛应用。右图表示一个电解池,装
有电解液a;X、Y是两块电极板,通过导
线与直流电源相连。请回答以下问题:
(1)若X、Y都是惰性电极,a是饱和NaCl
溶液,实验开始时,同时在两边各滴入几滴
酚酞试液,则
①电解池中X极上的电极反应式为 。在X极附近观察到的现象是 。
②Y电极上的电极反应式为 ,检验该电极反应产物的方法是 。
(2)如要用电解方法精炼粗铜,电解液a选用CuSO4溶液
①X的电极材料是 ,电极反应式为 。
②Y电极的材料是 ,电极反应式为 。(说明:杂质发生的电极反应不必写出)23.(2004·全国卷I.28)
有A、B、C、D、E、F、G7瓶
不同物质的溶液,它们各是
Na2CO3、Na2SO4、KCl、
AgNO3、MgCl2、Ca(NO3)2
和Ba(OH)2溶液中的一种。
为了鉴别,各取少量溶液进
行两两混合,实验结果如表所
示。表中“↓”表示生成的沉淀
或微溶化合物,“-”表示观察不到明显变化。试回答下面问题。
(1)A的化学式是 ,G的化学式是 。判断理由是 。
(2)写出其余几种物质的化学式。B: ,C: ,D: ,E: ,F: 。24.(2004·全国)29.(16分)恒温下,将a molN2与b mol H2的混合气体通入一个固定容积的密闭容器中,发生如下反应:
N2(g)+3H2(g) 2NH3(g)
(1)若反应进行到某时刻t时,nt(N2)=13 mol,nt(NH3)=6 mol,计算a的值。
(2)反应达平衡时,混合气体的体积为716.8L(标况下),其中NH3的含量(体积分数)为25%。计算平衡时NH3的物质的量。
(3)原混合气体与平衡混合气体的总物质的量之比(写最简整数比,下同),n(始):n(平)= 。
(4)原混合气体中,a:b= 。
(5)达到平衡时,N2和H2的转化率之比,α(N2): α(H2)= 。
(6)平衡混合气体中,n(N2):n(H2): n(NH3)= 。
2 0 0 3 年
25. (2003全国.30) (13分)根据图示填空
(1)化合物A含有的官能团是 。
(2)1mol A与2mo H2反应生成1moE,其反应方程式是 。
(3)与A具有相同官能团的A的同分异构体的结构简式是 。
(4)B在酸性条件下与Br2反应得到D,D的结构简式是 。
(5)F的结构简式是 。由E生成F的反应类型是 。26.(2003·全国卷)31.(13分)A、B、C是短周期ⅠA和ⅡA族元素的碳酸盐,它们的质量分别为 mA、mB、mC,与足量盐酸完全反应,消耗盐酸的物质的量分别为nA(HCl)、nB(HCl)、nC(HCl)。
已知:。mA=mB+mC,nA(HCl)=nB(HCl)+ nC(HCl)。请填空:
(1)写出短周期ⅠA和ⅡA族元素形成的所有碳酸盐的名称:
(2)若以MA、MB和MC分别表示A、B、C的相对分子质量,试写出MA、MB和MC三者的相互关系式 。
(3)A的正确选择有 种,其化学式为: 。
(4)若A和B为ⅡA族元素的碳酸盐,C为ⅠA族元素的碳酸盐,则A、B、C的化学式依次是 ,mB︰mC=1︰ 。(保留2位小数)27.(2003·全国卷)32.(11分)
X、Y、Z是短周期元素的三种常见氧化物。X跟水反应后可生成一种具有还原性的不稳定的二元酸,该酸的化学式是 ;Y和X的组成元素相同,Y的化学式是 ;1mol Z在加热时跟水反应的产物需要用6mol的氢氧化钠才能完全中和,Z的化学式是 ,其中和产物的化学式是 。在一定条件下,Y可以跟非金属单质A反应生成X和Z,其反应的化学方程式是 。 28.(2003·全国.33)用下面两种方法可以制得白色的Fe(OH)2沉淀。
方法一:用不含Fe3+的FeSO4溶液与用不含O2的蒸馏水配制的NaOH溶液反应制备。
(1)用硫酸亚铁晶体配制上述FeSO4溶液时还需加入 。
(2)除去蒸馏水中溶解的O2常采用 的方法。
(3)生成白色Fe(OH)2沉淀的操作是用长滴管吸取不含O2的NaOH溶液,插入FeSO4溶液液面下,再挤出NaOH溶液。这样操作的理由是 。
方法二:
在如图装置中,用NaOH溶液、铁屑、稀H2SO4等试剂制备。
(1)在试管Ⅰ里加入的试剂是 。
(2)在试管Ⅱ里加入的试剂是 。
(3)为了制得白色Fe(OH)2沉淀,在试管Ⅰ和Ⅱ中加入试剂,打开止水夹,塞紧塞子后的实验步骤是 。
(4)这样生成的Fe(OH)2沉淀能较长时间保持白色,其理由是 。
2 0 0 2 年
29(2002·全国)23.如图所示:
淀粉水解可产生某有机化合
物A,A在不同的氧化剂作用
下,可以生成B(C6H12O7)
或C(C6H10O8),B和C都
不能发生银镜反应。A、B、C都可以被强还原剂还原成为D(C6H14O6),B脱水可得到五元环的酯类化合物E或六元环的酯类化合物F。已知,相关物质被氧化的难易次序是:
RCHO最易,R—CH2OH次之, 最难。
请在下列空格中填写A、B、C、D、E、F的结构简式。
A: B: C:
D: E: F: 30.(2002·全国I卷.24)
在25℃,101kPa条件下,将15 L O2通入10 L CO和H2的混合气中,使其完全燃烧,干燥后,恢复至原来的温度和压强。
(1)若剩余气体的体积是15L,则原CO和H2的混合气中
V(CO)= L, V(H2)= L。
(2)若剩余气体的体积为a L,则原CO和H2的混合气中
V(CO)︰V(H2)= 。
(3)若剩余气体的体积为aL,则a的取值范围是 。31.(2002·全国.25)
已知:
①A、B、C、D四种物质均含元素X,有的还可能含有元素Y、Z。元素Y、X、Z的原子序数依次递增。
②X在A、B、C、D中都不呈现它的最高化合价。
③室温下单质A与某种常见一元强碱溶液反应,可得到B和C。
④化合物D受热催化分解,可制得元素Y的单质。
(1)元素X是 ,Z是 。
(2)写出③中反应的化学方程式: 。
(3)写出④中反应的化学方程式: 。 32.(2002·全国.28)制取氨气并完成喷泉实验(图中夹持装置均已略去)。
(1)写出实验室制取氨气前化学方程式: 。
(2)收集氨气应使用 法,要得到干燥的氨气可选用 做干燥剂。
(3)用图1装置进行喷泉实验,上部烧瓶已装满干燥氨气,引发水上喷的操作是 。该实验的原理是 。
(4)如果只提供如图2的装置,请说明引发喷泉的方法。 关键词
1.2006年高考新热点——置换反应。
2.2006命题热点——Na2O2 。
3.2007年北京、重庆、山东卷不约而同地从识 图跨跃到绘图。
4.2006年最大特点是通过创新试题的设计形式 来考查能力。
5.工艺流程题——2007年高考化学试题的新亮 点。
6.2008年实验探究型“小实验”题在考题中悄然增多。
7.2009年高考聚焦信息型化学方程式的书写。
8.2009年工艺流程题遍地开花。
同课章节目录
