江西高考实验题回顾
图片预览


文档简介
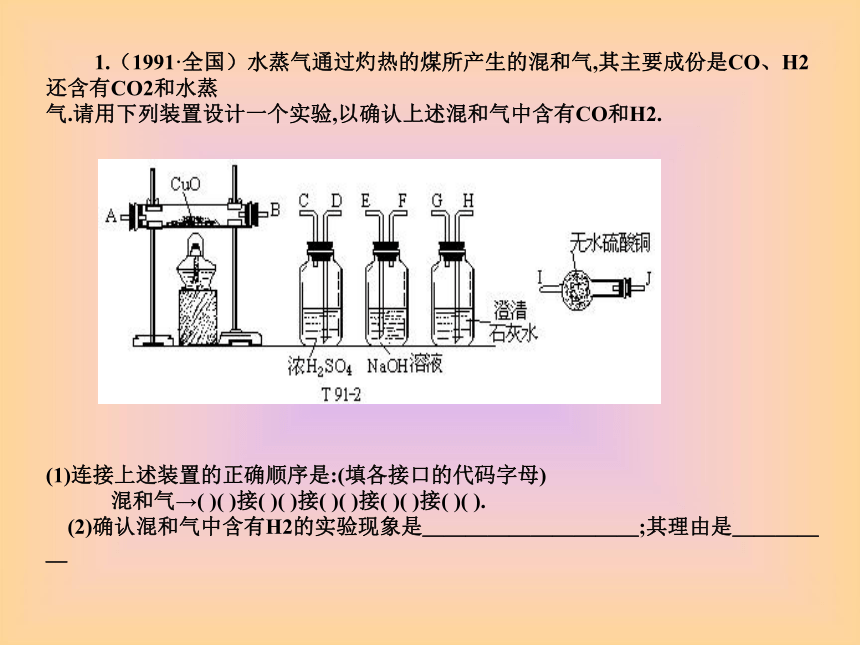
课件18张PPT。 江西高考实验题回顾 1.(1991·全国)水蒸气通过灼热的煤所产生的混和气,其主要成份是CO、H2还含有CO2和水蒸
气.请用下列装置设计一个实验,以确认上述混和气中含有CO和H2.
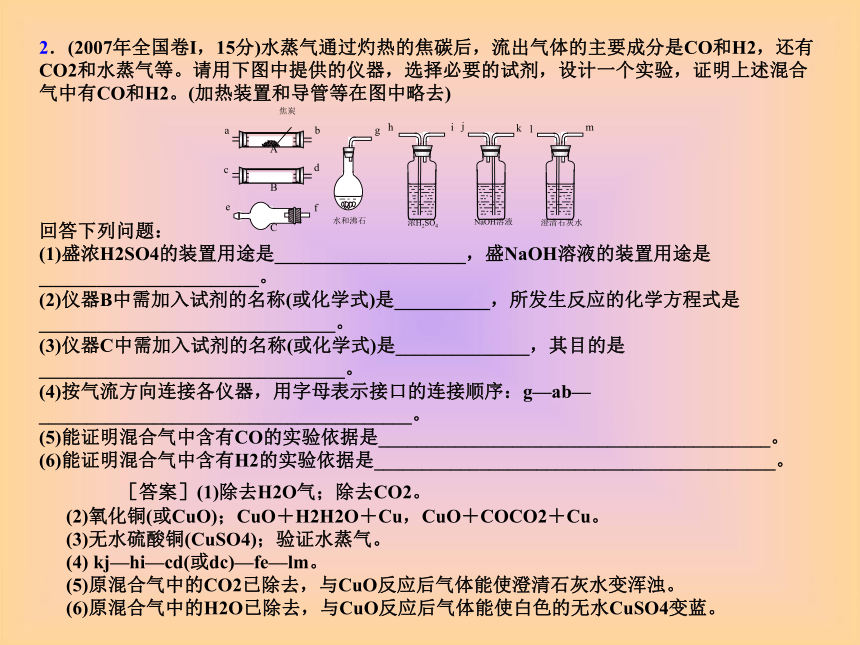
(1)连接上述装置的正确顺序是:(填各接口的代码字母) 混和气→( )( )接( )( )接( )( )接( )( )接( )( ). (2)确认混和气中含有H2的实验现象是__________;其理由是_____2.(2007年全国卷I,15分)水蒸气通过灼热的焦碳后,流出气体的主要成分是CO和H2,还有CO2和水蒸气等。请用下图中提供的仪器,选择必要的试剂,设计一个实验,证明上述混合气中有CO和H2。(加热装置和导管等在图中略去)
回答下列问题:
(1)盛浓H2SO4的装置用途是____________________,盛NaOH溶液的装置用途是_______________________。
(2)仪器B中需加入试剂的名称(或化学式)是__________,所发生反应的化学方程式是_______________________________。
(3)仪器C中需加入试剂的名称(或化学式)是______________,其目的是________________________________。
(4)按气流方向连接各仪器,用字母表示接口的连接顺序:g—ab—_______________________________________。
(5)能证明混合气中含有CO的实验依据是_________________________________________。
(6)能证明混合气中含有H2的实验依据是__________________________________________。 [答案](1)除去H2O气;除去CO2。
(2)氧化铜(或CuO);CuO+H2H2O+Cu,CuO+COCO2+Cu。
(3)无水硫酸铜(CuSO4);验证水蒸气。
(4) kj—hi—cd(或dc)—fe—lm。
(5)原混合气中的CO2已除去,与CuO反应后气体能使澄清石灰水变浑浊。
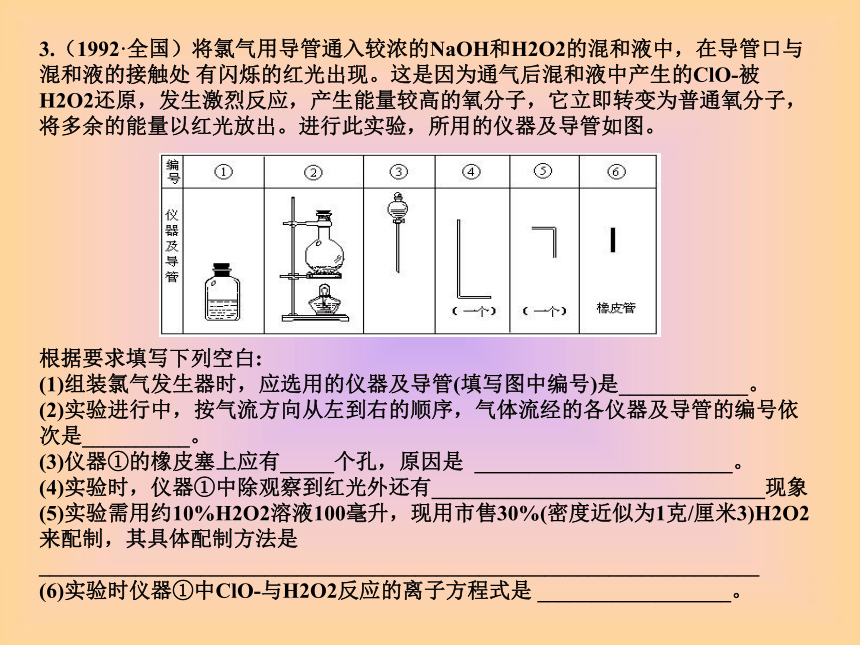
(6)原混合气中的H2O已除去,与CuO反应后气体能使白色的无水CuSO4变蓝。 3.(1992·全国)将氯气用导管通入较浓的NaOH和H2O2的混和液中,在导管口与混和液的接触处 有闪烁的红光出现。这是因为通气后混和液中产生的ClO-被H2O2还原,发生激烈反应,产生能量较高的氧分子,它立即转变为普通氧分子,将多余的能量以红光放出。进行此实验,所用的仪器及导管如图。
根据要求填写下列空白:
(1)组装氯气发生器时,应选用的仪器及导管(填写图中编号)是____________。
(2)实验进行中,按气流方向从左到右的顺序,气体流经的各仪器及导管的编号依次是__________。
(3)仪器①的橡皮塞上应有_____个孔,原因是 ________________________。
(4)实验时,仪器①中除观察到红光外还有_______________________________现象
(5)实验需用约10%H2O2溶液100毫升,现用市售30%(密度近似为1克/厘米3)H2O2来配制,其具体配制方法是 ___________________________________________________________________
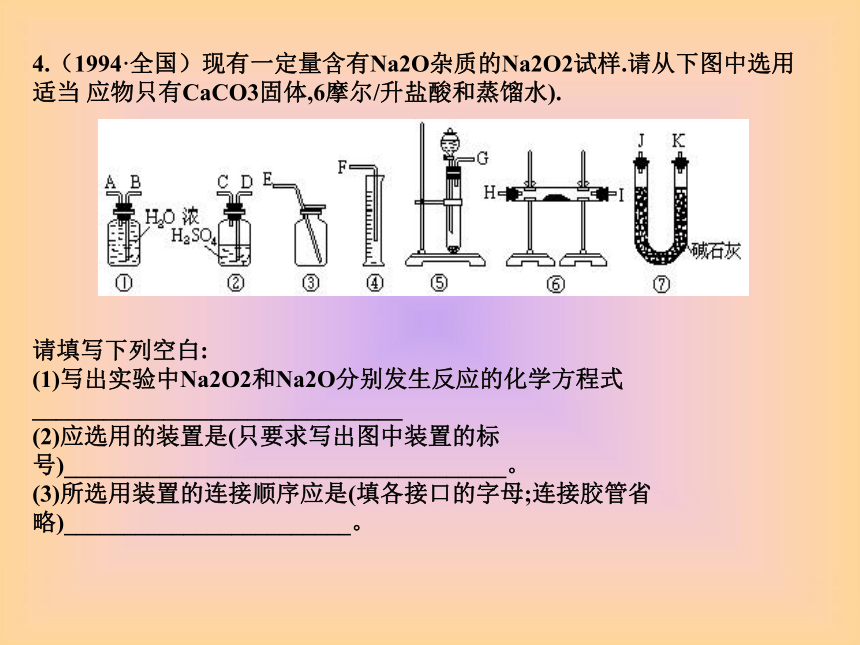
(6)实验时仪器①中ClO-与H2O2反应的离子方程式是 __________________。 4.(1994·全国)现有一定量含有Na2O杂质的Na2O2试样.请从下图中选用适当 应物只有CaCO3固体,6摩尔/升盐酸和蒸馏水).
请填写下列空白: (1)写出实验中Na2O2和Na2O分别发生反应的化学方程式_______________________________ (2)应选用的装置是(只要求写出图中装置的标号)_____________________________________。 (3)所选用装置的连接顺序应是(填各接口的字母;连接胶管省略)________________________。 (2004·上海)26.某种含有少量氧化钠的过氧化钠试样(已知试样质量为1.560g、锥形瓶和水的质量
190.720g),利用左图装置测定混合物中Na2O2的质量分数,每隔相同时间读得电子天平的数据如表:
(1)写出Na2O2和H2O反应的化学方程式
(2)计算过氧化钠质量分数时,必需的数据是
不必作第6次读数的原因是
(3)测定上述样品(1.560g)中Na2O2质量分数的另一种方案,其操作流程如下:
①操作Ⅱ的名称是
②需直接测定的物理量是
③测定过程中需要的仪器有电子天平、蒸发皿、酒精灯,还需要 、
(固定、夹持仪器除外)
④在转移溶液时,如溶液转移不完全,则Na2O2质量分数的测定结果
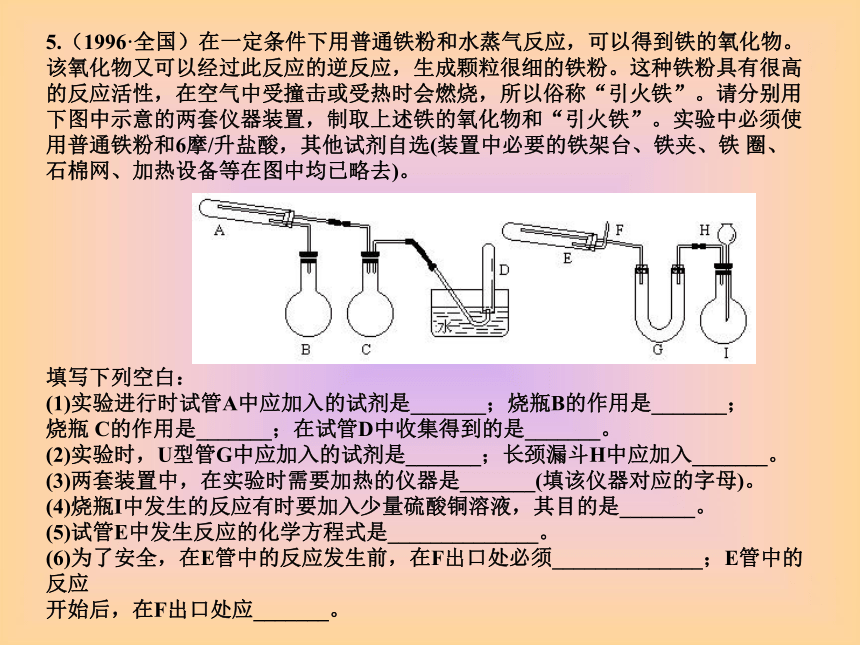
(填偏大、偏小或不变)。5.(1996·全国)在一定条件下用普通铁粉和水蒸气反应,可以得到铁的氧化物。该氧化物又可以经过此反应的逆反应,生成颗粒很细的铁粉。这种铁粉具有很高的反应活性,在空气中受撞击或受热时会燃烧,所以俗称“引火铁”。请分别用下图中示意的两套仪器装置,制取上述铁的氧化物和“引火铁”。实验中必须使用普通铁粉和6摩/升盐酸,其他试剂自选(装置中必要的铁架台、铁夹、铁 圈、石棉网、加热设备等在图中均已略去)。
填写下列空白: (1)实验进行时试管A中应加入的试剂是_______;烧瓶B的作用是_______;
烧瓶 C的作用是_______;在试管D中收集得到的是_______。 (2)实验时,U型管G中应加入的试剂是_______;长颈漏斗H中应加入_______。 (3)两套装置中,在实验时需要加热的仪器是_______(填该仪器对应的字母)。 (4)烧瓶I中发生的反应有时要加入少量硫酸铜溶液,其目的是_______。 (5)试管E中发生反应的化学方程式是______________。 (6)为了安全,在E管中的反应发生前,在F出口处必须______________;E管中的反应
开始后,在F出口处应_______。 6.(1998·全国)测定一定质量的铝锌合金与强酸溶液反应产生的氢气的体积,可以求得合金中铝和锌的质量分数。现有下列实验用品:中学化学实验常用仪器、800毫升烧杯、100毫升量筒、短颈玻璃漏斗、铜网、铝锌合金样品、浓盐酸(密度1.19克/毫升)、水。按图示装置进行实验,回答下列问题。(设合金样品完全反应,产生的气体体积不超过100毫升) (1)补充下列实验步骤,直到反应开始进行(铁架台和铁夹的安装可省略): ①将称量后的合金样品用铜网小心包裹好,放在800毫升烧杯底部,把短颈漏斗倒扣在样品上面。
(2)合金样品用铜网包裹的目的是: 7.(2000·江西)某学生课外活动小组利用下图所示装置分别做如下实验:
在试管中注入某红色溶液,加热试管,溶液颜色逐渐变浅,冷却后恢复红色,则原溶液可能是_______溶液:加热时溶液由红色逐渐变浅的原因是:______________________。
在试管中注入某无色溶液,加热试管,溶液变为红色,冷却后恢复无色,则此溶液可能是________溶液;加热时溶液由无色变为红色的原因是:________________________。
8.(2000·全国.24)实验室可用氯气与金属铁反应制备无水三氯化铁,该化合物是棕红色、易潮解,100℃左右时升华。下图是两个学生设计的实验装置、左边的反应装置相同,而右边的产品收集装置则不同,分别如(Ⅰ)和(Ⅱ)所示。试回答:
(1)B中反应的化学方程式
为:___
(2)D中的反应开始前,需
排除装置中的空气,应采取
的方法是:__________。
(3)D中反应化学方程式为:_____。
(4)装置(Ⅰ)的主要缺点是:___ 。
(5)装置(Ⅱ)的主要缺点是:________。
如果选用此装置来完成实验,则必须采取的改进措施是:________________________。 9.(2002·全国)制取氨气并完成喷泉实验(图中夹持装置均已略去)。
(1)写出实验室制取氨气前化学方程式: 。
(2)收集氨气应使用 法,要得到干燥的氨气可选用 做干燥剂。
(3)用图1装置进行喷泉实验,上部烧瓶已装满干燥氨气,引发水上喷的操作是 。该实验的原理是 。
(4)如果只提供如图2的装置,请说明引发喷泉的方法。 10.(2003·全国)用下面两种方法可以制得白色的Fe(OH)2沉淀。
方法一:用不含Fe3+的FeSO4溶液与用不含O2的蒸馏水配制的NaOH溶液反应制备。
(1)用硫酸亚铁晶体配制上述FeSO4溶液时还需加入 。
(2)除去蒸馏水中溶解的O2常采用 的方法。
(3)生成白色Fe(OH)2沉淀的操作是用长滴管吸取不含O2的NaOH溶液,插入FeSO4溶液液面下,再挤出NaOH溶液。这样操作的理由是 。
方法二:
在如图装置中,用NaOH溶液、铁屑、稀H2SO4等试剂制备。
(1)在试管Ⅰ里加入的试剂是 。
(2)在试管Ⅱ里加入的试剂是 。
(3)为了制得白色Fe(OH)2沉淀,在试管Ⅰ和Ⅱ中加入试剂,打开止水夹,塞紧塞子后的实验步骤是 。
(4)这样生成的Fe(OH)2沉淀能较长时间保持白色,其理由是 。11.( 2005·全国)已知某纯碱试样中含有NaCl杂质,为测定试样中纯碱的质量分数,可用下图中的装置进行实验。
主要实验步骤如下:
① 按图组装仪器,并检查装置的气密性
② 将a g试样放入锥形瓶中,加适量蒸馏水溶解,得到试样溶液
③ 称量盛有碱石灰的U型管的质量,得到b g
④ 从分液漏斗滴入6 mol·L?1的硫酸,直到不再产生气体时为止
⑤ 从导管A处缓缓鼓入一定量的空气
⑥ 再次称量盛有碱石灰的U型管的质量,得到c g
⑦ 重复步骤⑤和⑥的操作,直到U型管的质量基本不变,为d g
请填空和回答问题:
(1) 在用托盘天平称量样品时,如果天平的指针向左偏转,说明 。
(2) 装置中干燥管B的作用是 。
(3) 如果将分液漏斗中的硫酸换成浓度相同的盐酸,测试的结果 (填偏高、偏低或不变)。
(4) 步骤⑤的目的是 。
(5) 步骤⑦的目的是 。
(6) 该试样中纯碱的质量分数的计算式为 。
(7) 还可以用其他实验方法测定试样中纯碱的质量分数。请简述一种不同的实验方法12.(2006·全国)在呼吸面具和潜水艇中可用过氧化钠作为供氧剂。请选用适当的化学试剂和实验用品,用下图中的实验装置进行实验,证明过氧化钠可作供氧剂。
⑴A是制取CO2的装置。写出A中发生反应的化学方程式 。
⑵填写表中空格
⑶写出过氧化钠与二氧化碳反应的化学方程式 。
⑷试管F中收集满气体后,下一步实验操作是: 。解答:⑴CaCO3+2HCl===CaCl2+CO2↑+H2O
⑵)
⑶2Na2O2+2CO2===2Na2CO3+O2
⑷把E中的导管移出水面,关闭分液漏斗活塞,用拇指堵住试管口,取出试管,立即把带有火星的木条伸入试管口内,木条复燃,证明试管中收集的气体是氧气。
13.2008(全国Ⅰ卷)
取化学式为MZ的黄色粉末状化合物进行如下实验。将MZ和足量的碳粉充分混合物,平铺在反应管a中,在b瓶中盛足量澄清石灰水。按图连接仪器。
实验开始时缓缓通入氮气,过一段时间后,加热反应管a,观察到管内发生剧烈反应,并有熔融物生成,同时,b瓶的溶液出现白色浑浊。待反应完全后,停止加热,仍继
续通氮气,直至反应管冷却,此时,
管中的熔融物凝固城银白色金属。
根据以叙述回答:(1)元素Z是 ;
(2)停止加热前是否需要先断开a和
的连接处?为什么? ;
(3)反应管a中发生的所有反应的化学
方程式是 ;
(4)本实验的围棋是否需处理?如需处理,
请回答如何处理;如不需处理,请说明理由。 。14.2009全国Ⅰ卷
浓H2SO4和木炭在加热时发生反应的化学方程式是2 H2SO4 (浓) + C CO2↑+ 2 H2O + 2SO2↑请从下图中选用所需的仪器(可重复选用)组成一套进行该反应并检出反应产物的装置。现提供浓H2SO4、木炭和酸性KMnO4溶液,其他固、液试剂自选。(连接和固定仪器用的玻璃管、胶管、铁夹、铁架台及加热装置等均略去)
将所选的仪器按连接顺序由上至下依次填入下表,并写出该仪器中应加试剂的名称及其作用。
选用的仪器(填字母) 加入的试剂 作用15. 2009年广东卷 某工厂生产硼砂过程中产生的固体废料,主要含有MgCO3、MgSiO3、 CaMg(CO3)2、Al2O3和Fe2O3等,回收其中镁的工艺流程如下:
沉淀物 Fe(OH)3 Al(OH)3 Mg(OH)2
PH 3.2 5.2 12.4
部分阳离子以氢氧化物形式完全深沉时溶液的pH由见上表,请回答下列问题:
(1)“浸出”步骤中,为提高镁的浸出率,可采取的措施有 (要求写出两条)。
(2)滤渣I的主要成分有 。 (3)从滤渣Ⅱ中可回收利用的主要物质有 。
(4)Mg(ClO3)2在农业上可用作脱叶剂、催熟剂,可采用复分解反应制备:
MgCl2+2NaClO3===Mg(ClO3)2+2NaCl
已知四种化合物的溶解度(S)随温度(T)变化曲线如下图所示:
①将反应物按化学反应方程式计量数比混合制备Mg(ClO3)2。简述可制备Mg(ClO3)2的原因: 。
②按①中条件进行制备实验。在冷却降温析出Mg(ClO3)2过程中,常伴有NaCl析出,原因是: 。除去产品中该杂质的方法是: 。关键词
1.高考化学实验题的题材:源于教材、源于教材实验的改进,源于科学研究,研究性学习。
2.纵观这几年的化学高考实验题,处处都有课本实验的影子。
3.这些实验考题要么出现在课本中的学生实验,要么出现在课本中的演示实验,要么是将课本中有关物质的制备或性质的理论知识转变为实验。
4.以相互联系的课本实验为素材,向小课题研究方向发展。广义地讲:一个化学实验就是一个微型的课题。
5.重要的化学知识与实验“相伴而生”是现行高中教材的一个重要特点。
6.化学解题应审好实验装置图
7.实验复习中要做好联想、掘新工作
8.“入微”与“创新”化学实验考试的高境界
9.使用化学标准语言
10.准确解读实验题中的“命题语言”
11.新瓶装旧酒,高考用陈题
12.丰富实验功能,积累实验经验,提高动手能力
13.教师只讲做法不讲理,学生只知其然不知其所以然的局面必须改变,学习不能只是单纯地积累静态的科学结论,同时要将静态的知识转化为动态的认知过程。
14.百闻不如一见、百看不如一验。
气.请用下列装置设计一个实验,以确认上述混和气中含有CO和H2.
(1)连接上述装置的正确顺序是:(填各接口的代码字母) 混和气→( )( )接( )( )接( )( )接( )( )接( )( ). (2)确认混和气中含有H2的实验现象是__________;其理由是_____2.(2007年全国卷I,15分)水蒸气通过灼热的焦碳后,流出气体的主要成分是CO和H2,还有CO2和水蒸气等。请用下图中提供的仪器,选择必要的试剂,设计一个实验,证明上述混合气中有CO和H2。(加热装置和导管等在图中略去)
回答下列问题:
(1)盛浓H2SO4的装置用途是____________________,盛NaOH溶液的装置用途是_______________________。
(2)仪器B中需加入试剂的名称(或化学式)是__________,所发生反应的化学方程式是_______________________________。
(3)仪器C中需加入试剂的名称(或化学式)是______________,其目的是________________________________。
(4)按气流方向连接各仪器,用字母表示接口的连接顺序:g—ab—_______________________________________。
(5)能证明混合气中含有CO的实验依据是_________________________________________。
(6)能证明混合气中含有H2的实验依据是__________________________________________。 [答案](1)除去H2O气;除去CO2。
(2)氧化铜(或CuO);CuO+H2H2O+Cu,CuO+COCO2+Cu。
(3)无水硫酸铜(CuSO4);验证水蒸气。
(4) kj—hi—cd(或dc)—fe—lm。
(5)原混合气中的CO2已除去,与CuO反应后气体能使澄清石灰水变浑浊。
(6)原混合气中的H2O已除去,与CuO反应后气体能使白色的无水CuSO4变蓝。 3.(1992·全国)将氯气用导管通入较浓的NaOH和H2O2的混和液中,在导管口与混和液的接触处 有闪烁的红光出现。这是因为通气后混和液中产生的ClO-被H2O2还原,发生激烈反应,产生能量较高的氧分子,它立即转变为普通氧分子,将多余的能量以红光放出。进行此实验,所用的仪器及导管如图。
根据要求填写下列空白:
(1)组装氯气发生器时,应选用的仪器及导管(填写图中编号)是____________。
(2)实验进行中,按气流方向从左到右的顺序,气体流经的各仪器及导管的编号依次是__________。
(3)仪器①的橡皮塞上应有_____个孔,原因是 ________________________。
(4)实验时,仪器①中除观察到红光外还有_______________________________现象
(5)实验需用约10%H2O2溶液100毫升,现用市售30%(密度近似为1克/厘米3)H2O2来配制,其具体配制方法是 ___________________________________________________________________
(6)实验时仪器①中ClO-与H2O2反应的离子方程式是 __________________。 4.(1994·全国)现有一定量含有Na2O杂质的Na2O2试样.请从下图中选用适当 应物只有CaCO3固体,6摩尔/升盐酸和蒸馏水).
请填写下列空白: (1)写出实验中Na2O2和Na2O分别发生反应的化学方程式_______________________________ (2)应选用的装置是(只要求写出图中装置的标号)_____________________________________。 (3)所选用装置的连接顺序应是(填各接口的字母;连接胶管省略)________________________。 (2004·上海)26.某种含有少量氧化钠的过氧化钠试样(已知试样质量为1.560g、锥形瓶和水的质量
190.720g),利用左图装置测定混合物中Na2O2的质量分数,每隔相同时间读得电子天平的数据如表:
(1)写出Na2O2和H2O反应的化学方程式
(2)计算过氧化钠质量分数时,必需的数据是
不必作第6次读数的原因是
(3)测定上述样品(1.560g)中Na2O2质量分数的另一种方案,其操作流程如下:
①操作Ⅱ的名称是
②需直接测定的物理量是
③测定过程中需要的仪器有电子天平、蒸发皿、酒精灯,还需要 、
(固定、夹持仪器除外)
④在转移溶液时,如溶液转移不完全,则Na2O2质量分数的测定结果
(填偏大、偏小或不变)。5.(1996·全国)在一定条件下用普通铁粉和水蒸气反应,可以得到铁的氧化物。该氧化物又可以经过此反应的逆反应,生成颗粒很细的铁粉。这种铁粉具有很高的反应活性,在空气中受撞击或受热时会燃烧,所以俗称“引火铁”。请分别用下图中示意的两套仪器装置,制取上述铁的氧化物和“引火铁”。实验中必须使用普通铁粉和6摩/升盐酸,其他试剂自选(装置中必要的铁架台、铁夹、铁 圈、石棉网、加热设备等在图中均已略去)。
填写下列空白: (1)实验进行时试管A中应加入的试剂是_______;烧瓶B的作用是_______;
烧瓶 C的作用是_______;在试管D中收集得到的是_______。 (2)实验时,U型管G中应加入的试剂是_______;长颈漏斗H中应加入_______。 (3)两套装置中,在实验时需要加热的仪器是_______(填该仪器对应的字母)。 (4)烧瓶I中发生的反应有时要加入少量硫酸铜溶液,其目的是_______。 (5)试管E中发生反应的化学方程式是______________。 (6)为了安全,在E管中的反应发生前,在F出口处必须______________;E管中的反应
开始后,在F出口处应_______。 6.(1998·全国)测定一定质量的铝锌合金与强酸溶液反应产生的氢气的体积,可以求得合金中铝和锌的质量分数。现有下列实验用品:中学化学实验常用仪器、800毫升烧杯、100毫升量筒、短颈玻璃漏斗、铜网、铝锌合金样品、浓盐酸(密度1.19克/毫升)、水。按图示装置进行实验,回答下列问题。(设合金样品完全反应,产生的气体体积不超过100毫升) (1)补充下列实验步骤,直到反应开始进行(铁架台和铁夹的安装可省略): ①将称量后的合金样品用铜网小心包裹好,放在800毫升烧杯底部,把短颈漏斗倒扣在样品上面。
(2)合金样品用铜网包裹的目的是: 7.(2000·江西)某学生课外活动小组利用下图所示装置分别做如下实验:
在试管中注入某红色溶液,加热试管,溶液颜色逐渐变浅,冷却后恢复红色,则原溶液可能是_______溶液:加热时溶液由红色逐渐变浅的原因是:______________________。
在试管中注入某无色溶液,加热试管,溶液变为红色,冷却后恢复无色,则此溶液可能是________溶液;加热时溶液由无色变为红色的原因是:________________________。
8.(2000·全国.24)实验室可用氯气与金属铁反应制备无水三氯化铁,该化合物是棕红色、易潮解,100℃左右时升华。下图是两个学生设计的实验装置、左边的反应装置相同,而右边的产品收集装置则不同,分别如(Ⅰ)和(Ⅱ)所示。试回答:
(1)B中反应的化学方程式
为:___
(2)D中的反应开始前,需
排除装置中的空气,应采取
的方法是:__________。
(3)D中反应化学方程式为:_____。
(4)装置(Ⅰ)的主要缺点是:___ 。
(5)装置(Ⅱ)的主要缺点是:________。
如果选用此装置来完成实验,则必须采取的改进措施是:________________________。 9.(2002·全国)制取氨气并完成喷泉实验(图中夹持装置均已略去)。
(1)写出实验室制取氨气前化学方程式: 。
(2)收集氨气应使用 法,要得到干燥的氨气可选用 做干燥剂。
(3)用图1装置进行喷泉实验,上部烧瓶已装满干燥氨气,引发水上喷的操作是 。该实验的原理是 。
(4)如果只提供如图2的装置,请说明引发喷泉的方法。 10.(2003·全国)用下面两种方法可以制得白色的Fe(OH)2沉淀。
方法一:用不含Fe3+的FeSO4溶液与用不含O2的蒸馏水配制的NaOH溶液反应制备。
(1)用硫酸亚铁晶体配制上述FeSO4溶液时还需加入 。
(2)除去蒸馏水中溶解的O2常采用 的方法。
(3)生成白色Fe(OH)2沉淀的操作是用长滴管吸取不含O2的NaOH溶液,插入FeSO4溶液液面下,再挤出NaOH溶液。这样操作的理由是 。
方法二:
在如图装置中,用NaOH溶液、铁屑、稀H2SO4等试剂制备。
(1)在试管Ⅰ里加入的试剂是 。
(2)在试管Ⅱ里加入的试剂是 。
(3)为了制得白色Fe(OH)2沉淀,在试管Ⅰ和Ⅱ中加入试剂,打开止水夹,塞紧塞子后的实验步骤是 。
(4)这样生成的Fe(OH)2沉淀能较长时间保持白色,其理由是 。11.( 2005·全国)已知某纯碱试样中含有NaCl杂质,为测定试样中纯碱的质量分数,可用下图中的装置进行实验。
主要实验步骤如下:
① 按图组装仪器,并检查装置的气密性
② 将a g试样放入锥形瓶中,加适量蒸馏水溶解,得到试样溶液
③ 称量盛有碱石灰的U型管的质量,得到b g
④ 从分液漏斗滴入6 mol·L?1的硫酸,直到不再产生气体时为止
⑤ 从导管A处缓缓鼓入一定量的空气
⑥ 再次称量盛有碱石灰的U型管的质量,得到c g
⑦ 重复步骤⑤和⑥的操作,直到U型管的质量基本不变,为d g
请填空和回答问题:
(1) 在用托盘天平称量样品时,如果天平的指针向左偏转,说明 。
(2) 装置中干燥管B的作用是 。
(3) 如果将分液漏斗中的硫酸换成浓度相同的盐酸,测试的结果 (填偏高、偏低或不变)。
(4) 步骤⑤的目的是 。
(5) 步骤⑦的目的是 。
(6) 该试样中纯碱的质量分数的计算式为 。
(7) 还可以用其他实验方法测定试样中纯碱的质量分数。请简述一种不同的实验方法12.(2006·全国)在呼吸面具和潜水艇中可用过氧化钠作为供氧剂。请选用适当的化学试剂和实验用品,用下图中的实验装置进行实验,证明过氧化钠可作供氧剂。
⑴A是制取CO2的装置。写出A中发生反应的化学方程式 。
⑵填写表中空格
⑶写出过氧化钠与二氧化碳反应的化学方程式 。
⑷试管F中收集满气体后,下一步实验操作是: 。解答:⑴CaCO3+2HCl===CaCl2+CO2↑+H2O
⑵)
⑶2Na2O2+2CO2===2Na2CO3+O2
⑷把E中的导管移出水面,关闭分液漏斗活塞,用拇指堵住试管口,取出试管,立即把带有火星的木条伸入试管口内,木条复燃,证明试管中收集的气体是氧气。
13.2008(全国Ⅰ卷)
取化学式为MZ的黄色粉末状化合物进行如下实验。将MZ和足量的碳粉充分混合物,平铺在反应管a中,在b瓶中盛足量澄清石灰水。按图连接仪器。
实验开始时缓缓通入氮气,过一段时间后,加热反应管a,观察到管内发生剧烈反应,并有熔融物生成,同时,b瓶的溶液出现白色浑浊。待反应完全后,停止加热,仍继
续通氮气,直至反应管冷却,此时,
管中的熔融物凝固城银白色金属。
根据以叙述回答:(1)元素Z是 ;
(2)停止加热前是否需要先断开a和
的连接处?为什么? ;
(3)反应管a中发生的所有反应的化学
方程式是 ;
(4)本实验的围棋是否需处理?如需处理,
请回答如何处理;如不需处理,请说明理由。 。14.2009全国Ⅰ卷
浓H2SO4和木炭在加热时发生反应的化学方程式是2 H2SO4 (浓) + C CO2↑+ 2 H2O + 2SO2↑请从下图中选用所需的仪器(可重复选用)组成一套进行该反应并检出反应产物的装置。现提供浓H2SO4、木炭和酸性KMnO4溶液,其他固、液试剂自选。(连接和固定仪器用的玻璃管、胶管、铁夹、铁架台及加热装置等均略去)
将所选的仪器按连接顺序由上至下依次填入下表,并写出该仪器中应加试剂的名称及其作用。
选用的仪器(填字母) 加入的试剂 作用15. 2009年广东卷 某工厂生产硼砂过程中产生的固体废料,主要含有MgCO3、MgSiO3、 CaMg(CO3)2、Al2O3和Fe2O3等,回收其中镁的工艺流程如下:
沉淀物 Fe(OH)3 Al(OH)3 Mg(OH)2
PH 3.2 5.2 12.4
部分阳离子以氢氧化物形式完全深沉时溶液的pH由见上表,请回答下列问题:
(1)“浸出”步骤中,为提高镁的浸出率,可采取的措施有 (要求写出两条)。
(2)滤渣I的主要成分有 。 (3)从滤渣Ⅱ中可回收利用的主要物质有 。
(4)Mg(ClO3)2在农业上可用作脱叶剂、催熟剂,可采用复分解反应制备:
MgCl2+2NaClO3===Mg(ClO3)2+2NaCl
已知四种化合物的溶解度(S)随温度(T)变化曲线如下图所示:
①将反应物按化学反应方程式计量数比混合制备Mg(ClO3)2。简述可制备Mg(ClO3)2的原因: 。
②按①中条件进行制备实验。在冷却降温析出Mg(ClO3)2过程中,常伴有NaCl析出,原因是: 。除去产品中该杂质的方法是: 。关键词
1.高考化学实验题的题材:源于教材、源于教材实验的改进,源于科学研究,研究性学习。
2.纵观这几年的化学高考实验题,处处都有课本实验的影子。
3.这些实验考题要么出现在课本中的学生实验,要么出现在课本中的演示实验,要么是将课本中有关物质的制备或性质的理论知识转变为实验。
4.以相互联系的课本实验为素材,向小课题研究方向发展。广义地讲:一个化学实验就是一个微型的课题。
5.重要的化学知识与实验“相伴而生”是现行高中教材的一个重要特点。
6.化学解题应审好实验装置图
7.实验复习中要做好联想、掘新工作
8.“入微”与“创新”化学实验考试的高境界
9.使用化学标准语言
10.准确解读实验题中的“命题语言”
11.新瓶装旧酒,高考用陈题
12.丰富实验功能,积累实验经验,提高动手能力
13.教师只讲做法不讲理,学生只知其然不知其所以然的局面必须改变,学习不能只是单纯地积累静态的科学结论,同时要将静态的知识转化为动态的认知过程。
14.百闻不如一见、百看不如一验。
同课章节目录
