从微观结构看物质的多样性
图片预览









文档简介
课件47张PPT。第三单元从微观结构看物质的多样性交流讨论1由同一种元素组成的物质一定是纯净物吗?世界最大的绿色钻石41克拉 (8.2克) (1克拉=0.2克)碳元素的单质金刚石石墨一、同素异形现象1.同素异形现象与同素异形体(P18)
同一种元素能形成几种不同的单质,这种现象称为同素异形现象,这些单质互称为同素异形体
注意:
(1)同种元素
(2)不同单质2.几种常见元素的同素异形体
(1)碳元素的同素异形体
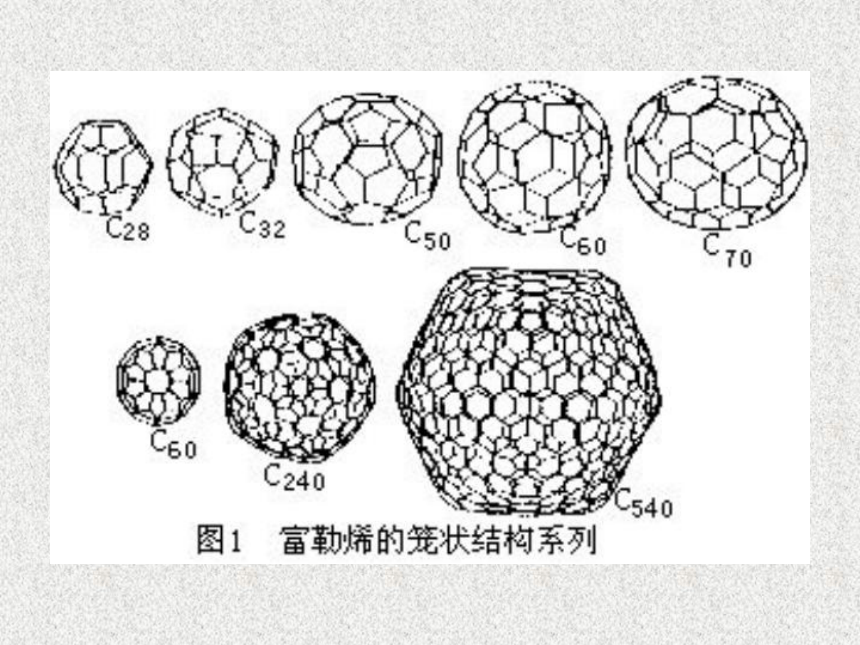
金刚石、石墨、富勒烯…(C60、C70、纳米碳管等)讨论如何证明金刚石和石墨是同素异形体
证明同素:
相互转化
在氧气中完全燃烧都只生成CO2
证明异形:
结构、性质不同石墨在15000个大气压,2000~3000摄氏度隔绝空气的条件下可转变为金刚石。
每个原子都与相邻4个原子以共价键结合成空间网状结构1、层状结构,每一层是正六边形的网状结构、C-C共价键
2、层与层之间:分子间作用力相结合
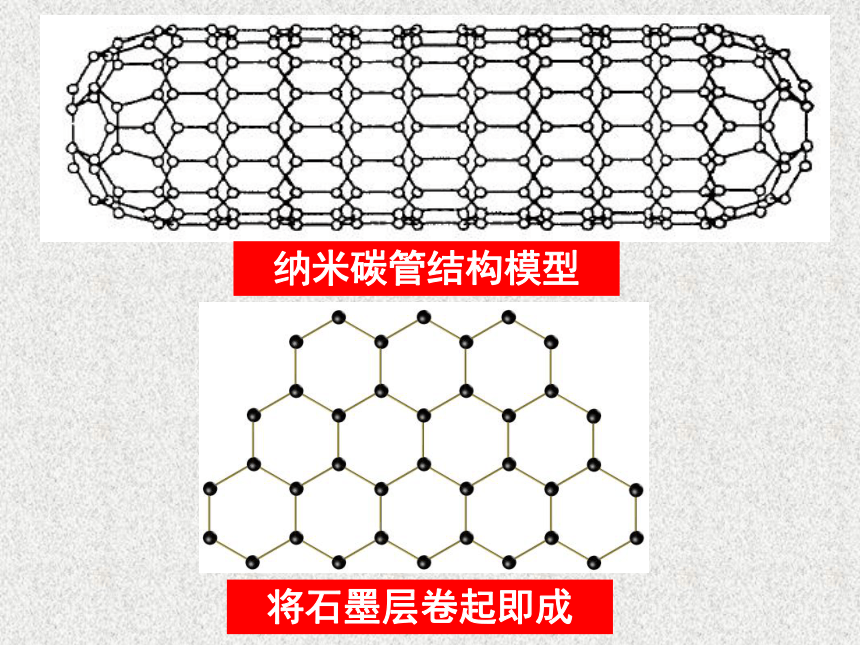
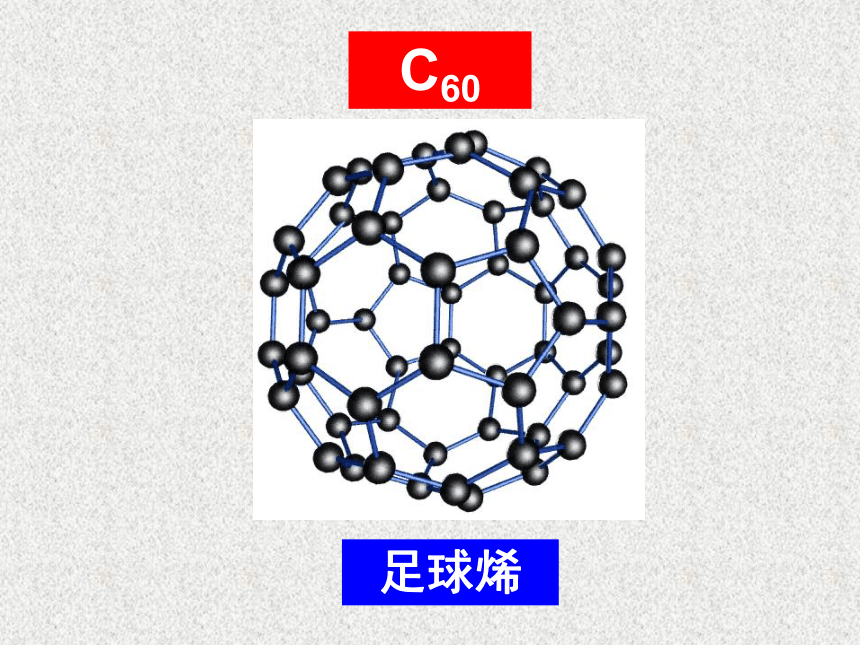
金刚石与石墨的对比空间网状结构层状结构很大较软不导电能导电很高很高纳米碳管结构模型将石墨层卷起即成C60足球烯(2)氧元素的同素异形体淡蓝色
鱼腥味
气体无色
无味
气体极强氧化性强氧化性O2O3放电或紫外光氯原子或NOx臭氧空洞的扩大原因:
危害:
废气(NO)和氟里昂的排放直接危害人体健康,像皮肤癌、白内障、
各种传染病患者会大幅度增加;
(2) 对生态环境和农林牧渔业造成破坏,农产
品减产、渔业产量减少、森林覆盖率减少等。
(3)磷元素的同素异形体(P20)白色蜡状固体红棕色固体P4复杂正四面体复杂剧毒无毒低(自燃)较高(不自燃)水中密封②磷的同素异形体的结构:拓展:白磷红磷相互转化知识小结 1、同素异形体:化学性质相似,物理性质差异较大;在一定条件下可相互转化。 2、同素异形现象是原子的成键方式和排列方式不同造成的。 3、同素异形现象是物质多样性的原因之一。同 分 异 构 现 象乙醇二甲醚【观察与思考】1.写出它们的化学式
2.甲醚是气体,几乎不溶于水;乙醇即酒精,是液体,能以任何比例与水混溶. bp=78℃bp=-23℃二、同分异构现象(P21)
化合物具有相同的分子式,但具有不同结构的现象,叫做同分异构现象。
分子式相同而结构不同的化合物互称为同分异构体
强调
同分:
异构:相同的分子式
结构不同的性质不同丁烷结构思考1.写出两种“丁烷”的分子式
2.它们是否同种物质?正丁烷异丁烷- 0.5℃- 11.7℃沸点名称59183575366319*同分异构现象是有机物种类繁多的最主要的原因质子数相同,中子数不同的核素同种元素形成的不同种单质分子式相同,而结构不同的化合物原子单质化合物质子数同种元素分子式中子数结构结构2、有下列各组物质:
6C与6C 金刚石与石墨 乙醇与二甲醚。
(1)互为同位素的是
(2)互为同素异形体的是
(3)互为同分异构体的是1213CH3CHCH2CH3CH3 ② ③
④①②③④1、判断下列各组物质之间的关系
①1H与2H
②金刚石与C70
③水银与汞
④乙醇与甲醚
⑤ O2与O3
⑥ NH4CNO与CO(NH2)2
⑦课堂练习4、科学家最近发现一种新分子,具有空心类似足球状的结构,其化学式为C60。下列说法不正确的是( )
A.C60是一种化合物 B.它的摩尔质量为720
C.它的化学性质和金刚石 相似 D.C60和金刚石、石墨一样,都是由碳元素组成的单质ABB晶态固体明矾水晶金
刚
石干冰雪花冰糖离子晶体分子晶体原子晶体金属晶体一、不同类型的晶体
晶体的概念(P22)
有规则几何外形的固体
晶体有规则几何外形的原因(P22)
构成微粒在空间有规律的重复排列
【思考】食盐、干冰、金刚石等晶体分别是由什么微粒通过什么作用聚集而成?
晶体的分类晶体分类依据:
构成微粒
相互作用1.离子晶体
概念
离子间通过离子键结合而成的晶体
构成微粒:
相互作用:
思考1:哪些类型物质固态时为离子晶体?
思考2:离子晶体中有无(小)分子?
思考3:离子晶体中含什么相互作用力?
思考4:离子晶体熔化时克服什么作用?
思考5:NaCl晶体中各离子有何排列规律?阴阳离子
离子键2.原子晶体
概念:原子间通过共价键结
合而成的空间网状结构的晶体
构成微粒:
相互作用:
空间结构:
存在范围:
思考1:原子晶体中有无(小)分子?
思考2:原子晶体中含什么相互作用力?
思考3:原子晶体熔化时克服什么作用?原子
共价键
空间网状
主要四种水晶几种原子晶体的结构金刚石晶体硅金刚砂晶体中每个碳原子与 个碳原子以 键相连,这几个碳原子构成 结构。A、每个Si原子与 个O原子通过 键结合;每个O原子与 Si原子结合。B、若将每个硅原子所连接的4个O原子连接起来,将构成 结构。二氧化硅C、该结构与晶体硅的结构有何关系?3.分子晶体
概念
分子间通过范氏力结合而成的晶体
构成微粒:
相互作用:
思考1:哪些类型物质固态时为分子晶体?
非金属单质
共价化合物
除(少数几种)原子晶体外分子
分子间作用力思考2:分子晶体中含什么相互作用力?
思考3:分子晶体熔化时克服什么作用?
思考4:0族的单质固态时是什么类型晶体?
思考5:干冰晶体中各分子有何排列规律?类型分子离子原子金属微粒分子离子原子离子、电子作用分子间作用力离子键共价键金属键形成规律非金属单质
共价化合物
(除…)离子化合物常见4种固态金属单质熔沸点很低较高很高难说水溶性不一定不一定难溶难溶导电性固液溶不不不导不导不导可能导--几种晶体对比2、分析物质的物理性质,判断其晶体类型:
A、碳化铝,黄色晶体,熔点2200℃,熔融态不导电;___________
B、溴化铝,无色晶体,熔点98 ℃,熔融态不导电;___________
C、五氟化钒,无色晶体,熔点19.5℃,易溶于乙醇、氯仿、丙酮中;_______________
D、物质A,无色晶体,熔融时或溶于水中都能导电_____________原子晶体分子晶体分子晶体离子晶体4、判断下列物质固态时的晶体类型、构成微粒以及晶体中存在的相互作用.
硫酸、水、铁、BaSO4、金刚石、氦
二氧化碳、二氧化硅、Na2O、硝酸钾物质的种类繁多,除了同素异形现象以及同分异构现象有关外,还与与晶体类型、结构的多样性有关晶体熔、沸点的比较不同类型:原子晶体 > 离子晶体 > 分子晶体同种类型:微粒间的作用越强,熔沸点越高原子晶体:原子半径越小,共价键越强,
熔沸点越高离子晶体:离子电荷数越多,离子半径越小,离子键越强,熔沸点越高一般而言:分子晶体:当组成结构相同时,相对分子质量越大,范氏力越强,熔沸点越高3、请将下列物质的熔沸点按由低到高的顺序排列:
①?I2 ②Cl2 ③NaCl ④SiO2 ⑤H2O
同一种元素能形成几种不同的单质,这种现象称为同素异形现象,这些单质互称为同素异形体
注意:
(1)同种元素
(2)不同单质2.几种常见元素的同素异形体
(1)碳元素的同素异形体
金刚石、石墨、富勒烯…(C60、C70、纳米碳管等)讨论如何证明金刚石和石墨是同素异形体
证明同素:
相互转化
在氧气中完全燃烧都只生成CO2
证明异形:
结构、性质不同石墨在15000个大气压,2000~3000摄氏度隔绝空气的条件下可转变为金刚石。
每个原子都与相邻4个原子以共价键结合成空间网状结构1、层状结构,每一层是正六边形的网状结构、C-C共价键
2、层与层之间:分子间作用力相结合
金刚石与石墨的对比空间网状结构层状结构很大较软不导电能导电很高很高纳米碳管结构模型将石墨层卷起即成C60足球烯(2)氧元素的同素异形体淡蓝色
鱼腥味
气体无色
无味
气体极强氧化性强氧化性O2O3放电或紫外光氯原子或NOx臭氧空洞的扩大原因:
危害:
废气(NO)和氟里昂的排放直接危害人体健康,像皮肤癌、白内障、
各种传染病患者会大幅度增加;
(2) 对生态环境和农林牧渔业造成破坏,农产
品减产、渔业产量减少、森林覆盖率减少等。
(3)磷元素的同素异形体(P20)白色蜡状固体红棕色固体P4复杂正四面体复杂剧毒无毒低(自燃)较高(不自燃)水中密封②磷的同素异形体的结构:拓展:白磷红磷相互转化知识小结 1、同素异形体:化学性质相似,物理性质差异较大;在一定条件下可相互转化。 2、同素异形现象是原子的成键方式和排列方式不同造成的。 3、同素异形现象是物质多样性的原因之一。同 分 异 构 现 象乙醇二甲醚【观察与思考】1.写出它们的化学式
2.甲醚是气体,几乎不溶于水;乙醇即酒精,是液体,能以任何比例与水混溶. bp=78℃bp=-23℃二、同分异构现象(P21)
化合物具有相同的分子式,但具有不同结构的现象,叫做同分异构现象。
分子式相同而结构不同的化合物互称为同分异构体
强调
同分:
异构:相同的分子式
结构不同的性质不同丁烷结构思考1.写出两种“丁烷”的分子式
2.它们是否同种物质?正丁烷异丁烷- 0.5℃- 11.7℃沸点名称59183575366319*同分异构现象是有机物种类繁多的最主要的原因质子数相同,中子数不同的核素同种元素形成的不同种单质分子式相同,而结构不同的化合物原子单质化合物质子数同种元素分子式中子数结构结构2、有下列各组物质:
6C与6C 金刚石与石墨 乙醇与二甲醚。
(1)互为同位素的是
(2)互为同素异形体的是
(3)互为同分异构体的是1213CH3CHCH2CH3CH3 ② ③
④①②③④1、判断下列各组物质之间的关系
①1H与2H
②金刚石与C70
③水银与汞
④乙醇与甲醚
⑤ O2与O3
⑥ NH4CNO与CO(NH2)2
⑦课堂练习4、科学家最近发现一种新分子,具有空心类似足球状的结构,其化学式为C60。下列说法不正确的是( )
A.C60是一种化合物 B.它的摩尔质量为720
C.它的化学性质和金刚石 相似 D.C60和金刚石、石墨一样,都是由碳元素组成的单质ABB晶态固体明矾水晶金
刚
石干冰雪花冰糖离子晶体分子晶体原子晶体金属晶体一、不同类型的晶体
晶体的概念(P22)
有规则几何外形的固体
晶体有规则几何外形的原因(P22)
构成微粒在空间有规律的重复排列
【思考】食盐、干冰、金刚石等晶体分别是由什么微粒通过什么作用聚集而成?
晶体的分类晶体分类依据:
构成微粒
相互作用1.离子晶体
概念
离子间通过离子键结合而成的晶体
构成微粒:
相互作用:
思考1:哪些类型物质固态时为离子晶体?
思考2:离子晶体中有无(小)分子?
思考3:离子晶体中含什么相互作用力?
思考4:离子晶体熔化时克服什么作用?
思考5:NaCl晶体中各离子有何排列规律?阴阳离子
离子键2.原子晶体
概念:原子间通过共价键结
合而成的空间网状结构的晶体
构成微粒:
相互作用:
空间结构:
存在范围:
思考1:原子晶体中有无(小)分子?
思考2:原子晶体中含什么相互作用力?
思考3:原子晶体熔化时克服什么作用?原子
共价键
空间网状
主要四种水晶几种原子晶体的结构金刚石晶体硅金刚砂晶体中每个碳原子与 个碳原子以 键相连,这几个碳原子构成 结构。A、每个Si原子与 个O原子通过 键结合;每个O原子与 Si原子结合。B、若将每个硅原子所连接的4个O原子连接起来,将构成 结构。二氧化硅C、该结构与晶体硅的结构有何关系?3.分子晶体
概念
分子间通过范氏力结合而成的晶体
构成微粒:
相互作用:
思考1:哪些类型物质固态时为分子晶体?
非金属单质
共价化合物
除(少数几种)原子晶体外分子
分子间作用力思考2:分子晶体中含什么相互作用力?
思考3:分子晶体熔化时克服什么作用?
思考4:0族的单质固态时是什么类型晶体?
思考5:干冰晶体中各分子有何排列规律?类型分子离子原子金属微粒分子离子原子离子、电子作用分子间作用力离子键共价键金属键形成规律非金属单质
共价化合物
(除…)离子化合物常见4种固态金属单质熔沸点很低较高很高难说水溶性不一定不一定难溶难溶导电性固液溶不不不导不导不导可能导--几种晶体对比2、分析物质的物理性质,判断其晶体类型:
A、碳化铝,黄色晶体,熔点2200℃,熔融态不导电;___________
B、溴化铝,无色晶体,熔点98 ℃,熔融态不导电;___________
C、五氟化钒,无色晶体,熔点19.5℃,易溶于乙醇、氯仿、丙酮中;_______________
D、物质A,无色晶体,熔融时或溶于水中都能导电_____________原子晶体分子晶体分子晶体离子晶体4、判断下列物质固态时的晶体类型、构成微粒以及晶体中存在的相互作用.
硫酸、水、铁、BaSO4、金刚石、氦
二氧化碳、二氧化硅、Na2O、硝酸钾物质的种类繁多,除了同素异形现象以及同分异构现象有关外,还与与晶体类型、结构的多样性有关晶体熔、沸点的比较不同类型:原子晶体 > 离子晶体 > 分子晶体同种类型:微粒间的作用越强,熔沸点越高原子晶体:原子半径越小,共价键越强,
熔沸点越高离子晶体:离子电荷数越多,离子半径越小,离子键越强,熔沸点越高一般而言:分子晶体:当组成结构相同时,相对分子质量越大,范氏力越强,熔沸点越高3、请将下列物质的熔沸点按由低到高的顺序排列:
①?I2 ②Cl2 ③NaCl ④SiO2 ⑤H2O
