化学能与电能
图片预览



文档简介
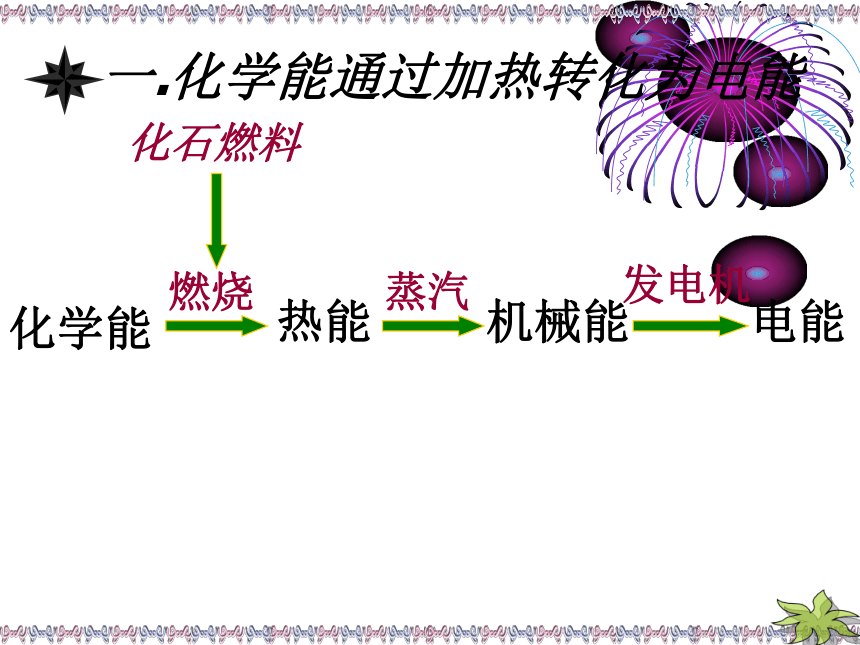
课件30张PPT。一.化学能通过加热转化为电能化学能燃烧热能蒸汽机械能发电机电能化石燃料锌表面有气泡产生,铜表面无明显现象1.反应中,哪种物质失电子,哪种物质得电子?2.Zn是通过什么途径将电子转移给溶液中H+的?
3.什么方法可使Zn与H+分开,不让H+直接在Zn表
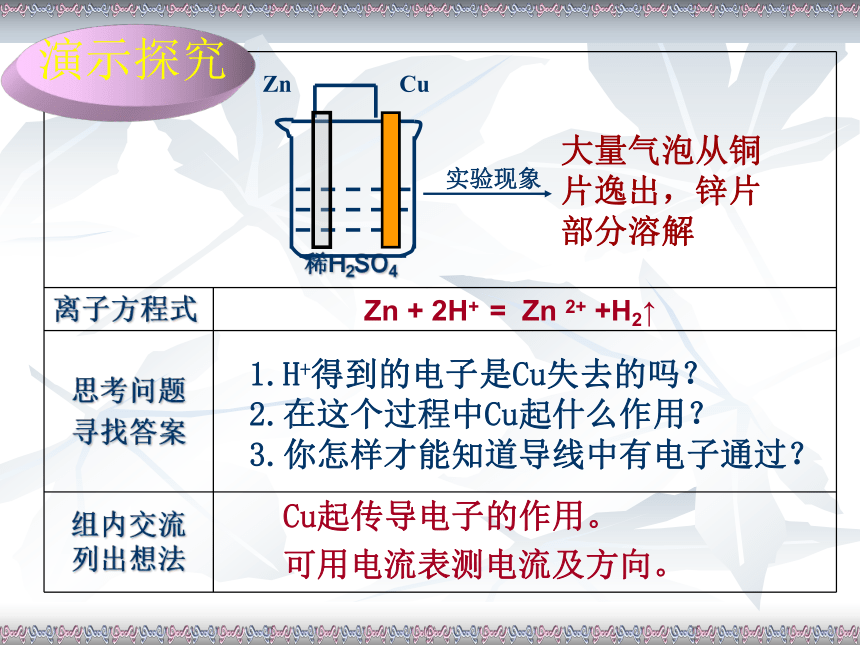
面得电子?用导线将锌表面的电子引出来Zn +2H+ = Zn 2+ +H2↑ 演示探究Cu起传导电子的作用。
可用电流表测电流及方向。Zn + 2H+ = Zn 2+ +H2↑大量气泡从铜片逸出,锌片部分溶解1.H+得到的电子是Cu失去的吗?
2.在这个过程中Cu起什么作用?
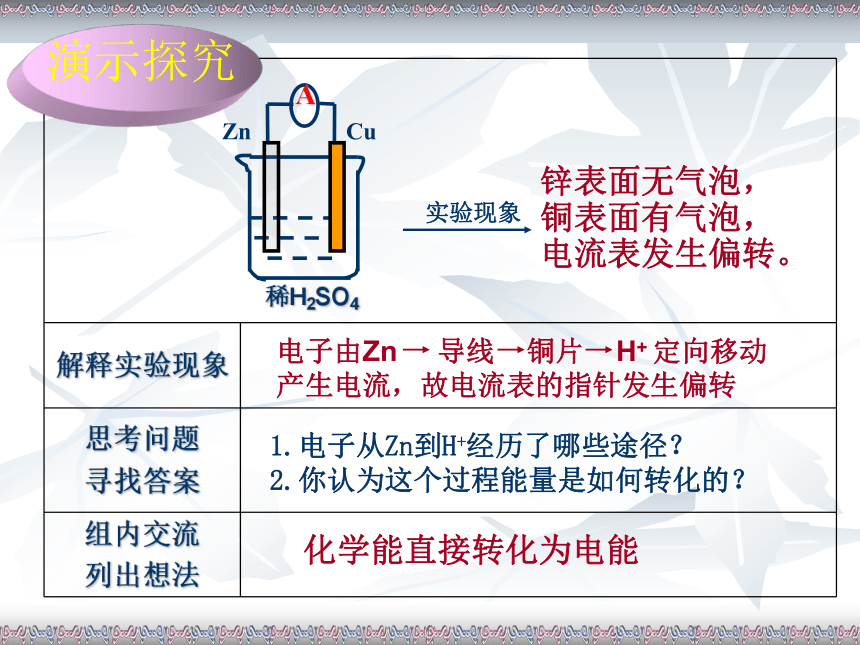
3.你怎样才能知道导线中有电子通过?演示探究化学能直接转化为电能1.电子从Zn到H+经历了哪些途径?
2.你认为这个过程能量是如何转化的?锌表面无气泡,
铜表面有气泡,
电流表发生偏转。上
一
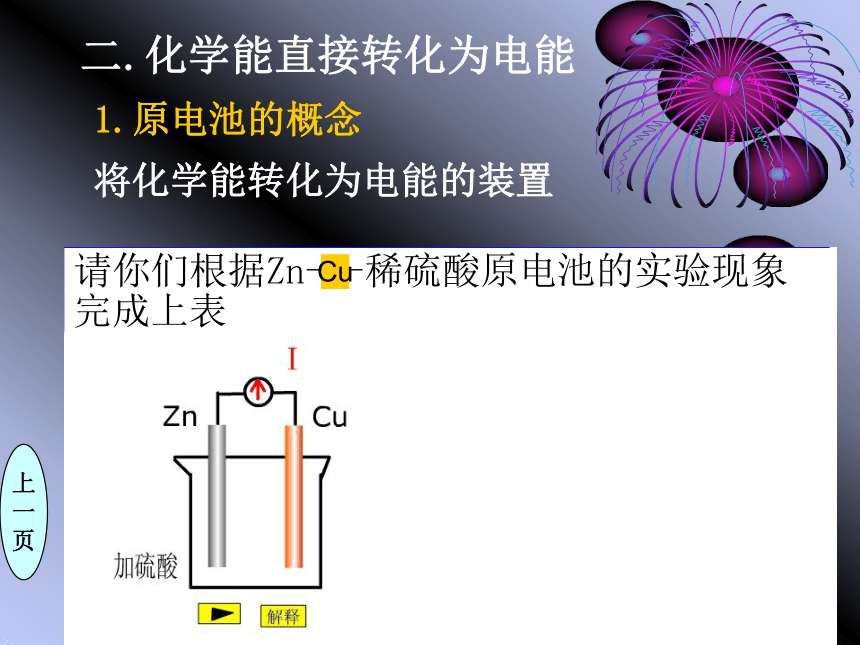
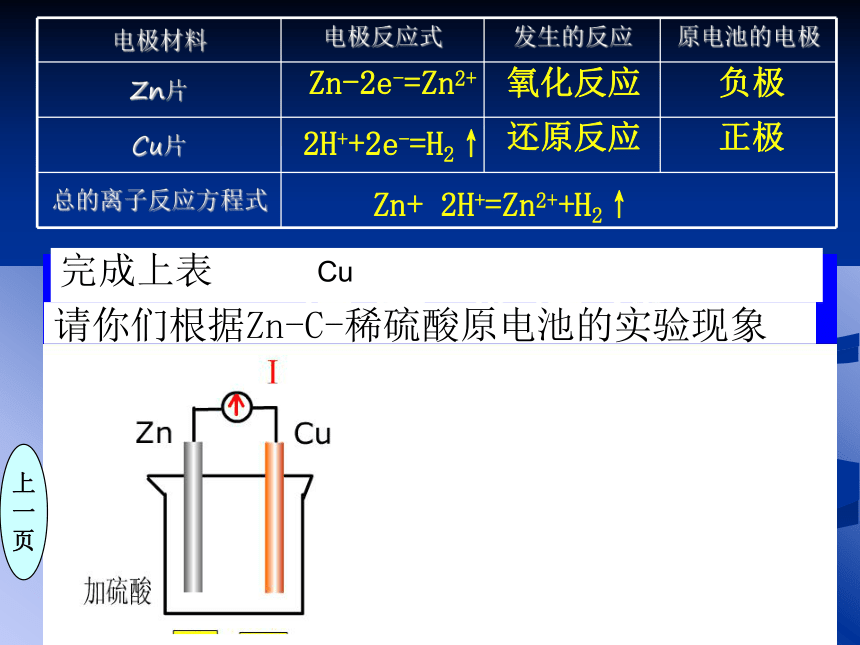
页Cu二.化学能直接转化为电能1.原电池的概念将化学能转化为电能的装置上
一
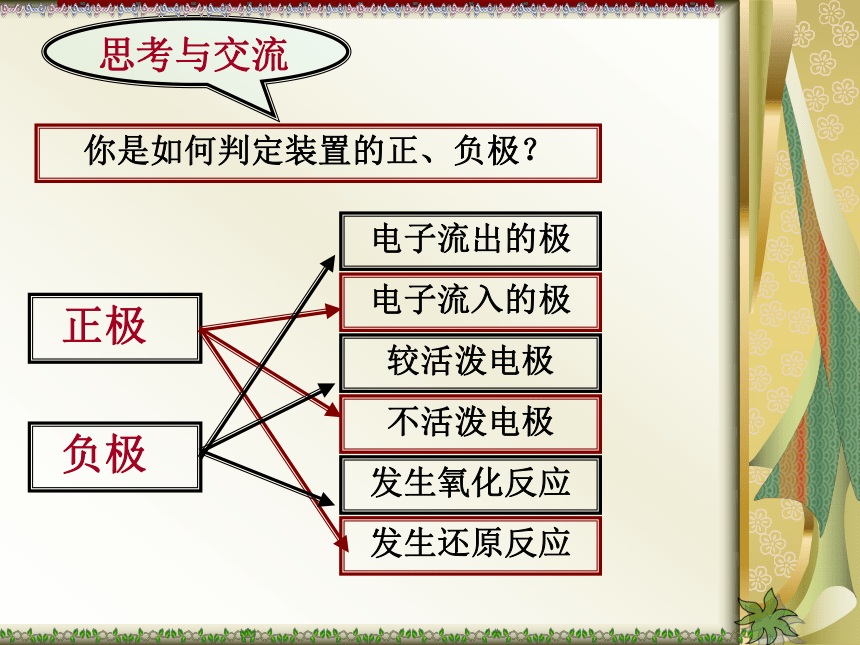
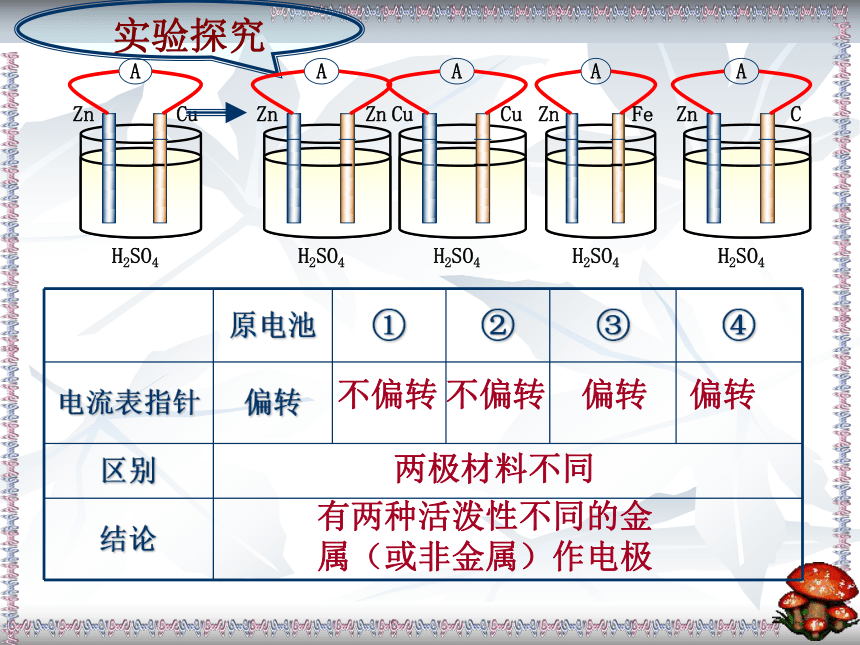
页CuZn-2e-=Zn2+2H++2e-=H2↑Zn+ 2H+=Zn2++H2↑负极正极还原反应氧化反应你是如何判定装置的正、负极?思考与交流实验探究不偏转偏转两极材料不同有两种活泼性不同的金
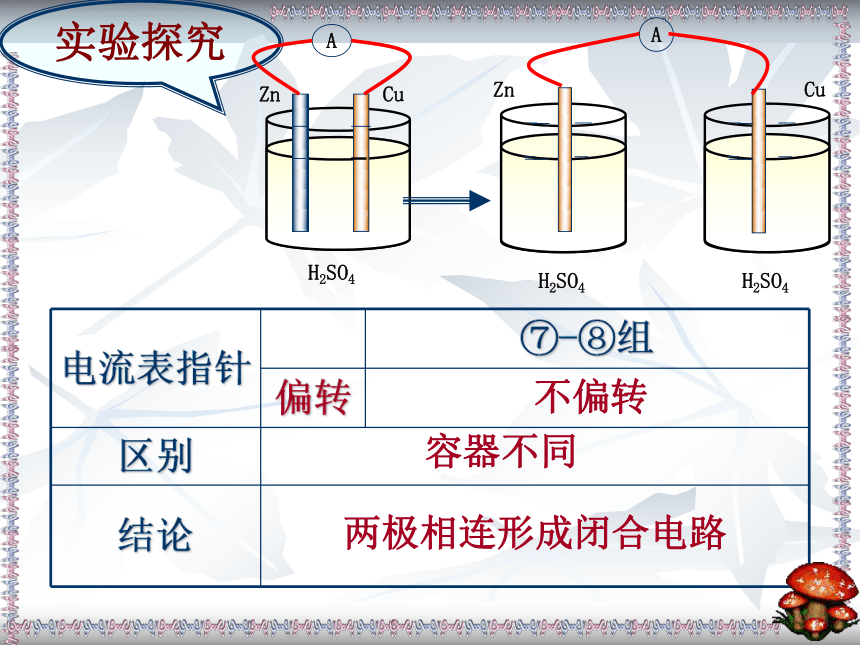
属(或非金属)作电极不偏转偏转实验探究不偏转溶液不同电极材料均插入
电解质溶液中偏转不偏转容器不同两极相连形成闭合电路
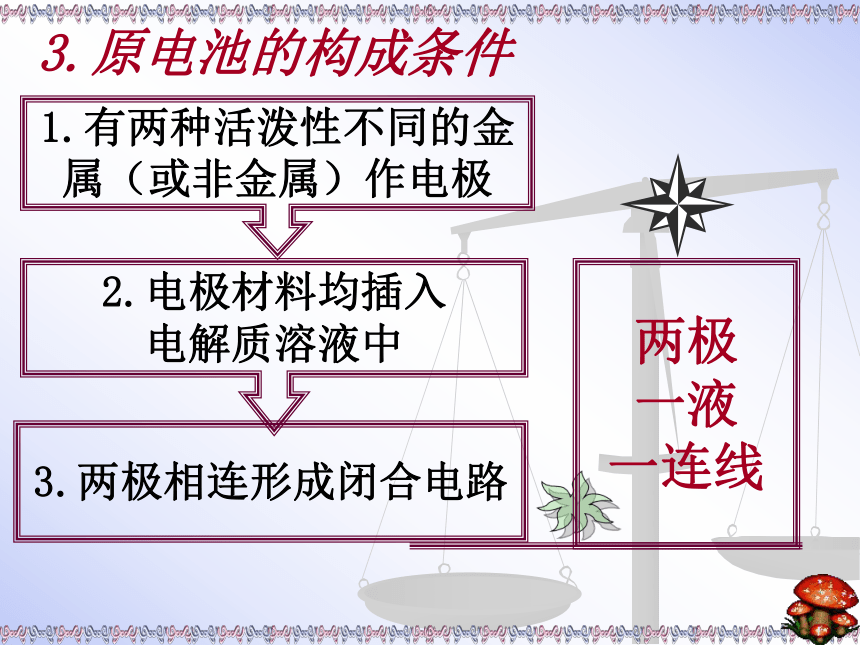
实验探究1.有两种活泼性不同的金
属(或非金属)作电极3.两极相连形成闭合电路2.电极材料均插入
电解质溶液中3.原电池的构成条件小结化
学
能
与
电
能间接:直接:装置原电池概
念构成条件工作原理1.下列装置中能组成原电池形成电流的是( )
习题一:C原电池的判断2.某金属能跟稀盐酸作用发出氢气,该金属与锌组成原电池时,锌为负极,此金属是( )
A.Mg B.Fe C.Al D.Cu原电池的工作原理B3.由铜锌和稀硫酸组成的原电池工作时,电解质溶液的 PH( )
A.不变 B先变大后变小
C逐渐变大 D.逐渐变小
C习题二习题三4.把a、b、c、d四块金属片浸入稀硫酸中,用导线两两相连组成原电池。若a、b相连时,a为负极;c、d相连时,电流由d到c;a、c相连时,c极上产生大量气泡,b、d相连时,b上有大量气泡产生,则四种金属的活动性顺序由强到弱的为( )
A.a > b > c > d B.a > c > d > b
C.c > a > b .> d D.b > d > c > a B利用原电池电极判断金属性强弱习题四5.一个电池反应的离子方程式是 Zn+Cu2+=Zn2+ +Cu,
该反应的的原电池正确组合是( )C原电池构成条件习题五科学工作者为心脏病人设计的心脏起搏器的电池是以Pt和Zn为电极材料,依靠人体内液体中含有一定浓度的溶解氧、H+和Zn2+进行工作,回答下列问题
(1)负极材料是______
电极反应式是____________________
(2)正极材料是______
电极反应式是___________________原电池电极反应式的书写Zn2Zn - 4e- = 2Zn2+PtO2+2H2O + 4e- =4OH-4、原电池原理的应用 a、加快氧化还原反应的速率 b、比较金属的活动性强弱 c、设计原电池 如利用 Cu+2FeCl3= CuCl2+2FeCl2 的氧化还原反应设计原电池 负极:正极:Cu—2e — = Cu2+2Fe3+ +2e— =2Fe2+氧化反应还原反应d、金属的腐蚀 例如铁的腐蚀1、析氢腐蚀(酸性较强的条件下的腐蚀)负极:正极:Fe—2e— =Fe2+2H++ 2e— =H2↑2、吸氧腐蚀(酸性较弱或中性条件下的腐蚀)负极:正极:2Fe—4e— =2Fe2+O2+2H2O+4e— =4OH—第2课时空气电池锂电池二、化学电源1、干电池的特点是: 只能一次性使用2、充电电池 充电电池又称 。可充电电池是两极都参加反应的电池。这是一种发展较快的原电池,如铅蓄电池、银锌电池、(纽扣电池)、锂电池、爱迪生蓄电池等,它们的负极是 ,正极一般是 。放电时,负极被 。正极材料的氧化物被 ,充电时的电极反应与放电时相反。较活泼的金属金属氧化物二次电池氧化还原铅蓄电池可放电亦可充电,它是用硬橡胶或透明塑料制成方形外壳,在正极板上有一层棕褐色的 ,负极板是海绵状的 ,两极均浸入
溶液中,且两极间用微孔橡胶或微孔塑料隔开。
负极:
正极:
放电总反应式:
⑴铅蓄电池PbO2金属铅硫酸Pb+SO42— —2e— =PbSO4PbO2+4H++SO42— +2e— = PbSO4+2H2OPb+ PbO2+2H2SO4= 2PbSO4+2H2O当硫酸的浓度降低,溶液的密度达1.18g/cm3时应停止使用,需充电,充电时起电解池的作用,电极反应为:
阳极:
阴极:
充电总反应式:
铅蓄电池放电和充电总反应式:PbSO4+2H2O—2e—=PbO2+4H++SO42—PbSO4 +2e— = Pb+SO42— 2PbSO4+2H2O= Pb+ PbO2+2H2SO4Pb+PbO2+2H2SO42PbSO4+2H2O(2)镍氢电池
负极:
正极:
放电总反应式:
H2 +2OH— —2e—= 2H2O2NiO(OH) +2H2O +2e— = 2Ni(OH)2 +2OH— H2 + 2NiO(OH) = 2Ni(OH)2 ⑷锂电池
锂电池是新一代可充电的绿色电池,已成为笔记本电脑、可移动电话、摄象机等低功耗电器的主流电源。3、燃料电池⑴氢氧燃料电池
氢氧燃料电池是一种高效低污染的新型电池,主要用于航天领域。它的电极材料一般为铂电极,活性炭电极,电解质溶液一般为40%的KOH溶液。 负极:
正极:
放电总反应式: 2H2 +4OH— —4e—=4H2OO2+2H2O+ 4e—= 4OH— 2H2 + O2 = 2H2O 若电解质溶液为稀H2SO4
负极:
正极:
放电总反应式: 2H2—4e—=4H+ O2+ 4H+ + 4e—= 2H2O2H2 + O2 = 2H2O⑵甲烷氧气燃料电池
该电池用铂片插入KOH溶液中作电极,在两极上分别通甲烷和氧气
负极:
正极:
放电总反应式:
CH4+10OH——8e—=CO32—+7H2O2O2+4H2O+8e—= 8OH—CH4+ 2O2+2KOH =K2CO3 +3H2O⑶Al—空气—海水电池
负极:
正极:
放电总反应式: 4Al —12e— = 4Al3+3O2+6H2O+12e—= 12OH—4Al + 3O2+6H2O= 4Al( OH)3
3.什么方法可使Zn与H+分开,不让H+直接在Zn表
面得电子?用导线将锌表面的电子引出来Zn +2H+ = Zn 2+ +H2↑ 演示探究Cu起传导电子的作用。
可用电流表测电流及方向。Zn + 2H+ = Zn 2+ +H2↑大量气泡从铜片逸出,锌片部分溶解1.H+得到的电子是Cu失去的吗?
2.在这个过程中Cu起什么作用?
3.你怎样才能知道导线中有电子通过?演示探究化学能直接转化为电能1.电子从Zn到H+经历了哪些途径?
2.你认为这个过程能量是如何转化的?锌表面无气泡,
铜表面有气泡,
电流表发生偏转。上
一
页Cu二.化学能直接转化为电能1.原电池的概念将化学能转化为电能的装置上
一
页CuZn-2e-=Zn2+2H++2e-=H2↑Zn+ 2H+=Zn2++H2↑负极正极还原反应氧化反应你是如何判定装置的正、负极?思考与交流实验探究不偏转偏转两极材料不同有两种活泼性不同的金
属(或非金属)作电极不偏转偏转实验探究不偏转溶液不同电极材料均插入
电解质溶液中偏转不偏转容器不同两极相连形成闭合电路
实验探究1.有两种活泼性不同的金
属(或非金属)作电极3.两极相连形成闭合电路2.电极材料均插入
电解质溶液中3.原电池的构成条件小结化
学
能
与
电
能间接:直接:装置原电池概
念构成条件工作原理1.下列装置中能组成原电池形成电流的是( )
习题一:C原电池的判断2.某金属能跟稀盐酸作用发出氢气,该金属与锌组成原电池时,锌为负极,此金属是( )
A.Mg B.Fe C.Al D.Cu原电池的工作原理B3.由铜锌和稀硫酸组成的原电池工作时,电解质溶液的 PH( )
A.不变 B先变大后变小
C逐渐变大 D.逐渐变小
C习题二习题三4.把a、b、c、d四块金属片浸入稀硫酸中,用导线两两相连组成原电池。若a、b相连时,a为负极;c、d相连时,电流由d到c;a、c相连时,c极上产生大量气泡,b、d相连时,b上有大量气泡产生,则四种金属的活动性顺序由强到弱的为( )
A.a > b > c > d B.a > c > d > b
C.c > a > b .> d D.b > d > c > a B利用原电池电极判断金属性强弱习题四5.一个电池反应的离子方程式是 Zn+Cu2+=Zn2+ +Cu,
该反应的的原电池正确组合是( )C原电池构成条件习题五科学工作者为心脏病人设计的心脏起搏器的电池是以Pt和Zn为电极材料,依靠人体内液体中含有一定浓度的溶解氧、H+和Zn2+进行工作,回答下列问题
(1)负极材料是______
电极反应式是____________________
(2)正极材料是______
电极反应式是___________________原电池电极反应式的书写Zn2Zn - 4e- = 2Zn2+PtO2+2H2O + 4e- =4OH-4、原电池原理的应用 a、加快氧化还原反应的速率 b、比较金属的活动性强弱 c、设计原电池 如利用 Cu+2FeCl3= CuCl2+2FeCl2 的氧化还原反应设计原电池 负极:正极:Cu—2e — = Cu2+2Fe3+ +2e— =2Fe2+氧化反应还原反应d、金属的腐蚀 例如铁的腐蚀1、析氢腐蚀(酸性较强的条件下的腐蚀)负极:正极:Fe—2e— =Fe2+2H++ 2e— =H2↑2、吸氧腐蚀(酸性较弱或中性条件下的腐蚀)负极:正极:2Fe—4e— =2Fe2+O2+2H2O+4e— =4OH—第2课时空气电池锂电池二、化学电源1、干电池的特点是: 只能一次性使用2、充电电池 充电电池又称 。可充电电池是两极都参加反应的电池。这是一种发展较快的原电池,如铅蓄电池、银锌电池、(纽扣电池)、锂电池、爱迪生蓄电池等,它们的负极是 ,正极一般是 。放电时,负极被 。正极材料的氧化物被 ,充电时的电极反应与放电时相反。较活泼的金属金属氧化物二次电池氧化还原铅蓄电池可放电亦可充电,它是用硬橡胶或透明塑料制成方形外壳,在正极板上有一层棕褐色的 ,负极板是海绵状的 ,两极均浸入
溶液中,且两极间用微孔橡胶或微孔塑料隔开。
负极:
正极:
放电总反应式:
⑴铅蓄电池PbO2金属铅硫酸Pb+SO42— —2e— =PbSO4PbO2+4H++SO42— +2e— = PbSO4+2H2OPb+ PbO2+2H2SO4= 2PbSO4+2H2O当硫酸的浓度降低,溶液的密度达1.18g/cm3时应停止使用,需充电,充电时起电解池的作用,电极反应为:
阳极:
阴极:
充电总反应式:
铅蓄电池放电和充电总反应式:PbSO4+2H2O—2e—=PbO2+4H++SO42—PbSO4 +2e— = Pb+SO42— 2PbSO4+2H2O= Pb+ PbO2+2H2SO4Pb+PbO2+2H2SO42PbSO4+2H2O(2)镍氢电池
负极:
正极:
放电总反应式:
H2 +2OH— —2e—= 2H2O2NiO(OH) +2H2O +2e— = 2Ni(OH)2 +2OH— H2 + 2NiO(OH) = 2Ni(OH)2 ⑷锂电池
锂电池是新一代可充电的绿色电池,已成为笔记本电脑、可移动电话、摄象机等低功耗电器的主流电源。3、燃料电池⑴氢氧燃料电池
氢氧燃料电池是一种高效低污染的新型电池,主要用于航天领域。它的电极材料一般为铂电极,活性炭电极,电解质溶液一般为40%的KOH溶液。 负极:
正极:
放电总反应式: 2H2 +4OH— —4e—=4H2OO2+2H2O+ 4e—= 4OH— 2H2 + O2 = 2H2O 若电解质溶液为稀H2SO4
负极:
正极:
放电总反应式: 2H2—4e—=4H+ O2+ 4H+ + 4e—= 2H2O2H2 + O2 = 2H2O⑵甲烷氧气燃料电池
该电池用铂片插入KOH溶液中作电极,在两极上分别通甲烷和氧气
负极:
正极:
放电总反应式:
CH4+10OH——8e—=CO32—+7H2O2O2+4H2O+8e—= 8OH—CH4+ 2O2+2KOH =K2CO3 +3H2O⑶Al—空气—海水电池
负极:
正极:
放电总反应式: 4Al —12e— = 4Al3+3O2+6H2O+12e—= 12OH—4Al + 3O2+6H2O= 4Al( OH)3
