认识晶体授课课件
图片预览







文档简介
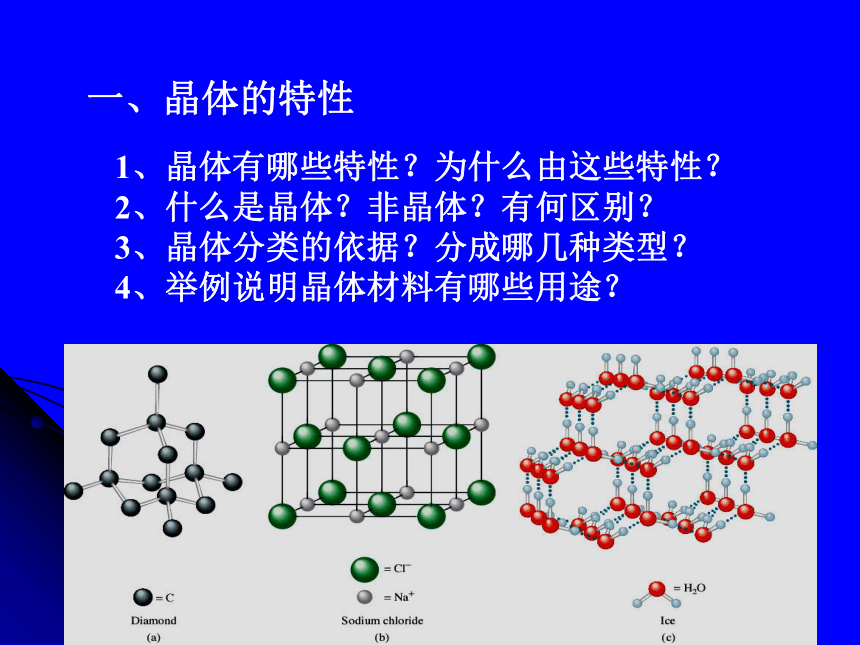
课件51张PPT。第三章 物质的聚集状态与物质性质第一节 认识晶体一、晶体的特性1、晶体有哪些特性?为什么由这些特性?
2、什么是晶体?非晶体?有何区别?
3、晶体分类的依据?分成哪几种类型?
4、举例说明晶体材料有哪些用途? 1、定义:
晶体——内部微粒(原子、离子或分子)在空间按一定规律做周期性重复排列构成的固体物质。
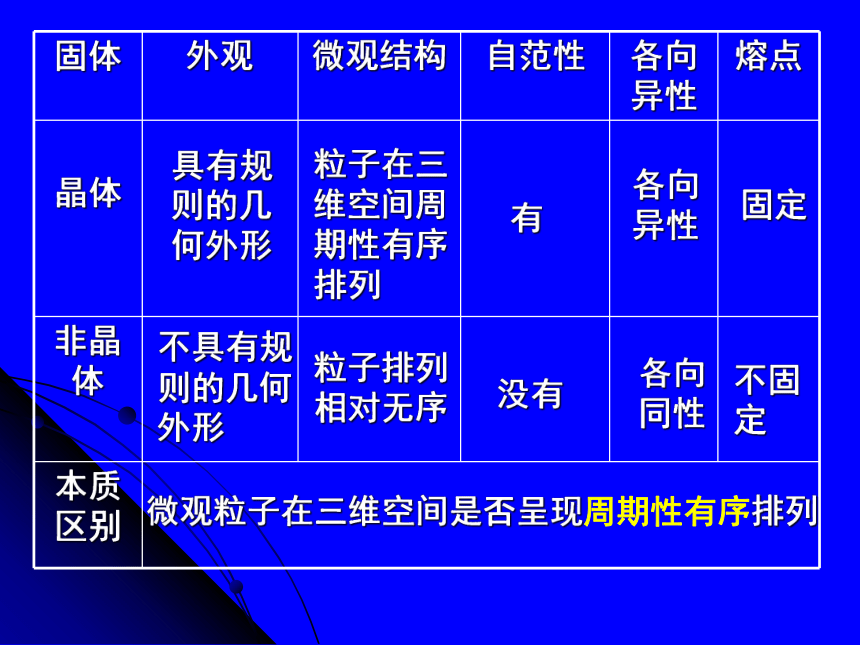
非晶体——内部微粒的排列呈现杂乱无章的分布状态。一、晶体和非晶体2、特点和性质:
(1)自范性:在适宜条件下,晶体能自发地呈现封闭的、规则的多面体外形。——是晶体中粒子在微观空间里呈现周期性有序排列的宏观表现(2)物理性质表现各向异性:晶体在不同方向上表现出不同的物理性质。 (强度、导热性、
光学性质)——同样反映了晶体内部粒子排列
的有序性(3)晶体具有固定的熔点(4)对称性:形状对称:对称轴、对称面有这些特性的原因:
构成晶体的微粒在空间按一定规律做
周期性重复排列
3.晶体的种类根据晶体构成微粒和相互作用不同分为四种类型:金属阳离子、自由电子阴阳离子原子分子分子间作用力离子键共价键金属键具有规则的几何外形有粒子在三维空间周期性有序排列各向异性固定不具有规则的几何外形没有粒子排列相对无序各向同性不固定微观粒子在三维空间是否呈现周期性有序排列二、晶体结构的堆积模型晶体为什么大都服从紧密堆积?金属晶体、离子晶体、分子晶体的结构中,金属键、离子键、分子间作用力均没有方向性,都趋向于使原子、离子或分子吸引尽可能多的微粒分布于周围,并以密堆积的方式降低体系的能量,使晶体变得比较稳定等径圆球的密堆积 由于金属键没有方向性,每个金属原子中的电子分布基本是球对称的,所以可以把金属晶体看成是由直径相等的圆球的三维空间堆积而成的。
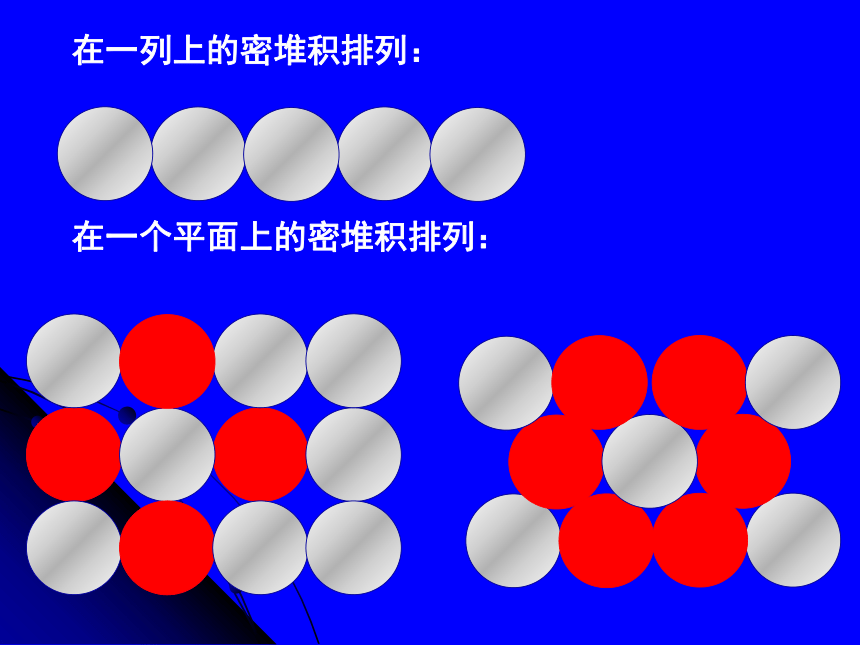
等径圆球的排列在一列上进行紧密堆积的方式只有一种,即所有的圆球都在一条直线上排列;
等径圆球在平面上的堆积方式很多。1.金属晶体的密堆积结构-----在一列上的密堆积排列:在一个平面上的密堆积排列: 在一个层中,最紧密的堆积方式是:一个球与周围 6 个球相切,在中心的周围形成 6 个凹位,将其算为第一层----密置层
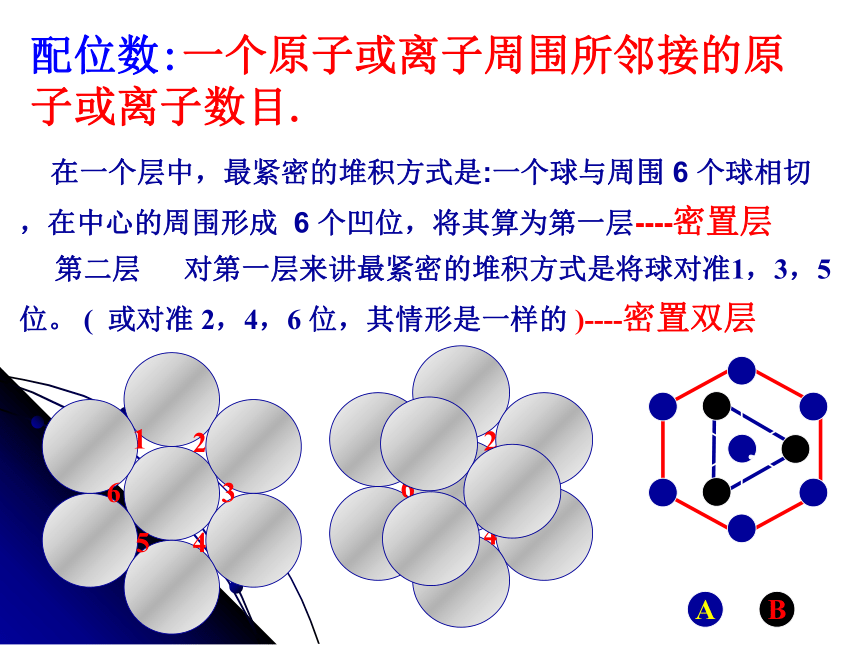
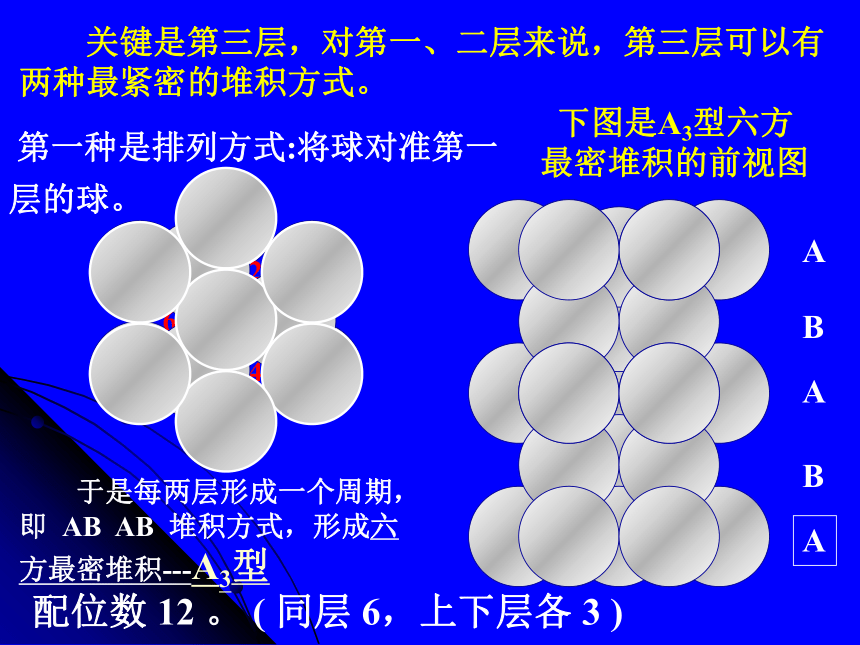
第二层 对第一层来讲最紧密的堆积方式是将球对准1,3,5 位。 ( 或对准 2,4,6 位,其情形是一样的 )----密置双层配位数:一个原子或离子周围所邻接的原 子或离子数目. 下图是A3型六方
最密堆积的前视图A 第一种是排列方式:将球对准第一层的球。 于是每两层形成一个周期,即 AB AB 堆积方式,形成六方最密堆积---A3型 配位数 12 。 ( 同层 6,上下层各 3 ) 关键是第三层,对第一、二层来说,第三层可以有两种最紧密的堆积方式。六方最密堆积面心立方最密堆积的前视图A 第四层再排 A,于是形成 ABC ABC 三层一个周期。 得到面心立方最密堆积—A1型 配位数 12 。
( 同层 6, 上下层各 3 ) 面心立方最密堆积ABC ABC 形式的堆积,为什么是面心立方堆积?
…ABCABC…堆积如何看出? 请来个逆向思维:体对角线垂直方向就是密置层,
将它们设成3种色彩:将视线逐步移向体对角线,
沿此线观察:你看到的正是…ABCABC…堆积! A1和A3这两种堆积都是最紧密堆积,空间利用率为 74.05%。氯化钠的晶体结构NaCl晶体中阴、阳离子配位数ZnS型离子晶体 返回原处2. 离子晶体的密堆积结构---非等径圆球的密堆积 由于阴阳离子的半径不相同,故离子晶体可以视为不等径圆球的密堆积,即:将不同半径的圆球的堆积看成是大球先按一定方式做等径圆球的密堆积,小球再填充在大球所形成的空隙中。 如NaCl配位数为6,即每个Na+离子周围直接连有6个CI-,反之亦然。分子的密堆积(与CO2分子距离最近的CO2分子共有12个 )干冰的晶体结构图 由于范德华力没有方向性
和饱和性,因此分子间尽可
能采取紧密排列方式,但分
子的排列方式与分子的形状
有关。如:作为直线型分子
的二氧化碳在空间是以A1型
密堆积方式形成晶体的。4、分子晶体的堆积方式-紧密堆积方式 原子晶体的堆集 由于共价键具有饱和性和方向性,就决定了一个原子周围的其他数目不仅是很有限的,而且堆集方向是一定的,所以其堆集不服从紧密堆集原理。配位数:
问题:考虑Mg Cu CO2 NaCI晶体的配位数是多少?问题:
1:什么是晶体?晶体有哪些特性?
2:非等径圆球的密堆积的堆积方式如何?什么是配位数?Mg Cu NaCI晶体中的配位数是多少?
3、晶体的结构微粒的堆积原则是什么?影响因素是什么?
4、晶体的分类依据是什么?分为哪几类?各自的微粒、相互作用堆积方式如何?
5、等径圆球的密堆积有几种?二者关系如何?举例:
非等径圆球的密堆积如何?4:1):相似:都是最密堆积,
不同:紧密堆积的方式不同,A1型密堆积 层与层采用…ABCABC…堆积方式,A3型密堆积 层与层采用…ABAB…堆积方式,
2):金属晶体的密堆积为等径圆球的密堆积,离子晶体为非等径圆球的密堆积,分子晶体中由于范德华力无方向性和饱和性分子间尽可能采用紧密堆积的排列方式 ,但排列还与分子形状有关采用紧密堆积的排列方式 ,可使晶体的能量最低。
三﹑晶胞1. 晶胞:描述晶体结构的基本单元蜂巢与蜂室铜晶体铜晶胞 晶体与晶胞的关系可用蜂巢与峰室的关系比喻然而蜂巢是有形的,晶胞是无形的,是人为划定的。第二层的离子NaCl晶体的结构示意图再请看:CsCl晶体的结构示意图CsCl晶体的结构:铜晶体铜晶胞晶体结构晶胞示意图NaCl晶体结构和晶胞思考与交流:
1.上述铜晶体、金刚石、CO2晶体、NaCl晶体的晶胞的空间构形呈什么形状?
2.在上述晶体中,晶胞是如何排列的?晶胞之间是否存在空隙?CO2晶胞平行六面体无隙并置2、特点:晶胞都是平行六面体.晶胞在晶体中“无隙并置”.3、三种典型立方晶体结构体心立方密堆积六方最密堆积面心立方最密堆积A3型A2型A1型体心:1面心:1/2顶点:1/8棱边:1/44.晶胞中原子个数的计算均摊法:晶胞任意位置上的一个原子如果是被x个晶胞所共有,那么,每个晶胞对这个原子分得的份额就是1/x晶胞中微粒数=顶点微粒数X 1/8+棱微粒数 X 1/4
+面微粒数X 1/2 +体内微粒数 X 11、现有甲、乙、丙、丁四种晶胞,可推知:甲晶体中A与B的离子个数比为 ;乙晶体的化学式为 ;丙晶体的化学式为______;丁晶体的化学式为______。1:1C2DEFXY3Z2、下图依次是金属钠(Na)、金属锌(Zn)、碘(12)、金刚石(C)晶胞的示意图,数一数,它们分别平均含有几个原子?NaZnI2金刚石3、钙-钛矿晶胞结构如图所示。观察钙-钛矿晶胞结构,求该晶体中,钙、钛、氧的微粒个数比为多少?4、在碳单质的成员中还有一种混合型晶体
——石墨,如图所示。它是层状结构,层与层之间依靠作用力相结合。每层内部碳原子与碳原子之间靠作用力相结合,其键角为120?。分析图中每个六边形含有 个碳原子。 25、下列是NaCl晶胞示意图,晶胞中Na+和Clˉ的个数比是多少?(8× + 6 × )×3 =126、下图是CO2分子晶体的晶胞结构示意图,其中有多少个原子?NiO晶体结构如图,Ni2+与邻近的O2-核间距为a×10-8 ㎝,计算NiO晶体密度(已知NiO摩尔质量为74.7g·mol-1)7、最近发现一种由钛原子和碳原子构成的气态团簇分子,如下图所示,顶角和面心的原子是钛原子,棱的中心和体心的原子是碳原子,它的化学式是 。解析:由于本题团簇分子指的是一个分子的具体结构,并不是晶体中的最小的一个重复单位,不能采用均摊法分析,所以只需数出该结构内两种原子的数目就可以了。答案为:Ti14C132:假如:晶胞是六方柱型,晶胞中微粒数如何算?晶胞中微粒数=顶点微粒数X 1/6+棱微粒数X 1/3 +面微粒数 X 1/2 +体内微粒数 X 112 X 1/6 + 2 x ? + 3 x 1 = 6立方晶胞体心:1面心:1/2棱边:1/4顶点:1/8小结:晶胞1、概念:描述晶体结构的基本单元2、晶胞中原子个数的计算——分摊法作业: [1]:90页,4 题上演草,
[2]:全练:1、2课时。
[3]:熟记基本知识
2、什么是晶体?非晶体?有何区别?
3、晶体分类的依据?分成哪几种类型?
4、举例说明晶体材料有哪些用途? 1、定义:
晶体——内部微粒(原子、离子或分子)在空间按一定规律做周期性重复排列构成的固体物质。
非晶体——内部微粒的排列呈现杂乱无章的分布状态。一、晶体和非晶体2、特点和性质:
(1)自范性:在适宜条件下,晶体能自发地呈现封闭的、规则的多面体外形。——是晶体中粒子在微观空间里呈现周期性有序排列的宏观表现(2)物理性质表现各向异性:晶体在不同方向上表现出不同的物理性质。 (强度、导热性、
光学性质)——同样反映了晶体内部粒子排列
的有序性(3)晶体具有固定的熔点(4)对称性:形状对称:对称轴、对称面有这些特性的原因:
构成晶体的微粒在空间按一定规律做
周期性重复排列
3.晶体的种类根据晶体构成微粒和相互作用不同分为四种类型:金属阳离子、自由电子阴阳离子原子分子分子间作用力离子键共价键金属键具有规则的几何外形有粒子在三维空间周期性有序排列各向异性固定不具有规则的几何外形没有粒子排列相对无序各向同性不固定微观粒子在三维空间是否呈现周期性有序排列二、晶体结构的堆积模型晶体为什么大都服从紧密堆积?金属晶体、离子晶体、分子晶体的结构中,金属键、离子键、分子间作用力均没有方向性,都趋向于使原子、离子或分子吸引尽可能多的微粒分布于周围,并以密堆积的方式降低体系的能量,使晶体变得比较稳定等径圆球的密堆积 由于金属键没有方向性,每个金属原子中的电子分布基本是球对称的,所以可以把金属晶体看成是由直径相等的圆球的三维空间堆积而成的。
等径圆球的排列在一列上进行紧密堆积的方式只有一种,即所有的圆球都在一条直线上排列;
等径圆球在平面上的堆积方式很多。1.金属晶体的密堆积结构-----在一列上的密堆积排列:在一个平面上的密堆积排列: 在一个层中,最紧密的堆积方式是:一个球与周围 6 个球相切,在中心的周围形成 6 个凹位,将其算为第一层----密置层
第二层 对第一层来讲最紧密的堆积方式是将球对准1,3,5 位。 ( 或对准 2,4,6 位,其情形是一样的 )----密置双层配位数:一个原子或离子周围所邻接的原 子或离子数目. 下图是A3型六方
最密堆积的前视图A 第一种是排列方式:将球对准第一层的球。 于是每两层形成一个周期,即 AB AB 堆积方式,形成六方最密堆积---A3型 配位数 12 。 ( 同层 6,上下层各 3 ) 关键是第三层,对第一、二层来说,第三层可以有两种最紧密的堆积方式。六方最密堆积面心立方最密堆积的前视图A 第四层再排 A,于是形成 ABC ABC 三层一个周期。 得到面心立方最密堆积—A1型 配位数 12 。
( 同层 6, 上下层各 3 ) 面心立方最密堆积ABC ABC 形式的堆积,为什么是面心立方堆积?
…ABCABC…堆积如何看出? 请来个逆向思维:体对角线垂直方向就是密置层,
将它们设成3种色彩:将视线逐步移向体对角线,
沿此线观察:你看到的正是…ABCABC…堆积! A1和A3这两种堆积都是最紧密堆积,空间利用率为 74.05%。氯化钠的晶体结构NaCl晶体中阴、阳离子配位数ZnS型离子晶体 返回原处2. 离子晶体的密堆积结构---非等径圆球的密堆积 由于阴阳离子的半径不相同,故离子晶体可以视为不等径圆球的密堆积,即:将不同半径的圆球的堆积看成是大球先按一定方式做等径圆球的密堆积,小球再填充在大球所形成的空隙中。 如NaCl配位数为6,即每个Na+离子周围直接连有6个CI-,反之亦然。分子的密堆积(与CO2分子距离最近的CO2分子共有12个 )干冰的晶体结构图 由于范德华力没有方向性
和饱和性,因此分子间尽可
能采取紧密排列方式,但分
子的排列方式与分子的形状
有关。如:作为直线型分子
的二氧化碳在空间是以A1型
密堆积方式形成晶体的。4、分子晶体的堆积方式-紧密堆积方式 原子晶体的堆集 由于共价键具有饱和性和方向性,就决定了一个原子周围的其他数目不仅是很有限的,而且堆集方向是一定的,所以其堆集不服从紧密堆集原理。配位数:
问题:考虑Mg Cu CO2 NaCI晶体的配位数是多少?问题:
1:什么是晶体?晶体有哪些特性?
2:非等径圆球的密堆积的堆积方式如何?什么是配位数?Mg Cu NaCI晶体中的配位数是多少?
3、晶体的结构微粒的堆积原则是什么?影响因素是什么?
4、晶体的分类依据是什么?分为哪几类?各自的微粒、相互作用堆积方式如何?
5、等径圆球的密堆积有几种?二者关系如何?举例:
非等径圆球的密堆积如何?4:1):相似:都是最密堆积,
不同:紧密堆积的方式不同,A1型密堆积 层与层采用…ABCABC…堆积方式,A3型密堆积 层与层采用…ABAB…堆积方式,
2):金属晶体的密堆积为等径圆球的密堆积,离子晶体为非等径圆球的密堆积,分子晶体中由于范德华力无方向性和饱和性分子间尽可能采用紧密堆积的排列方式 ,但排列还与分子形状有关采用紧密堆积的排列方式 ,可使晶体的能量最低。
三﹑晶胞1. 晶胞:描述晶体结构的基本单元蜂巢与蜂室铜晶体铜晶胞 晶体与晶胞的关系可用蜂巢与峰室的关系比喻然而蜂巢是有形的,晶胞是无形的,是人为划定的。第二层的离子NaCl晶体的结构示意图再请看:CsCl晶体的结构示意图CsCl晶体的结构:铜晶体铜晶胞晶体结构晶胞示意图NaCl晶体结构和晶胞思考与交流:
1.上述铜晶体、金刚石、CO2晶体、NaCl晶体的晶胞的空间构形呈什么形状?
2.在上述晶体中,晶胞是如何排列的?晶胞之间是否存在空隙?CO2晶胞平行六面体无隙并置2、特点:晶胞都是平行六面体.晶胞在晶体中“无隙并置”.3、三种典型立方晶体结构体心立方密堆积六方最密堆积面心立方最密堆积A3型A2型A1型体心:1面心:1/2顶点:1/8棱边:1/44.晶胞中原子个数的计算均摊法:晶胞任意位置上的一个原子如果是被x个晶胞所共有,那么,每个晶胞对这个原子分得的份额就是1/x晶胞中微粒数=顶点微粒数X 1/8+棱微粒数 X 1/4
+面微粒数X 1/2 +体内微粒数 X 11、现有甲、乙、丙、丁四种晶胞,可推知:甲晶体中A与B的离子个数比为 ;乙晶体的化学式为 ;丙晶体的化学式为______;丁晶体的化学式为______。1:1C2DEFXY3Z2、下图依次是金属钠(Na)、金属锌(Zn)、碘(12)、金刚石(C)晶胞的示意图,数一数,它们分别平均含有几个原子?NaZnI2金刚石3、钙-钛矿晶胞结构如图所示。观察钙-钛矿晶胞结构,求该晶体中,钙、钛、氧的微粒个数比为多少?4、在碳单质的成员中还有一种混合型晶体
——石墨,如图所示。它是层状结构,层与层之间依靠作用力相结合。每层内部碳原子与碳原子之间靠作用力相结合,其键角为120?。分析图中每个六边形含有 个碳原子。 25、下列是NaCl晶胞示意图,晶胞中Na+和Clˉ的个数比是多少?(8× + 6 × )×3 =126、下图是CO2分子晶体的晶胞结构示意图,其中有多少个原子?NiO晶体结构如图,Ni2+与邻近的O2-核间距为a×10-8 ㎝,计算NiO晶体密度(已知NiO摩尔质量为74.7g·mol-1)7、最近发现一种由钛原子和碳原子构成的气态团簇分子,如下图所示,顶角和面心的原子是钛原子,棱的中心和体心的原子是碳原子,它的化学式是 。解析:由于本题团簇分子指的是一个分子的具体结构,并不是晶体中的最小的一个重复单位,不能采用均摊法分析,所以只需数出该结构内两种原子的数目就可以了。答案为:Ti14C132:假如:晶胞是六方柱型,晶胞中微粒数如何算?晶胞中微粒数=顶点微粒数X 1/6+棱微粒数X 1/3 +面微粒数 X 1/2 +体内微粒数 X 112 X 1/6 + 2 x ? + 3 x 1 = 6立方晶胞体心:1面心:1/2棱边:1/4顶点:1/8小结:晶胞1、概念:描述晶体结构的基本单元2、晶胞中原子个数的计算——分摊法作业: [1]:90页,4 题上演草,
[2]:全练:1、2课时。
[3]:熟记基本知识
