共价键课件
图片预览





文档简介
课件49张PPT。化学 选修3
物质结构与性质
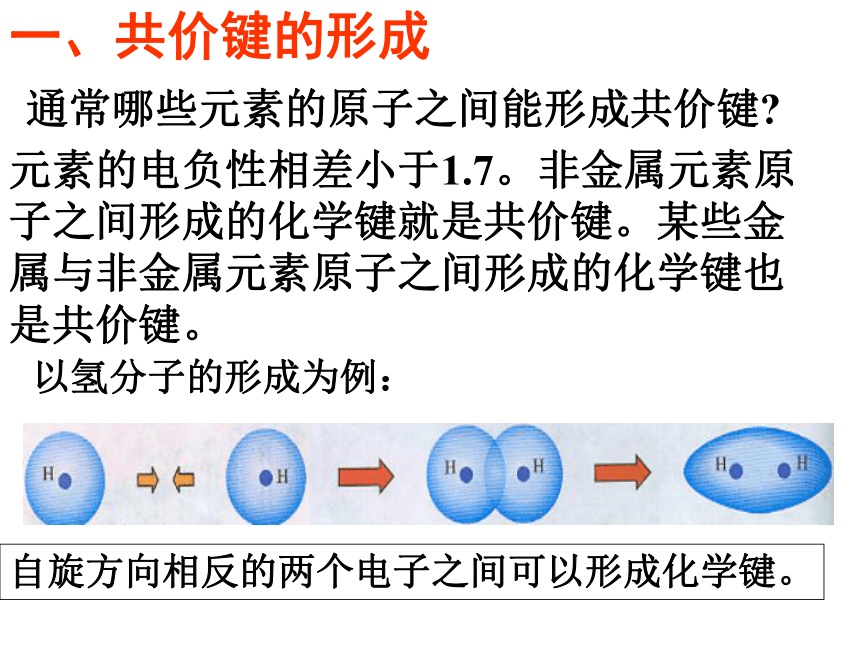
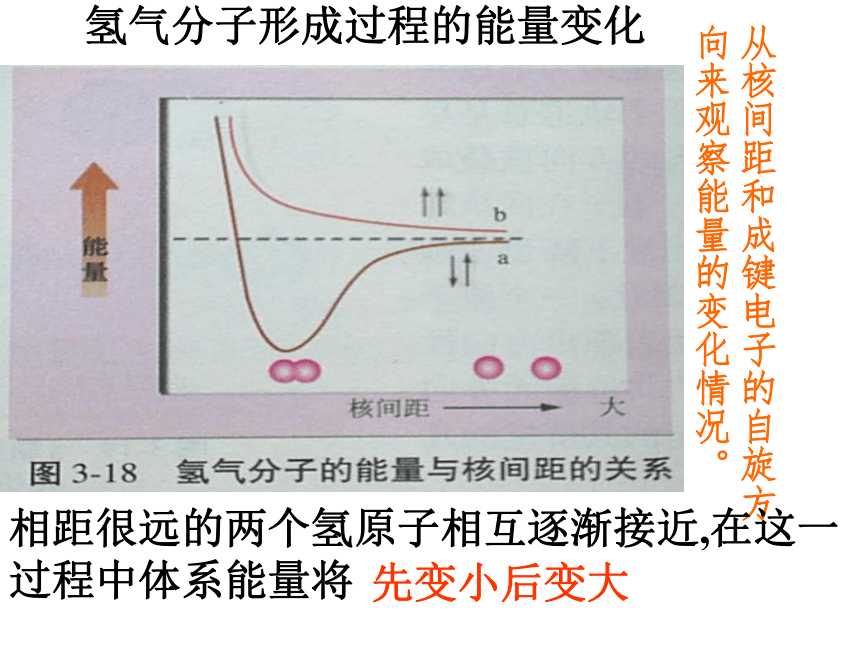
专题3微粒间作用力第三单元共价键一、共价键的形成以氢分子的形成为例:自旋方向相反的两个电子之间可以形成化学键。元素的电负性相差小于1.7。非金属元素原子之间形成的化学键就是共价键。某些金属与非金属元素原子之间形成的化学键也是共价键。通常哪些元素的原子之间能形成共价键?氢气分子形成过程的能量变化从核间距和成键电子的自旋方向来观察能量的变化情况。相距很远的两个氢原子相互逐渐接近,在这一
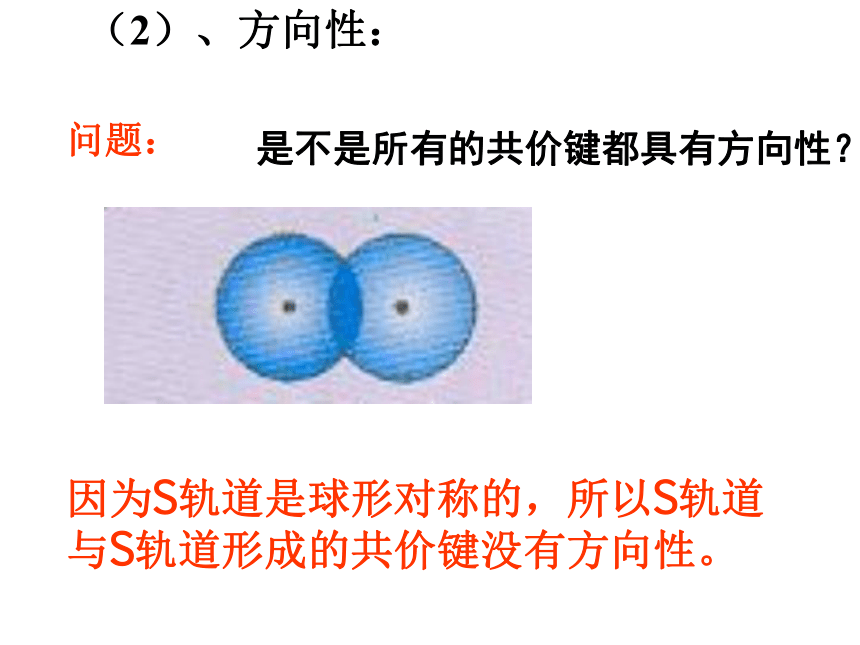
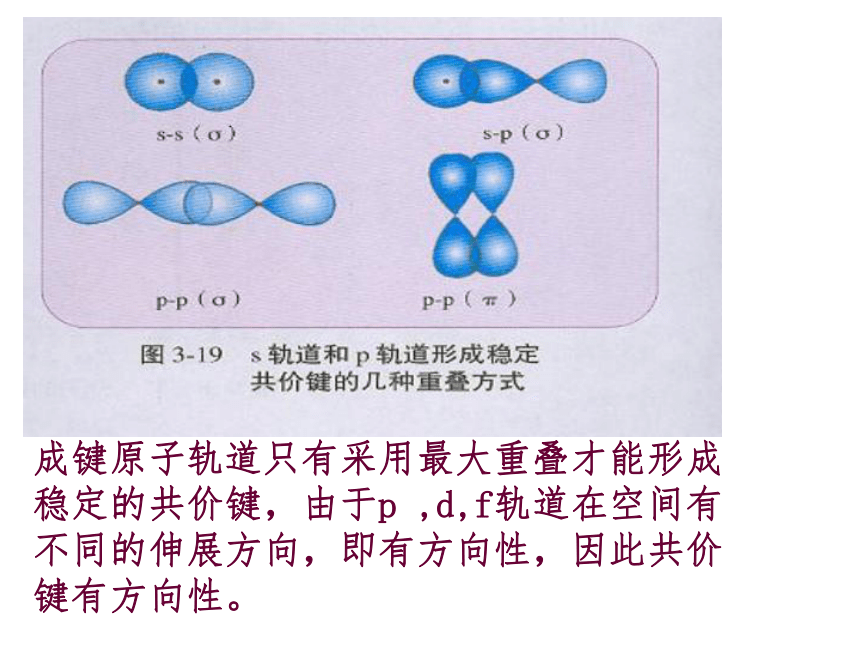
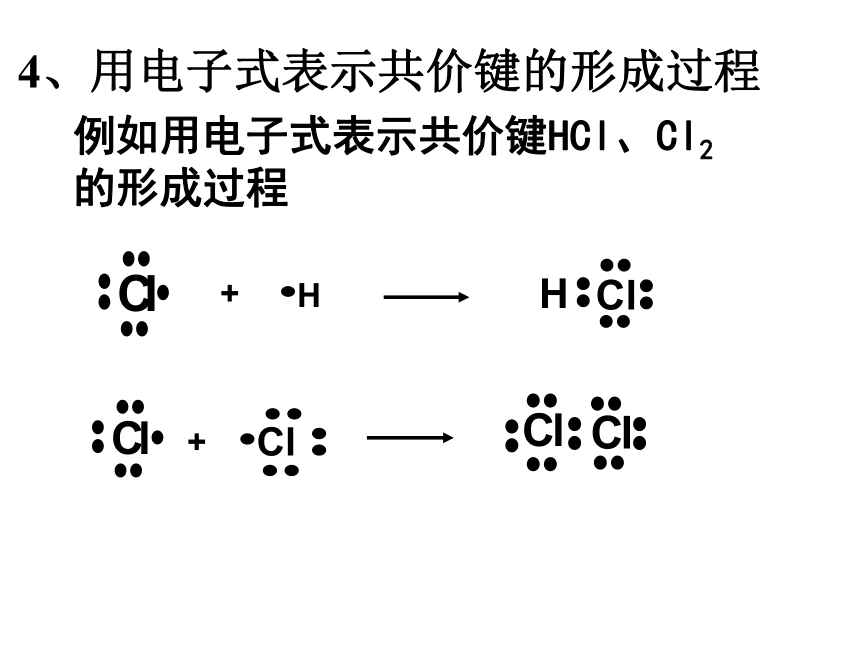
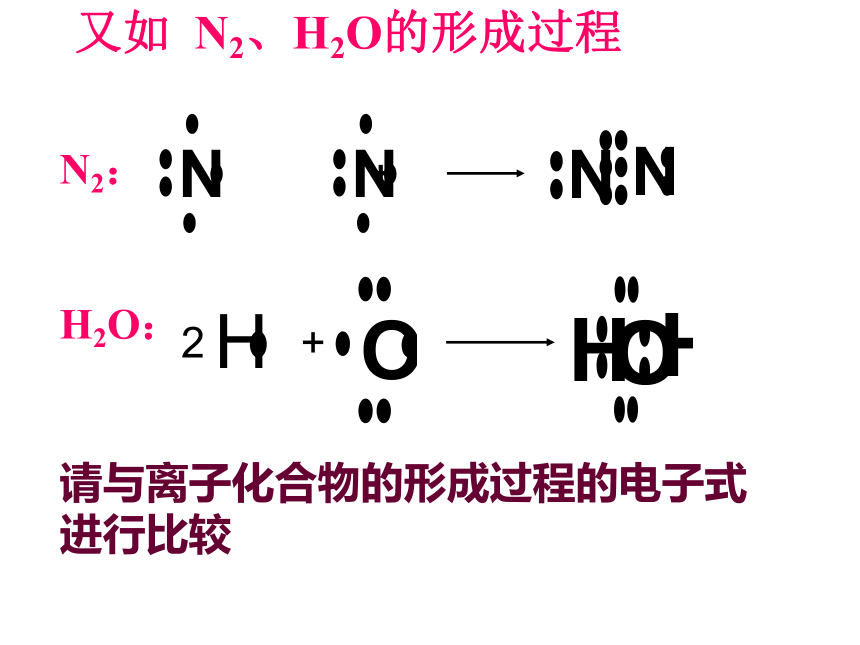
过程中体系能量将先变小后变大1、形成共价键的要点 电子配对原理 最大重叠原理两原子各自提供1个自旋方向相反的电子彼此配对。两个原子轨道重叠部分越大,两核间电子的概率密度越大,形成的共价键越牢固,分子越稳定。2、共价键的本质当成键原子相互接近时,原子轨道发生重叠,自旋方向相反的未成对电子形成共用电子对,两原子核间的电子概率密度增加,体系的能量降低.3、共价键的特点(1)、饱和性:原子有几个未成对电子就形成几个共价键。因为S轨道是球形对称的,所以S轨道与S轨道形成的共价键没有方向性。(2)、方向性:是不是所有的共价键都具有方向性?问题:成键原子轨道只有采用最大重叠才能形成稳定的共价键,由于p ,d,f轨道在空间有不同的伸展方向,即有方向性,因此共价键有方向性。4、用电子式表示共价键的形成过程例如用电子式表示共价键HCl、Cl2的形成过程又如 N2、H2O的形成过程 N2:
H2O:
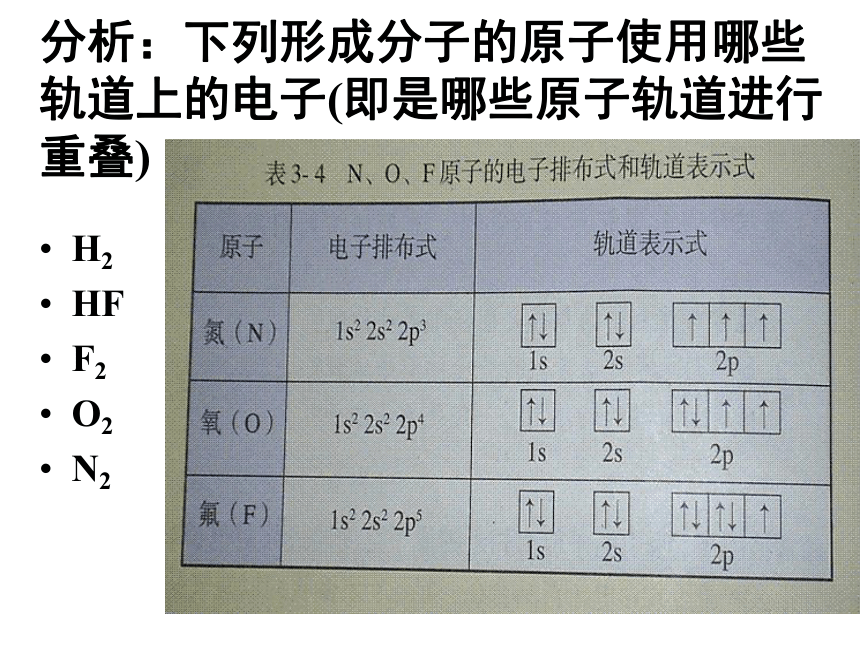
请与离子化合物的形成过程的电子式进行比较分析:下列形成分子的原子使用哪些轨道上的电子(即是哪些原子轨道进行重叠)H2
HF
F2
O2
N2
二、共价键的类型1、非极性键:共用电子对不偏向任何原子的共价键,同种非金属元素的原子形成的共价键。
2、极性键:共用电子对发生偏向的共价键,不同种非金属元素的原子形成的共价键。成键原子的电负型相差越大,键的极性越强。
配位键:由一个原子提供一对电子与另一个接受电子的原子形成共价键。例,NH4+ 、H3O+[归纳、小结]1、共价键:原子间通过共用电子对所形成的化学键叫共价键。
2、极性键:共用电子对发生偏向的共价键,不同种元素的原子。
非极性键:共用电子对不偏向任何原子的共价键,同种元素的原子
3、共用电子对的目的是达到稳定结构(氢原子达到2个电子,其他原子达到8个电子)二、共价键的类型1.σ键:“头碰头”X++s—sX+px—sXpx—px形成σ键的电子
称为σ电子。原子轨道沿核间连线重叠(即头碰头方式)形成的共价键,叫σ键. 2.π键:“肩并肩”+IXZZpZ—pZ形成π键的电子称为π电子。原子轨道在核间连线两侧进行重叠(即采用肩并肩)方式形成的共价键,叫π键.σ键的类型π键的类型有机物中的共价键1、C – H 是σ键。2、C—C 是σ键。3、C=C 一个σ键,一个π键。4、 C ≡C 一个σ键,两个π键。乙烯、乙炔分子中C-C σ键比较稳定不容易断裂, π键比较容易断裂。请指出乙烷、乙烯、乙炔分子中存在哪些类型的共价键,分别有几个σ键,几个π键?1个σ键
+ 6个σ键3个σ键
两个π键5个σ键,
一个π键拓展视野 苯分子中的共价键请大家看课本P42~P43的相应内容。完成 P43交流与讨论1、极性键:
非极性键:HCl CO H2OCl2 N2 H22、键的极性由强到弱的顺序:F—H O– H N—H C—H三、共价键的键能与化学反应热2、共价键的键能用来衡量共价键牢固程度,共价键键能越大表示该共价键越牢固,即越不容易被破坏。1、共价键的键能:在101kPa、298K条件下,1mol气态AB分子生成气态A原子和气态B原子的过程所吸收的能量,称为AB间共价键的键能。3、键长:成键两原子间的平均间距。4、共价键键能与键长的关系:
请认真分析P45 表3-5。结论:
键长越短,键能越大,共价键越稳定。(二)、键能与反应过程中能量变化的关系P45 问题解决
核心问题是如何利用键能来计算反应过程中的能量变化。1、试利用表3—5的数据进行计算,1 mo1H2分别跟lmolCl2、lmolBr2(蒸气)反应,分别形成2 mo1HCl分子和2molHBr分子,哪一个反应释放的能量更多?如何用计算的结果说明氯化氢分子和溴化氢分子哪个更容易发生热分解生成相应的单质?
2.N2、02、F2跟H2的反应能力依次增强,从键能的角度应如何理解这一化学事实?(三)、键长、键能对分子的
化学性质有什么影响?1、形成2mo1HCl释放能量:2×431.8 kJ -(436.0kJ+242.7kJ)= 184.9 kJ
形成2 mo1HBr释放能量:2×366kJ -(436.0kJ+193.7kJ)= 102.97kJ
HCl释放能量比HBr释放能量多,因而生成的HCl更稳定,即HBr更容易发生热分解生成相应的单质. 解释因此、键长越长,键能越小,键越易断裂,
化学性质越活泼。P46 问题解决(2)△H=2 ×436kJ/mol+498kJ/mol-2×(2×463) kJ/mol=-482kJ/mol1、(1)
△H = 946kJ/mol+3×436kJ/mol-
2×(3×393)kJ/mol= -104kJ/mol2、H---X的键能分别是:
H—F = 567kj/mol
H—Cl = 431kj/mol
H—Br = 366kj/mol
H—I = 298kj/mol
结论:键能越大,分子的稳定性越强。 CO分子和N2分子的某些性质 等电子原理:原子总数相同、价电子总数相同的分子具有
相似的化学键特征,它们的许多性质是相近
的 四、原子晶体1、什么叫原子晶体?
晶体中所有原子都是通过共价键结合的空间网状结构。
2、原子晶体的特点?
由于共价键键能大,所以原子晶体一般具有很高的熔、沸点和很大的硬度,一般不溶于溶剂。
3、常见哪些物质属于原子晶体?
金刚石、单晶硅、碳化硅(金刚砂)、二氧化硅、氮化硼(BN)等。参看P47 问题解决金刚石晶体结构模型金刚石的晶体结构SiO2晶体结构石墨石墨为什么很软?石墨为层状结构,各层之间是范德华力结合,容易滑动,所以石墨很软。
石墨的熔沸点为什么很高?石墨各层均为平面网状结构,碳原子之间存在很强的共价键,故熔沸点很高。
石墨的晶体结构P47 整理与归纳几种类型化学键的比较整理与归纳 晶体比较和判断晶体类型
离子晶体
分子晶体
原子晶体离子键
范德华力
共价键离子
分子
原子较高
较低
很高NaCl、CsCl
干冰
金刚石微粒结合力熔沸点典型实例三种晶体的比较晶体类型的判断从组成上判断(仅限于中学范围):
有无金属离子?(有:离子晶体)
是否属于“四种原子晶体”?
以上皆否定,则多数是分子晶体。
从性质上判断:
熔沸点和硬度;(高:原子晶体;中:离子晶体;低:分子晶体)
熔融状态的导电性。(导电:离子晶体)课堂练习题下列不存在化学键的晶体是:
A.硝酸钾 B.干冰 C.石墨 D.固体氩
不是分子晶体的是:
A.碘 B.水 C. 硫酸铵 D.干冰
晶体中的一个微粒周围有6个微粒,这种晶体是:
A.金刚石 B.石墨 C.干冰 D.氯化钠DCD开拓思考题仔细观察左边的示意图后,回答下列问题:
金刚石与石墨的熔点均很高,那么二者熔点是否相同?为什么?若不相同,哪种更高一些?
三、等电子原理 1.原子总数相同、价电子总数相同的分子具有相似化学键特征,许多性质是相似的。此原理称为等电子原理2.等电子体的判断和利用
判断方法:原子总数相同,价电子总数相同的 分子为 等电子体
运用:利用等电子体的性质相似,空间构型相 同,可运用来预测分子空间的构型和性质
过程中体系能量将先变小后变大1、形成共价键的要点 电子配对原理 最大重叠原理两原子各自提供1个自旋方向相反的电子彼此配对。两个原子轨道重叠部分越大,两核间电子的概率密度越大,形成的共价键越牢固,分子越稳定。2、共价键的本质当成键原子相互接近时,原子轨道发生重叠,自旋方向相反的未成对电子形成共用电子对,两原子核间的电子概率密度增加,体系的能量降低.3、共价键的特点(1)、饱和性:原子有几个未成对电子就形成几个共价键。因为S轨道是球形对称的,所以S轨道与S轨道形成的共价键没有方向性。(2)、方向性:是不是所有的共价键都具有方向性?问题:成键原子轨道只有采用最大重叠才能形成稳定的共价键,由于p ,d,f轨道在空间有不同的伸展方向,即有方向性,因此共价键有方向性。4、用电子式表示共价键的形成过程例如用电子式表示共价键HCl、Cl2的形成过程又如 N2、H2O的形成过程 N2:
H2O:
请与离子化合物的形成过程的电子式进行比较分析:下列形成分子的原子使用哪些轨道上的电子(即是哪些原子轨道进行重叠)H2
HF
F2
O2
N2
二、共价键的类型1、非极性键:共用电子对不偏向任何原子的共价键,同种非金属元素的原子形成的共价键。
2、极性键:共用电子对发生偏向的共价键,不同种非金属元素的原子形成的共价键。成键原子的电负型相差越大,键的极性越强。
配位键:由一个原子提供一对电子与另一个接受电子的原子形成共价键。例,NH4+ 、H3O+[归纳、小结]1、共价键:原子间通过共用电子对所形成的化学键叫共价键。
2、极性键:共用电子对发生偏向的共价键,不同种元素的原子。
非极性键:共用电子对不偏向任何原子的共价键,同种元素的原子
3、共用电子对的目的是达到稳定结构(氢原子达到2个电子,其他原子达到8个电子)二、共价键的类型1.σ键:“头碰头”X++s—sX+px—sXpx—px形成σ键的电子
称为σ电子。原子轨道沿核间连线重叠(即头碰头方式)形成的共价键,叫σ键. 2.π键:“肩并肩”+IXZZpZ—pZ形成π键的电子称为π电子。原子轨道在核间连线两侧进行重叠(即采用肩并肩)方式形成的共价键,叫π键.σ键的类型π键的类型有机物中的共价键1、C – H 是σ键。2、C—C 是σ键。3、C=C 一个σ键,一个π键。4、 C ≡C 一个σ键,两个π键。乙烯、乙炔分子中C-C σ键比较稳定不容易断裂, π键比较容易断裂。请指出乙烷、乙烯、乙炔分子中存在哪些类型的共价键,分别有几个σ键,几个π键?1个σ键
+ 6个σ键3个σ键
两个π键5个σ键,
一个π键拓展视野 苯分子中的共价键请大家看课本P42~P43的相应内容。完成 P43交流与讨论1、极性键:
非极性键:HCl CO H2OCl2 N2 H22、键的极性由强到弱的顺序:F—H O– H N—H C—H三、共价键的键能与化学反应热2、共价键的键能用来衡量共价键牢固程度,共价键键能越大表示该共价键越牢固,即越不容易被破坏。1、共价键的键能:在101kPa、298K条件下,1mol气态AB分子生成气态A原子和气态B原子的过程所吸收的能量,称为AB间共价键的键能。3、键长:成键两原子间的平均间距。4、共价键键能与键长的关系:
请认真分析P45 表3-5。结论:
键长越短,键能越大,共价键越稳定。(二)、键能与反应过程中能量变化的关系P45 问题解决
核心问题是如何利用键能来计算反应过程中的能量变化。1、试利用表3—5的数据进行计算,1 mo1H2分别跟lmolCl2、lmolBr2(蒸气)反应,分别形成2 mo1HCl分子和2molHBr分子,哪一个反应释放的能量更多?如何用计算的结果说明氯化氢分子和溴化氢分子哪个更容易发生热分解生成相应的单质?
2.N2、02、F2跟H2的反应能力依次增强,从键能的角度应如何理解这一化学事实?(三)、键长、键能对分子的
化学性质有什么影响?1、形成2mo1HCl释放能量:2×431.8 kJ -(436.0kJ+242.7kJ)= 184.9 kJ
形成2 mo1HBr释放能量:2×366kJ -(436.0kJ+193.7kJ)= 102.97kJ
HCl释放能量比HBr释放能量多,因而生成的HCl更稳定,即HBr更容易发生热分解生成相应的单质. 解释因此、键长越长,键能越小,键越易断裂,
化学性质越活泼。P46 问题解决(2)△H=2 ×436kJ/mol+498kJ/mol-2×(2×463) kJ/mol=-482kJ/mol1、(1)
△H = 946kJ/mol+3×436kJ/mol-
2×(3×393)kJ/mol= -104kJ/mol2、H---X的键能分别是:
H—F = 567kj/mol
H—Cl = 431kj/mol
H—Br = 366kj/mol
H—I = 298kj/mol
结论:键能越大,分子的稳定性越强。 CO分子和N2分子的某些性质 等电子原理:原子总数相同、价电子总数相同的分子具有
相似的化学键特征,它们的许多性质是相近
的 四、原子晶体1、什么叫原子晶体?
晶体中所有原子都是通过共价键结合的空间网状结构。
2、原子晶体的特点?
由于共价键键能大,所以原子晶体一般具有很高的熔、沸点和很大的硬度,一般不溶于溶剂。
3、常见哪些物质属于原子晶体?
金刚石、单晶硅、碳化硅(金刚砂)、二氧化硅、氮化硼(BN)等。参看P47 问题解决金刚石晶体结构模型金刚石的晶体结构SiO2晶体结构石墨石墨为什么很软?石墨为层状结构,各层之间是范德华力结合,容易滑动,所以石墨很软。
石墨的熔沸点为什么很高?石墨各层均为平面网状结构,碳原子之间存在很强的共价键,故熔沸点很高。
石墨的晶体结构P47 整理与归纳几种类型化学键的比较整理与归纳 晶体比较和判断晶体类型
离子晶体
分子晶体
原子晶体离子键
范德华力
共价键离子
分子
原子较高
较低
很高NaCl、CsCl
干冰
金刚石微粒结合力熔沸点典型实例三种晶体的比较晶体类型的判断从组成上判断(仅限于中学范围):
有无金属离子?(有:离子晶体)
是否属于“四种原子晶体”?
以上皆否定,则多数是分子晶体。
从性质上判断:
熔沸点和硬度;(高:原子晶体;中:离子晶体;低:分子晶体)
熔融状态的导电性。(导电:离子晶体)课堂练习题下列不存在化学键的晶体是:
A.硝酸钾 B.干冰 C.石墨 D.固体氩
不是分子晶体的是:
A.碘 B.水 C. 硫酸铵 D.干冰
晶体中的一个微粒周围有6个微粒,这种晶体是:
A.金刚石 B.石墨 C.干冰 D.氯化钠DCD开拓思考题仔细观察左边的示意图后,回答下列问题:
金刚石与石墨的熔点均很高,那么二者熔点是否相同?为什么?若不相同,哪种更高一些?
三、等电子原理 1.原子总数相同、价电子总数相同的分子具有相似化学键特征,许多性质是相似的。此原理称为等电子原理2.等电子体的判断和利用
判断方法:原子总数相同,价电子总数相同的 分子为 等电子体
运用:利用等电子体的性质相似,空间构型相 同,可运用来预测分子空间的构型和性质
