原子结构与元素性质
图片预览








文档简介
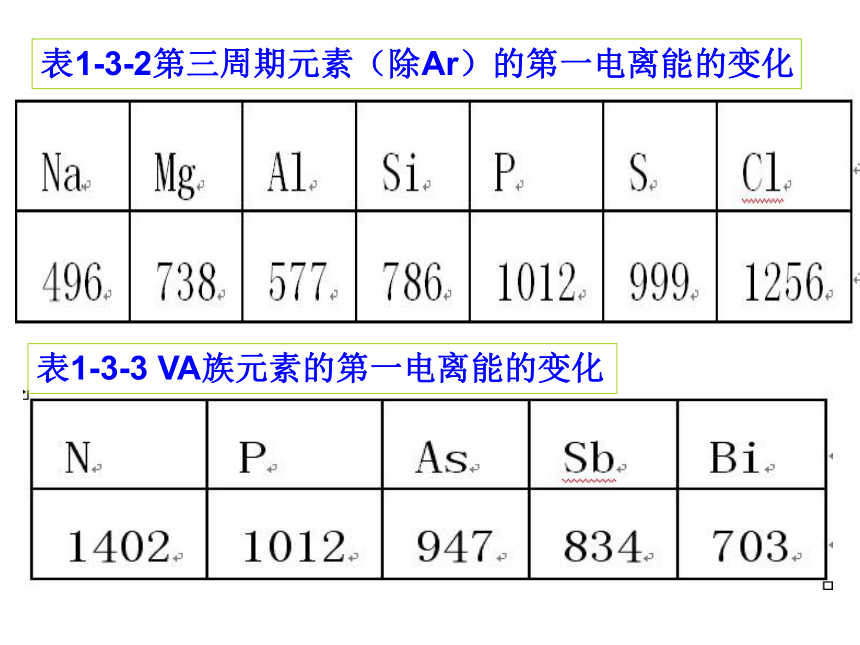
课件27张PPT。第一章?原子结构??第3节?原子结构与元素性质1 请同学们写出第3周期和VA族元素原子的价电子排布2 根据写出的价电子排布分析元素周期表中元素原子得失电子能力的变化规律 族周期IA IIA IIIA IVA VA VIA VIIA在科学研究和生产实践中,仅有定性的分析往往是不够的,为此,人们用电离能、电子亲和能、电负性来定量的衡量或比较原子得失电子能力的强弱。 表1-3-2第三周期元素(除Ar)的第一电离能的变化表1-3-3 VA族元素的第一电离能的变化问题
1.什么是电离能。
2.符号和表示方法
3.意义电离能是元素的一种性质。
从已经学过的知识出发,你能推测出电离能描述的是元素的那种性质吗?
你能分析第一电离能的数值和性质的关系吗?一、电离能及其变化规律
1.定义:
2.符号: 单位:
表示式:
气态原子或气态离子失去一个电子所需要的
最小能量叫做电离能。IM(g)= M+ (g) + e- I1(第一电离能)3.意义:表示原子或离子失去电子的难易程度 电离能越小,该气态原子越 失去电子 金属性越___ 故可判断金属原子在气态时失电子的难易M+(g)= M2+ (g) + e- I2(第二电离能)M2+(g)= M3+ (g) + e- I3(第三电离能)KJ/mol4、影响第一电离能的因素1)、主量子数
2)、有效核电荷数5、同一种元素的逐级电离能大小关系:
I11、 Mg的第一电离能比Al的大,所以Al比Mg易失去电子,但我们以前学习的金属失电子顺序中,Mg比Al易失电子,与酸反应时更剧烈。
同理:P与S
原因:条件不一致,一是气态,二是溶液解疑答惑Mg(1s22s22p63s2)正处于全满状态,能量较低,比较稳定,所以不易失去电子。
同理分析:P和S
学生分析P(1s22s22p63s23p3)半满状态,比较稳定,所以不易失去电子。从左到右,元素的第一电离能在总体上呈现由小到大的变化趋势,表示元素原子越来越难失去电子,碱金属元素的第一电离能最小,稀有气体元素的第一电离能最大产生这种趋势的原因?
随着核电荷数的增大 和原子半径的减 小,核对外层电 子的有效吸引作 用依次增强。同主族元素,自上而下第一电离能逐渐减小同主族元素原子的价电子数相同,原 子半径逐渐增 大,原子核对核 外电子的有效吸 引作用逐渐减弱原因?2.总体上金属元素第一电离能较小 非金属元素第一电离能较大。友情提示:比较金属元素、非金属元素
及稀有气体元素最外层电子数多少入手参考答案:金属元素最外层电子数较少,原子半径较大,较易失一个电子,因此第一电离能较小。非金属元素最外层电子数较多,原子半径较小,较难失一个电子,因此第一电离能较大。
稀有气体最外层电子排布 ns2np6,达稳定结构,难失电子,第一电离能大。
为什么?实质分析总之,第一电离能的周期性递变规律是原子半径、核外电子排布周期性变化的结果练习2. 从元素原子的第一电离能数据的大小可以判断出( )
A、元素原子得电子的难易
B、元素的主要化合价
C、元素原子失电子的难易
D、核外电子是分层排布的
3.下列元素中,第一电离能最小的( )
A、 K B、 Na C、P D、Cl Ac3、下列说法中正确的是 ( )
A.同周期中Ⅶ A族元素的原子半径最大
B.Ⅵ A族元素的原子,半径越大,越易得到电子
C.室温时,零族元素的单质都是气体
D.同一周期中,碱金属元素的第一电离能最大C电离能与元素的化合价 (化合价是元素性质的一种体现)
观察思考:为什么钠元素的常见价态为+1价,
镁元素的为+2价,铝元素的为+3价? 化合价与原子结构有什么关系?应用 电离能是原子核外电子排布的实验佐证,根据电离能的数值可以判断核外电子的分层排布,层与层之间电离能相差较大,电离能数值呈突跃性变化,同层内电离能差别较小。分析结果:
钠原子的第一电离能较低,而第二电离能突越式变高,也就是说,I2 》 I1。这说明钠原子很容易失去一个电子成为+1价阳离子,形成稀有气体元素原子的稳定状态后,核对外层电子的有效吸引作用变得更强,不再失去第2个电子。因此,钠元素的常见化合价为+1价。同理分析镁和铝。元素的化合价与原子的核外电子排布尤其是价电子排布有着密切的关系。
除Ⅷ、IB外,元素的最高价化合价等于它所在的族的序数,非金属元素的最高正化合价和负化合价的绝对值之和为8(H除外);
稀有气体元素原子的电子层结构时全充满的稳定结构,其原子既不易失去电子,也不易得到电子,因此稀有气体元素的化合价在通常情况下为0;
过渡金属元素的价电子较多,并且各级电离能相差不大,因此具有多种价态,如锰元素的化合价为+2——+7。综合分析 同一周期的元素而言,碱金属元素的第一电离能最小,稀有气体元素的第一电离能最大从左到右,元素的第一电离能在总体上呈现由小到大的变化趋势,表示元素原 子越来越难失去电子2、判断下列元素间的第一电离能的大小
Na K N P
F Ne Cl S
Mg Al O N课堂练习>>>><<3、将下列元素按第一电离能由大到小的顺序排列
①K Na Li
②B C Be N
③He Ne Ar
④ Na Al S PLi >Na> KN> C >Be> BHe >Ne > Ar
P >S >Al> Na概念辨析1、每一周期元素中都是以碱金属开始,以稀有气体结束。
2、f区都是副族元素,s区p区都是主族元素
3、铝的第一电离能大于K的第一电离能
4、20℃时1moLNa失去1moL电子吸收650KJ能量,则Na的第一电离能为650 KJ·moL-1 错错对错1.什么是电离能。
2.符号和表示方法
3.意义
4.应用小结元素金属性 同周期左→ 右减小
同主族上→ 下增强元素第一电离能 同周期左→ 右增大趋势(两处反常)
同主族上→ 下减小原子结构 原子核吸引电子的能力
原子形成稳定结构的趋势
1.什么是电离能。
2.符号和表示方法
3.意义电离能是元素的一种性质。
从已经学过的知识出发,你能推测出电离能描述的是元素的那种性质吗?
你能分析第一电离能的数值和性质的关系吗?一、电离能及其变化规律
1.定义:
2.符号: 单位:
表示式:
气态原子或气态离子失去一个电子所需要的
最小能量叫做电离能。IM(g)= M+ (g) + e- I1(第一电离能)3.意义:表示原子或离子失去电子的难易程度 电离能越小,该气态原子越 失去电子 金属性越___ 故可判断金属原子在气态时失电子的难易M+(g)= M2+ (g) + e- I2(第二电离能)M2+(g)= M3+ (g) + e- I3(第三电离能)KJ/mol4、影响第一电离能的因素1)、主量子数
2)、有效核电荷数5、同一种元素的逐级电离能大小关系:
I1
同理:P与S
原因:条件不一致,一是气态,二是溶液解疑答惑Mg(1s22s22p63s2)正处于全满状态,能量较低,比较稳定,所以不易失去电子。
同理分析:P和S
学生分析P(1s22s22p63s23p3)半满状态,比较稳定,所以不易失去电子。从左到右,元素的第一电离能在总体上呈现由小到大的变化趋势,表示元素原子越来越难失去电子,碱金属元素的第一电离能最小,稀有气体元素的第一电离能最大产生这种趋势的原因?
随着核电荷数的增大 和原子半径的减 小,核对外层电 子的有效吸引作 用依次增强。同主族元素,自上而下第一电离能逐渐减小同主族元素原子的价电子数相同,原 子半径逐渐增 大,原子核对核 外电子的有效吸 引作用逐渐减弱原因?2.总体上金属元素第一电离能较小 非金属元素第一电离能较大。友情提示:比较金属元素、非金属元素
及稀有气体元素最外层电子数多少入手参考答案:金属元素最外层电子数较少,原子半径较大,较易失一个电子,因此第一电离能较小。非金属元素最外层电子数较多,原子半径较小,较难失一个电子,因此第一电离能较大。
稀有气体最外层电子排布 ns2np6,达稳定结构,难失电子,第一电离能大。
为什么?实质分析总之,第一电离能的周期性递变规律是原子半径、核外电子排布周期性变化的结果练习2. 从元素原子的第一电离能数据的大小可以判断出( )
A、元素原子得电子的难易
B、元素的主要化合价
C、元素原子失电子的难易
D、核外电子是分层排布的
3.下列元素中,第一电离能最小的( )
A、 K B、 Na C、P D、Cl Ac3、下列说法中正确的是 ( )
A.同周期中Ⅶ A族元素的原子半径最大
B.Ⅵ A族元素的原子,半径越大,越易得到电子
C.室温时,零族元素的单质都是气体
D.同一周期中,碱金属元素的第一电离能最大C电离能与元素的化合价 (化合价是元素性质的一种体现)
观察思考:为什么钠元素的常见价态为+1价,
镁元素的为+2价,铝元素的为+3价? 化合价与原子结构有什么关系?应用 电离能是原子核外电子排布的实验佐证,根据电离能的数值可以判断核外电子的分层排布,层与层之间电离能相差较大,电离能数值呈突跃性变化,同层内电离能差别较小。分析结果:
钠原子的第一电离能较低,而第二电离能突越式变高,也就是说,I2 》 I1。这说明钠原子很容易失去一个电子成为+1价阳离子,形成稀有气体元素原子的稳定状态后,核对外层电子的有效吸引作用变得更强,不再失去第2个电子。因此,钠元素的常见化合价为+1价。同理分析镁和铝。元素的化合价与原子的核外电子排布尤其是价电子排布有着密切的关系。
除Ⅷ、IB外,元素的最高价化合价等于它所在的族的序数,非金属元素的最高正化合价和负化合价的绝对值之和为8(H除外);
稀有气体元素原子的电子层结构时全充满的稳定结构,其原子既不易失去电子,也不易得到电子,因此稀有气体元素的化合价在通常情况下为0;
过渡金属元素的价电子较多,并且各级电离能相差不大,因此具有多种价态,如锰元素的化合价为+2——+7。综合分析 同一周期的元素而言,碱金属元素的第一电离能最小,稀有气体元素的第一电离能最大从左到右,元素的第一电离能在总体上呈现由小到大的变化趋势,表示元素原 子越来越难失去电子2、判断下列元素间的第一电离能的大小
Na K N P
F Ne Cl S
Mg Al O N课堂练习>>>><<3、将下列元素按第一电离能由大到小的顺序排列
①K Na Li
②B C Be N
③He Ne Ar
④ Na Al S PLi >Na> KN> C >Be> BHe >Ne > Ar
P >S >Al> Na概念辨析1、每一周期元素中都是以碱金属开始,以稀有气体结束。
2、f区都是副族元素,s区p区都是主族元素
3、铝的第一电离能大于K的第一电离能
4、20℃时1moLNa失去1moL电子吸收650KJ能量,则Na的第一电离能为650 KJ·moL-1 错错对错1.什么是电离能。
2.符号和表示方法
3.意义
4.应用小结元素金属性 同周期左→ 右减小
同主族上→ 下增强元素第一电离能 同周期左→ 右增大趋势(两处反常)
同主族上→ 下减小原子结构 原子核吸引电子的能力
原子形成稳定结构的趋势
