共价键课件
图片预览







文档简介
课件35张PPT。第二章 分子结构与性质第一节 共价键化学是在分子层次上研究物质的科学。分子由原子构成,绝大多数物质分子是由原子相互结合构成的,只有极少数物质的分子是由单个原子构成。
20世纪初,在原子结构理论的基础上,建立了化学键的电子理论。共价键是现代化学键的理论核心.知识回顾:
什么化学键、离子键、共价键?
通常哪些元素之间可以形成离子键、共价键?
离子键、共价键是如何形成的?用电子式来表示下列物质的形成过程?NaCl H2 HCl Cl2 N2一、共价键1、概念:
2、成键微粒:
3、键的本质:
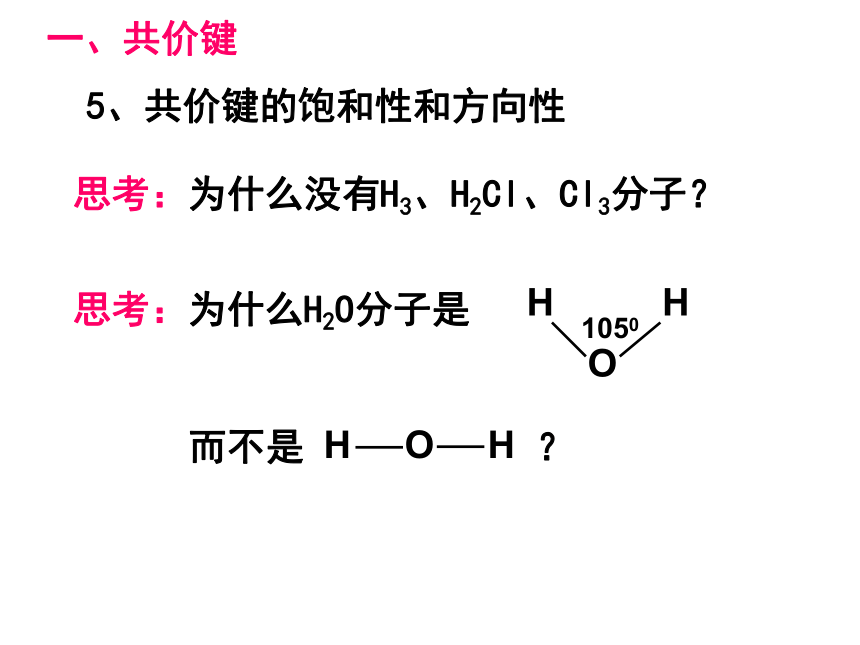
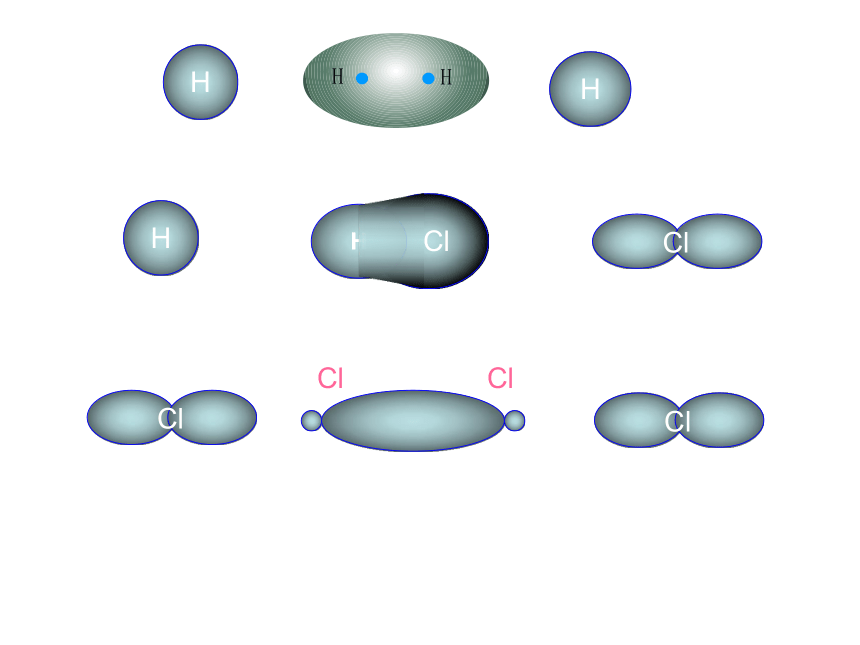
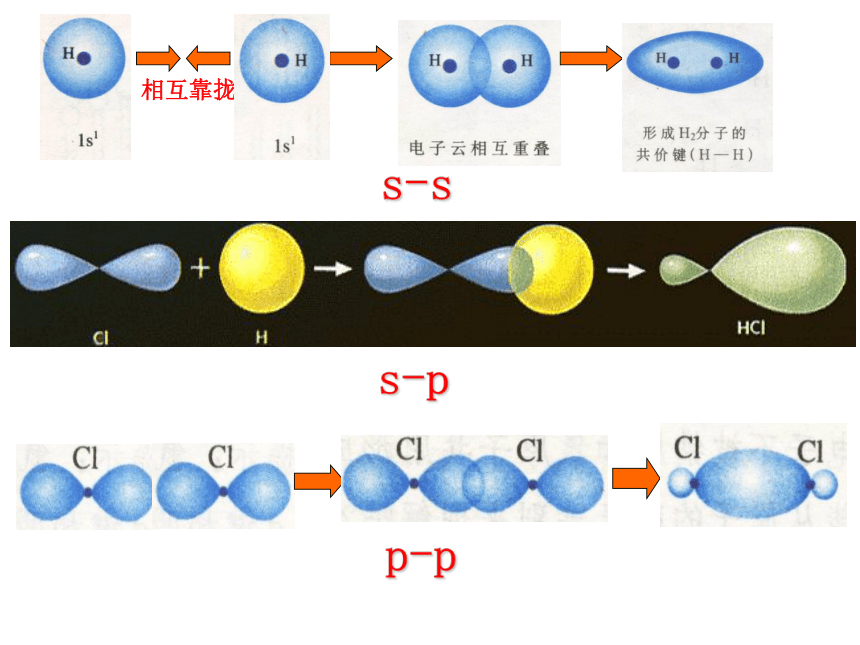
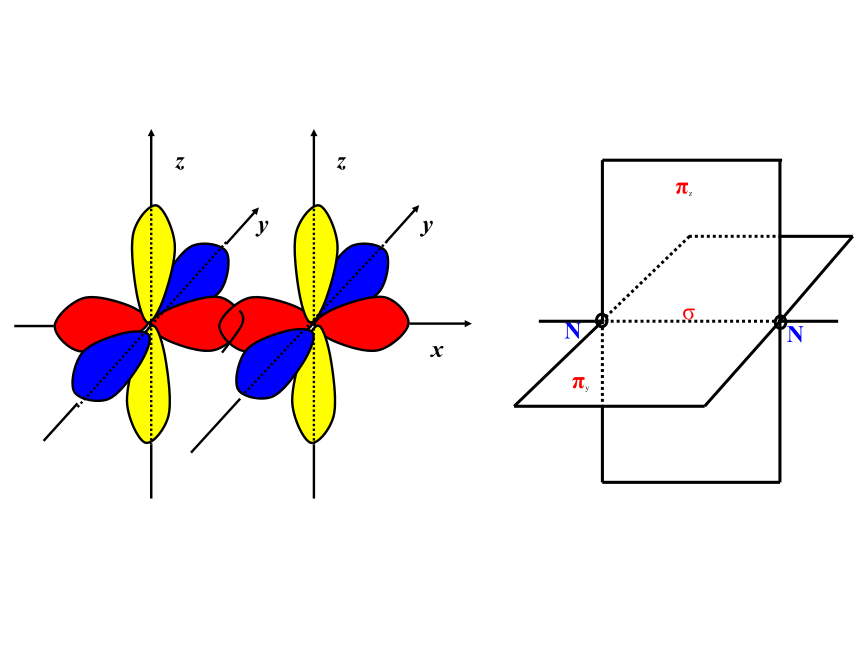
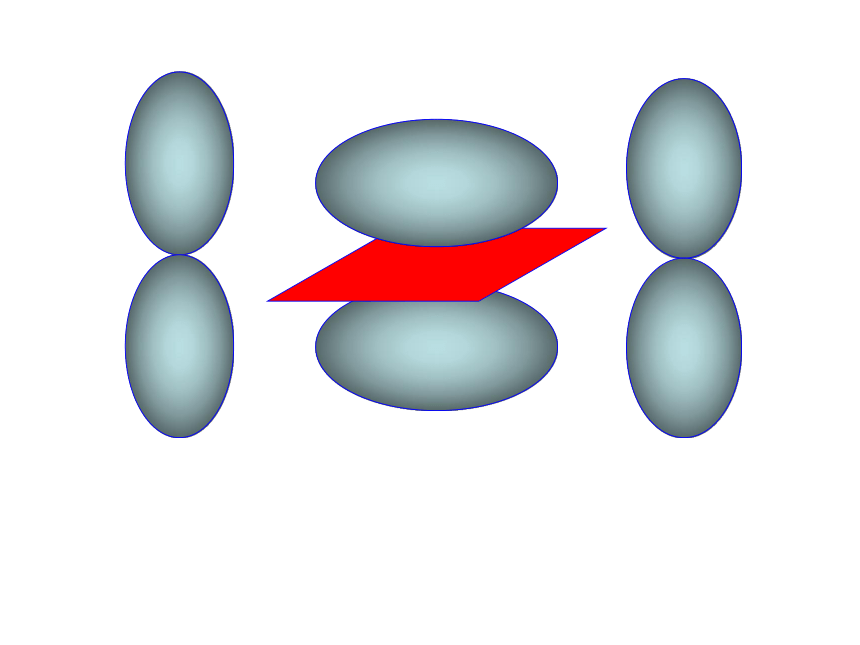
4、键的类型:原子间通过共用电子对所形成的相互作用一般为电负性相差小于1.7的原子共用电子对(电子云的重叠)非极性键、极性键一、共价键5、共价键的饱和性和方向性思考:为什么没有H3、H2Cl、Cl3分子?(1) σ键 原子轨道在核间连线方向以“头碰头”方式互相重叠形成的共价键6、σ键和π键HHHs-ss-pp-p 原子轨道在核间连线方向以“肩并肩”方式相互重叠形成的共价键(2)π键σ键和π键的比较“头碰头”“肩并肩”轴对称镜像对称强度大,不易断裂强度较小易断裂共价单键是 键,共价双键中一个是 键,另一个是 键,共价三键中一个是 键,另两个为 键σσπσπ以上原子轨道相互重叠形成的σ键和π键 ,总称价键轨道σ键的常见类型有(1)s-s,(2)s-p,
(3)p-p,请指出下列分子σ键所属类型:
A、HBr
B、NH3
C、F2
D、H2s-ps-pp-ps-s下列物质中哪些是含有π键的分子
A. H2O B. CH4
C. CO2 D. C2H2 乙烷、乙烯和乙炔分子中的共价键分别由几个σ键和几个π键组成?乙烷: 个σ键
乙烯: 个σ键 个π键
乙炔: 个σ键 个π键写出电子式:
NaOH Na2O2 NH4Cl
N2 H2 NH3
CH4 H2O2 CO2
C2H4 C2H2二、键参数——键能、键长与键角1、键能定义:单位:与共价键的稳定性:键能越大,键越牢固。KJ?mol-1气态基态原子形成1mol共价键释放的最低能量试比较氯化氢与碘化氢的稳定性,解释原因。下列说法中,正确的是
A.在N2分子中,两个原子的总键能是单个键能的三倍
B.N2分子中有一个σ键、两个π键
C.N2分子中有两个个σ键、一个π键
D.N2分子中存在一个σ键、一个π键已知:H—H:键能为436kJ/mol,
Cl—Cl键能为243kJ/mol,
H—Cl键能为431kJ/mol。通过计算确定反应:H2(g)+Cl2(g)=2HCl(g)的反应热。
二、键参数——键能、键长与键角定义:
与共价键的稳定性:
2、键长形成共价键的两个原子之间的核间的距离一般来说,键长越短,键能越大,分子越稳定.资料卡片:共价半径:
范氏半径:
金属半径:二、键参数——键能、键长与键角定义:
与分子的空间构型:
3、键角分子中两个共价键之间的夹角称键角。键长和键角决定分子的立体结构下列分子中键角最大的是 ( )
A.CH4 B.NH3
C.H2O D.CO2三、等电子原理原子总数相同、价电子总数相同的分子具有相似化学键特征,许多性质是相似的。此原理称为等电子原理CO和N2,CH4和NH4+下列物质属于等电子体一组的是( )
A.CH4和NH4+ B.B3H6N3和C6H6 C.F-和Mg D.H2O和CH4根据等电子原理,下列分子或离子与SO42-有相似结构的是
A.PCl5 B.CCl4
C.NF3 D.NH4+
与NO3-互为等电子体的是
A.SO3 B.BF3 C.CH4 D.NO2下列关于N2O的说法正确的是
A.N2O的空间构型与CO2构型不同
B.N2O的空间构型与H2O构型相似
C.N2O的空间构型与NH3构型相似
D.N2O的空间构型为直线型 “笑气”(N2O)是人类最早应用于医疗的麻醉剂之一。有关理论认为N2O与CO2分子具有相似的结构(包括电子式);又已知N2O分子中氧原子只与一个氮原子相连,则N2O的电子式可表示为 ,
由此可知它 (填“含有”或“不含”)非极性键。1919年,Langmuir提出等电子原理:原子数相同、电子数相同的分子,互称为等电子体。等电子体的结构相似、物理性质相近。
?1? 根据上述原理,仅由第2周期元素组成的共价分子中,互为等电子体的是:
和 ; 和 。?2? 此后,等电子原理又有所发展。例如,由短周期元素组成的微粒,只要其原子数相同,各原子最外层电子数之和相同,也可互称为等电子体,它们也具有相似的结构特征。在短周期元素组成的物质中,与互为等电子体的分子有: 、 ;这些等电子体的微粒构型为 形。
20世纪初,在原子结构理论的基础上,建立了化学键的电子理论。共价键是现代化学键的理论核心.知识回顾:
什么化学键、离子键、共价键?
通常哪些元素之间可以形成离子键、共价键?
离子键、共价键是如何形成的?用电子式来表示下列物质的形成过程?NaCl H2 HCl Cl2 N2一、共价键1、概念:
2、成键微粒:
3、键的本质:
4、键的类型:原子间通过共用电子对所形成的相互作用一般为电负性相差小于1.7的原子共用电子对(电子云的重叠)非极性键、极性键一、共价键5、共价键的饱和性和方向性思考:为什么没有H3、H2Cl、Cl3分子?(1) σ键 原子轨道在核间连线方向以“头碰头”方式互相重叠形成的共价键6、σ键和π键HHHs-ss-pp-p 原子轨道在核间连线方向以“肩并肩”方式相互重叠形成的共价键(2)π键σ键和π键的比较“头碰头”“肩并肩”轴对称镜像对称强度大,不易断裂强度较小易断裂共价单键是 键,共价双键中一个是 键,另一个是 键,共价三键中一个是 键,另两个为 键σσπσπ以上原子轨道相互重叠形成的σ键和π键 ,总称价键轨道σ键的常见类型有(1)s-s,(2)s-p,
(3)p-p,请指出下列分子σ键所属类型:
A、HBr
B、NH3
C、F2
D、H2s-ps-pp-ps-s下列物质中哪些是含有π键的分子
A. H2O B. CH4
C. CO2 D. C2H2 乙烷、乙烯和乙炔分子中的共价键分别由几个σ键和几个π键组成?乙烷: 个σ键
乙烯: 个σ键 个π键
乙炔: 个σ键 个π键写出电子式:
NaOH Na2O2 NH4Cl
N2 H2 NH3
CH4 H2O2 CO2
C2H4 C2H2二、键参数——键能、键长与键角1、键能定义:单位:与共价键的稳定性:键能越大,键越牢固。KJ?mol-1气态基态原子形成1mol共价键释放的最低能量试比较氯化氢与碘化氢的稳定性,解释原因。下列说法中,正确的是
A.在N2分子中,两个原子的总键能是单个键能的三倍
B.N2分子中有一个σ键、两个π键
C.N2分子中有两个个σ键、一个π键
D.N2分子中存在一个σ键、一个π键已知:H—H:键能为436kJ/mol,
Cl—Cl键能为243kJ/mol,
H—Cl键能为431kJ/mol。通过计算确定反应:H2(g)+Cl2(g)=2HCl(g)的反应热。
二、键参数——键能、键长与键角定义:
与共价键的稳定性:
2、键长形成共价键的两个原子之间的核间的距离一般来说,键长越短,键能越大,分子越稳定.资料卡片:共价半径:
范氏半径:
金属半径:二、键参数——键能、键长与键角定义:
与分子的空间构型:
3、键角分子中两个共价键之间的夹角称键角。键长和键角决定分子的立体结构下列分子中键角最大的是 ( )
A.CH4 B.NH3
C.H2O D.CO2三、等电子原理原子总数相同、价电子总数相同的分子具有相似化学键特征,许多性质是相似的。此原理称为等电子原理CO和N2,CH4和NH4+下列物质属于等电子体一组的是( )
A.CH4和NH4+ B.B3H6N3和C6H6 C.F-和Mg D.H2O和CH4根据等电子原理,下列分子或离子与SO42-有相似结构的是
A.PCl5 B.CCl4
C.NF3 D.NH4+
与NO3-互为等电子体的是
A.SO3 B.BF3 C.CH4 D.NO2下列关于N2O的说法正确的是
A.N2O的空间构型与CO2构型不同
B.N2O的空间构型与H2O构型相似
C.N2O的空间构型与NH3构型相似
D.N2O的空间构型为直线型 “笑气”(N2O)是人类最早应用于医疗的麻醉剂之一。有关理论认为N2O与CO2分子具有相似的结构(包括电子式);又已知N2O分子中氧原子只与一个氮原子相连,则N2O的电子式可表示为 ,
由此可知它 (填“含有”或“不含”)非极性键。1919年,Langmuir提出等电子原理:原子数相同、电子数相同的分子,互称为等电子体。等电子体的结构相似、物理性质相近。
?1? 根据上述原理,仅由第2周期元素组成的共价分子中,互为等电子体的是:
和 ; 和 。?2? 此后,等电子原理又有所发展。例如,由短周期元素组成的微粒,只要其原子数相同,各原子最外层电子数之和相同,也可互称为等电子体,它们也具有相似的结构特征。在短周期元素组成的物质中,与互为等电子体的分子有: 、 ;这些等电子体的微粒构型为 形。
