典型非金属元素及其化合物
图片预览







文档简介
课件35张PPT。元素及其化合物
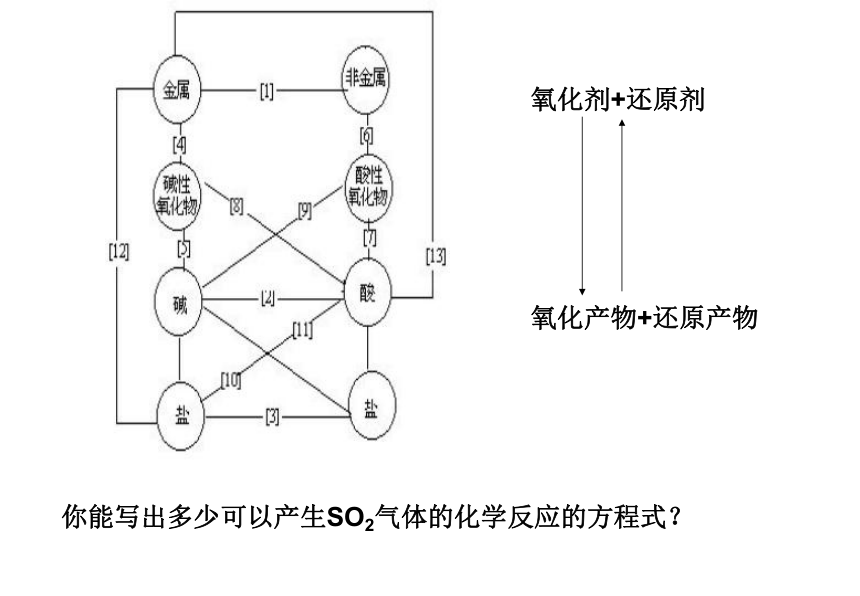
无机框图推断元素及其化合物知识是中学化学最主干的知识,我认为复习的主要任务是有序贮存,考试时能够快速提取;熟记常见的化合物的性质、变化、转化、制备等有关知识。由于这些知识零碎、繁琐,所以在复习时建议大家可以从以下几种途径进行系统的记忆。1、非金属元素的单质在常温下都呈气态吗?
2、由短周期非金属元素形成的氢化物在常温下都呈气态吗?
3、由短周期非金属元素形成的氧化物都是酸性氧化物吗?
4、哪些非金属单质与H2O能反应?(与酸、与碱反应)
想一想:H He
B C N O F Ne
Si P S Cl Ar
As As Br Kr
Te I Xe
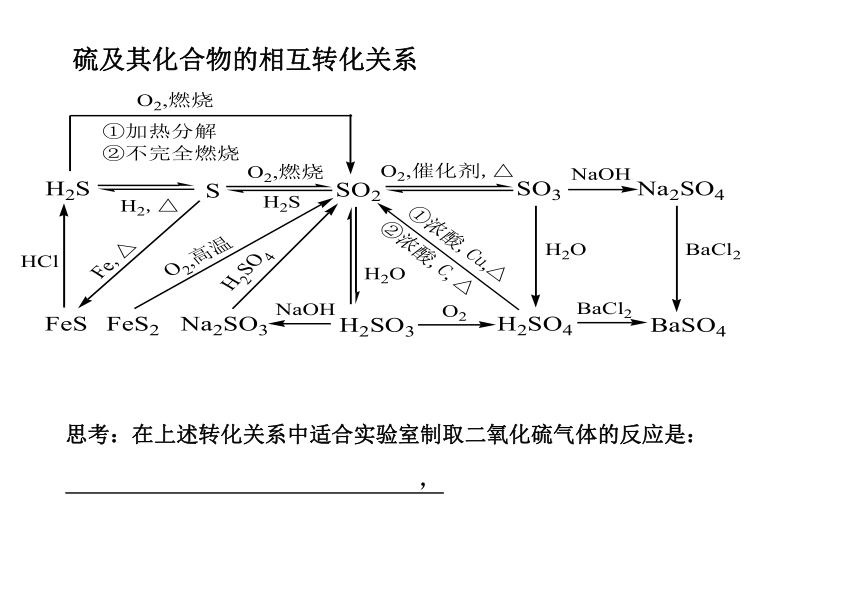
At Rn你能写出多少可以产生SO2气体的化学反应的方程式?试一试:S+O2 SO2 H 2SO4 +Na2SO3==H2O+SO2↑+Na2SO4Cu+2H2SO4(浓) CuSO4+SO2↑+H2O4 FeS2 +11O2 2Fe2O3+8SO22H2S+3O2 2SO2+2H2O 结论:不同价态的硫及其化合物之间可以相互转化硫及其化合物的相互转化关系思考:在上述转化关系中适合实验室制取二氧化硫气体的反应是:
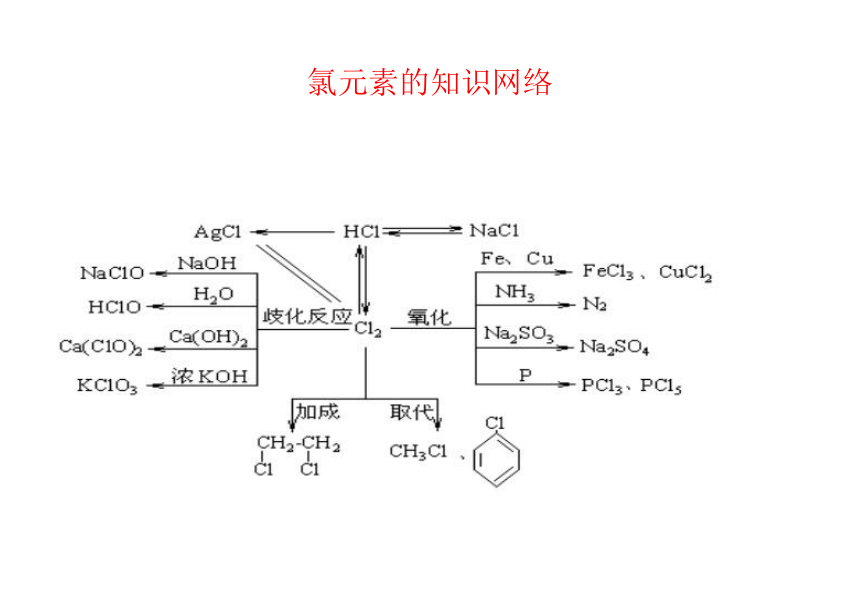
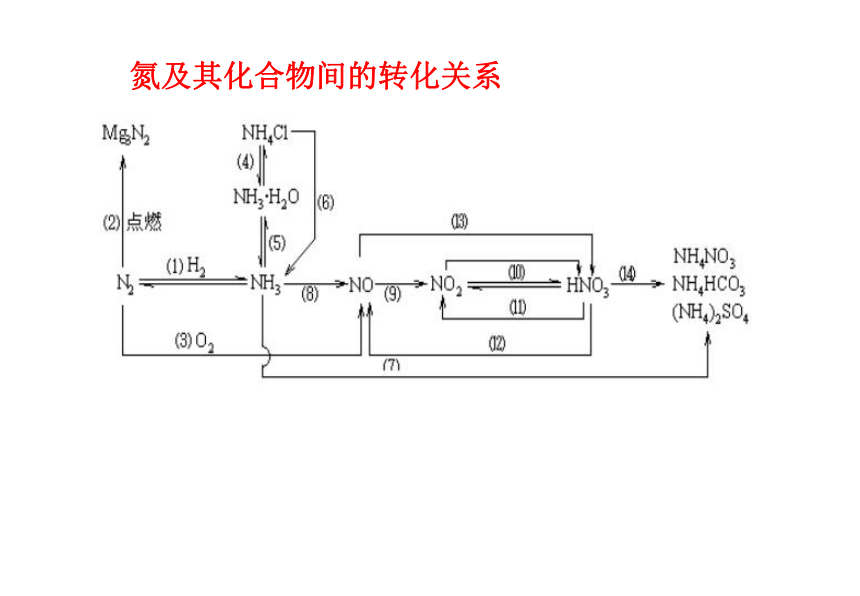
,氯元素的知识网络 氮及其化合物间的转化关系 (09年海南化学·13)(9分)
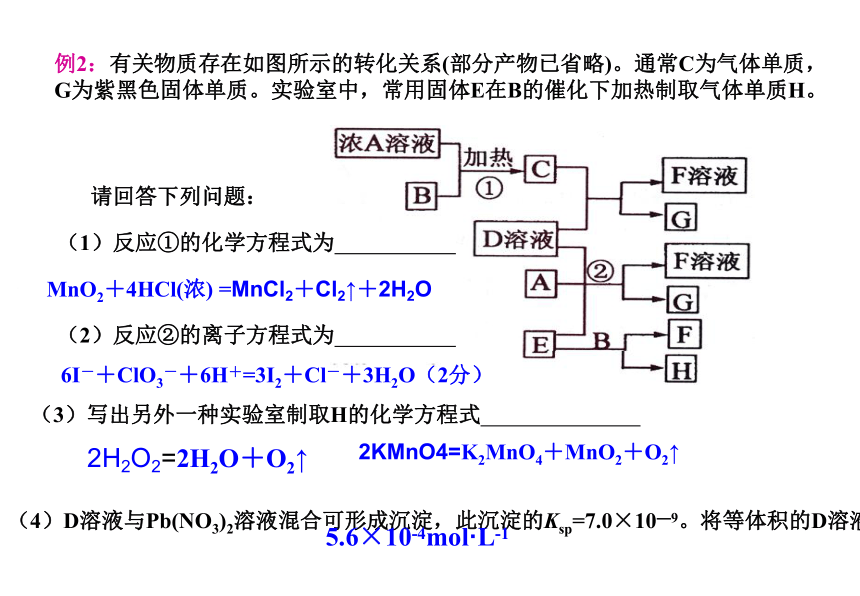
有关物质存在如图所示的转化关系(部分产物已省略)。通常C为气体单质,G为紫黑色固体单质。实验室中,常用固体E在B的催化下加热制取气体单质H。
请回答下列问题:
(1)反应①的化学方程式为
(2)反应②的离子方程式为
(3)写出另外一种实验室制取H的化学方程式
(4)D溶液与Pb(NO3)2溶液混合可形成沉淀,此沉淀的Ksp=7.0×10—9。将等体积的D溶液与Pb(NO3)2溶液混合,若D的浓度为1×10—2mo1/L ,则生成沉淀所需Pb(NO3)2溶液的最小浓度为 。
MnO2+4HCl(浓) =MnCl2+Cl2↑+2H2O
6I-+ClO3-+6H+=3I2+Cl-+3H2O(2分)
2H2O2=2H2O+O2↑2KMnO4=K2MnO4+MnO2+O2↑5.6×10-4mol·L-1 例2:有关物质存在如图所示的转化关系(部分产物已省略)。通常C为气体单质,G为紫黑色固体单质。实验室中,常用固体E在B的催化下加热制取气体单质H。例3:工业上常用氨氧化法生产硝酸,其过程包括氨的催化氧化(催化剂为铂铑合金丝网)、一氧化氮的氧化和水吸收二氧化氮生成硝酸。请回答下列问题:
(1)氨催化氧化的化学方程式为 :
(2)原料气中空气必须过量,其主要原因是 ;
(3)将铂铑合金做成薄丝网的主要原因是 ;
(4)水吸收二氧化氮生成硝酸为放热反应,其化学方程式为 ,为了提高水对二氧化氮的吸收率,可采取的措施为 (3分)
提高氨的转化率和一氧化氮的转化率
增大单位质量的催化剂与反应物的接触面积
3NO2+H2O=2HNO3+NO 加压 降温 4NH3+5O2 4NO+6H2O熟记一些特征信息提供思维的起点AgI、 FeS2、S(晶体)
S(↓)、Na2O2、AgBr
Cu
C、FeS、CuS、CuO、MnO2、Fe3O4、FeO
KMnO4、I2
Fe2O3、红磷 Fe(OH)3
BaSO4、BaCO3、CaCO3、AgCl…
Cu(OH)2溶液:Fe2+、Fe3+、Cu2+、
MnO4-、[Fe(SCN)]2+NO2、溴蒸气
Cl21、几种物质的特征颜色1.焰色反应显黄色的元素是__,显紫色(透过钴玻璃)的元素是__
2.有臭鸡蛋气味或能使湿润的________ 试纸变黑的气体是 ______
3.在空气中由无色迅速变为红棕色的气体是_________
4.使品红溶液褪色的往往是 __________
5.能使淀粉变蓝的是 __________
6.与碱溶液反应生成白色沉淀且放置空气中变灰绿色最终变红褐色的离子是_________
7.滴入_____ 溶液显血红色以及遇苯酚显紫色的离子是 _______
8.既能跟酸反应又能跟碱反应且生成气体的物质一般是
_________________________________________________________NOSO2 (Cl2使品红溶液褪色后不恢复)I2 Fe2+Al,NH4HCO3 ,(NH4)2CO3 , NH4HSO3 ,(NH4)2SO3 , (NH4)2S, NH4HS2、几种物质的特征反应现象9.能使湿润的红色石蕊试纸变蓝的气体是_____
10.与碱反应产生气体的物质是_________________
产生气体一般是_________
11.与水反应产生气体的物质一般是_________________
12.既能酸反应,又能与碱反应的物质是
___________________________________________________
13.既产生沉淀又产生气体的物质一般是
__________________________________________________
__________________________________________________
__________________________________________________NH3Na 、F2 、Na2O2Al 、Al2O3、Al(OH)3、弱酸弱碱盐、弱酸的酸式盐Al、Si、铵盐H2、NH3CaC2、Al2S3、Mg3N2 与H2O; S2O32-与H+;
CO32-、HCO3-、 SO32- 、 HSO3-、 S2-、HS- 与Al3+;
CO32-、HCO3-与Fe3+(双水解)例1:下列各组溶液不用任何试剂,能否鉴别出来? ①FeCl3 MgCl2 NaNO3 K2SO4
②Na2CO3 BaCl2 HCl NaCl 练习1:有失去标鉴的四瓶溶液①FeCl3;②MgCl2;③NaCl;④KOH不用任何其他试剂,将其鉴别出来的顺序为 。
练习2:有失去标鉴的三瓶溶液BaCl2、K2CO3、MgSO4,只用一种试剂将它们区别出来,这种试剂可以是 。
练习3:将一包白色粉末,可能含有无水硫酸铜,碳酸钠,硝酸钾,氯化钙,碳酸钡中的一种或几种,将该白色粉末溶于水得到无色透明溶液,向溶液中加入盐酸有气体放出,试推断该白色粉末一定含有
一定没有 可能含有 1、一些特别的连续变化关系A为NH3、H2S、S、CH4、C、Na,D为O2A为P,D为Cl2A为C,D为H2OA为AlO2-,D为H+A为Al3+,D为OH-A为Cl2,D为Fe4、几种物质的特征转化关系A为AgNO3,D为NH3A为Na,D为O2A为乙醇,D为O23、注意几个典型转化关系元素及其化合物的性质是高考试题命题的重要载体,了解近年高考试题的命题特点,是提高解题能力的重要途径,现在就让我们来分析试题的特点: 特点一:与元素周期表相结合命题,推断出相应的元素后,融合化学反应原理考察学生对元素化合物知识的理解和应用能力以及书面表达能力H-C=N例1:(08北京卷)通常状况下,X、Y和Z是三种气态单质。X的组成元素是第三周期原子半径最小的元素(稀有气体元素除外);Y和Z均由元素R组成,反应Y+2I-+2H+===I2+Z+H2O常作为Y的鉴定反应。
(3)举出实例说明X的氧化性比硫单质的氧化性强(用化学方程式表示)。_________________________________________。
(4)气体(CN)2与X化学性质相似,也能与H2反应生成HCN(其水溶液是一种酸)。
①HCN分子中含有4个共价键,
其结构式是____________________。
②KCN溶液显碱性,原因是(用离子方程式表示)
_________________________________。CNˉ+H2O HCN+OHˉ H He
Li Be B C N O F Ne
Na Mg Al Si P S Cl Arc加热褪色后的溶液,若溶液恢复红色,则原通入气体为SO2;若溶液不变红,则原通入气体是O3例1:(08北京卷)通常状况下,X、Y和Z是三种气态单质。X的组成元素是第三周期原子半径最小的元素(稀有气体元素除外);Y和Z均由元素R组成,反应Y+2I-+2H+===I2+Z+H2O常作为Y的鉴定反应。
(1)Y与Z的关系是(选填字母)___________。
a、同位素 b、同系物
c、同素异形体 d、同分异构体
(2)将Y和二氧化硫分别通入品红溶液,都能使品红褪色。简述用褪色的溶液区别二者的实验方法
___________________________________________________________。
H He
Li Be B C N O F Ne
Na Mg Al Si P S Cl Ar特点二:给出元素及其化合的一些性质以及相互转化的一些信息,以推断的形式考察学生对元素及化合物知识的理解、记忆和掌握,同时还要求学生准确的进行书面表达。例2:已知A、B、C、D、E为中学化学常见物质,A、B、C、D、E中均含有同一种元素,A、C均为气体,E为液体,下图中箭头
上的反应物和反应条件均已略去
(1)当A与E反应生成B和C时,则A、E共同含有乙元素。生成的C气体易液化。常温常压下D是气体,冰水冷却D时变成无色晶体,此无色晶体的化学式是 。
根据所学的氧化还原反应知识判断:在A~E各物质中,在一定条件下能与D发生氧化还原反应的物质有 (填字母)。D溶于纯净的E时,能按物质的量比1:1化合,生成物的化学式可表示为
(写成化合物、复合物或氧化物形式均可)。试描述气体C的物理性质
________________________________。SO3 A和BH2S2O7或H2SO4·SO3或2SO3·H2OSO2是无色有刺激性气味的气体,密度比空气大,易溶于水,有毒H He
Li Be B C N O F Ne
Na Mg Al Si P S Cl Ar例2:已知A、B、C、D、E为中学化学常见物质,A、B、C、D、E中均含有同一种元素,A、C均为气体,E为液体,下图中箭头上的反应物和反应条件均已略去
(2)当A与E发生化合反应时,能观察到空气中形成大量的白烟,则A、E共同含有甲元素。通过上述描述可知:A的化学为 ,E的化学式为 。当小心加热A与E化合时的生成物F时,可得到一种无色无味的气体G(G和CO2具有相同的原子数目和电子数目)和一种无色无味的液体H,写出F分解生成的
G+H的化学方程式 。
NH3 HNO3NH4NO3 N2O↑+2H2O
H He
Li Be B C N O F Ne
Na Mg Al Si P S Cl Ar特点三:以实验的设计、评价形式考察元素和化合物知识,试题往往在课本实验基础上有一定的创新,这要求学生对课本实验及其原理有深刻的理解,能应用在新的情景中解决问题例3(04江苏)有两个实验小组的同学为探究过氧化钠与二氧化硫的反应,都用如下图所示的装置进行实验。通入SO2气体,将带余烬的木条插入试管C中,木条复燃。请回答下列问题:
(1)第1小组同学认为 Na2O2与SO2反应生成了Na2SO3和O2,该反应的化学方程式是:
(2)请设计一种实验方案证明 Na2O2与SO2反应生成的白色固体中有 Na2SO3
2Na2O2+2SO2==2Na 2SO3+O2 取白色固体,加稀硫酸,产生能使品红溶液褪色的气体。 例3(04江苏)有两个实验小组的同学为探究过氧化钠与二氧化硫的反应,都用如下图所示的装置进行实验。通入SO2气体,将带余烬的木条插入试管C中,木条复燃。请回答下列问题
(3)第2小组同学认为Na2O2与SO2
反应除了生成Na2SO3和O2外,还
有Na2SO4生成。为检验是否有
Na2SO4生成,他们设计了如下方
案:
上述方案是否合理? 。
请简要说明两点理由:① ;
② 。 不合理 稀硝酸能将亚硫酸钡氧化为硫酸钡如果反应后的固体中还残留Na2O2,它溶于水后能将亚硫酸根氧化成硫酸根 课堂反馈1A、B、C是短周期元素的三种常见非金属单质,常温下B为无色气体,A、C为固体。甲、乙、丙为中学常见的三种化合物,常温下C易溶于乙中。A、B、C与甲、乙、丙之间的转化关系如下图所示:试回答下列问题:
(1)甲的电子式:__________。
(2)写出甲与NaOH溶液反应的离子方程式__________
CO2+2OHˉ=CO32ˉ﹢H2OH He
Li Be B C N O F Ne
Na Mg Al Si P S Cl ArA、B、C是短周期元素的三种常见非金属单质,常温下B为无色气体,A、C为固体。甲、乙、丙为中学常见的三种化合物,常温下C易溶于乙中。A、B、C与甲、乙、丙之间的转化关系如下图所示:试回答下列问题:
(3)下列物质能用来鉴别甲和丙的是:__(填序号)
①溴水;②BaCl2溶液;③Ca(OH)2溶液;④酸性KMnO4溶液;⑤品红溶液;⑥石蕊试液。
(4)写出乙在气体B中燃烧的化学方程式__________
①④⑤CS2+O2 CO2+SO2课堂反馈2已知Q、R、X、Y、Z为前20号元素中的五种,Q的低价氧化物与X单质分子的电子总数相等,R与Q同族,Y和Z的离子与Ar原子的电子结构相同且Y的原子序数小于Z。
(1)Q的最高价氧化物,其固态属于 _______晶体,俗名叫_________
(2)R的氢化物分子的空间构型是______________属于________分子(填“极性”或“非极性”) ;它与X形成的化合物可作为一种重要的陶瓷材料,其化学式是______________;分子干冰正四面体非极性Si3N4 H He
Li Be B C N O F Ne
Na Mg Al Si P S Cl Ar
K Ca课堂反馈2已知Q、R、X、Y、Z为前20号元素中的五种,Q的低价氧化物与X单质分子的电子总数相等,R与Q同族,Y和Z的离子与Ar原子的电子结构相同且Y的原子序数小于Z。
(3)X的常见氢化物的空间构型是________________它的另一氢化物X2H4是一种火箭燃料的成分,其电子式是
__________________;
(4)Q分别与Y、Z形成的共价化合物的化学式是_____________ 和________Q与Y形成的分子的电子式是_____________________,属于 分子(填“极性”或“非极性”)。 CCl4 CS2三角锥非极性 某同学为研究硝酸与镁的反应,进行图示实验,实验现象及相关数据如下:(a)A中为一定浓度的硝酸与Mg片发生反应,生成的气体通过B后,在B中只生成一种盐,剩余气体遇空气不变色,其体积为原体积的一半。(b)从C进入D中的气体有两种,且体积比为1∶1。(c)将D加热一段时间后,E中干燥的红色石蕊试纸逐渐变蓝。(设实验前,装置中的空气已排尽;气体的体积均在同温同压下测定)已知反应中水蒸气的体积忽略不计,实验中的液体药品均过量。请回答:
(1)硝酸与Mg片反应生成的气体成分是______________________(用化学式表示)。
(2)硝酸在装置A的反应中所表现的性质有__________。
。 NO NO2 N2 H2 酸性 氧化性 课堂反馈3某同学为研究硝酸与镁的反应,进行图示实验,实验现象及相关数据如下:(a)A中为一定浓度的硝酸与Mg片发生反应,生成的气体通过B后,在B中只生成一种盐,剩余气体遇空气不变色,其体积为原体积的一半。(b)从C进入D中的气体有两种,且体积比为1∶1。(c)将D加热一段时间后,E中干燥的红色石蕊试纸逐渐变蓝。(设实验前,装置中的空气已排尽;气体的体积均在同温同压下测定)(3)写出D中发生反应的化学方程式________________
(4)若向反应后的A中加入足量的NaOH固体,使产生的气体全部逸出,其体积为硝酸与Mg片反应生成的气体体积的1/4(同温同压),写出符合上述实验事实的硝酸与Mg片反应的离子方程式_________________________
______________________________________________。 12Mg+30H++5NO3-=12Mg2++NH4++NO2↑+NO↑+N2↑+H2↑+12H2OFe2O3+3H2 2Fe+3H2O
N2+3H2 2NH3再见
2、由短周期非金属元素形成的氢化物在常温下都呈气态吗?
3、由短周期非金属元素形成的氧化物都是酸性氧化物吗?
4、哪些非金属单质与H2O能反应?(与酸、与碱反应)
想一想:H He
B C N O F Ne
Si P S Cl Ar
As As Br Kr
Te I Xe
At Rn你能写出多少可以产生SO2气体的化学反应的方程式?试一试:S+O2 SO2 H 2SO4 +Na2SO3==H2O+SO2↑+Na2SO4Cu+2H2SO4(浓) CuSO4+SO2↑+H2O4 FeS2 +11O2 2Fe2O3+8SO22H2S+3O2 2SO2+2H2O 结论:不同价态的硫及其化合物之间可以相互转化硫及其化合物的相互转化关系思考:在上述转化关系中适合实验室制取二氧化硫气体的反应是:
,氯元素的知识网络 氮及其化合物间的转化关系 (09年海南化学·13)(9分)
有关物质存在如图所示的转化关系(部分产物已省略)。通常C为气体单质,G为紫黑色固体单质。实验室中,常用固体E在B的催化下加热制取气体单质H。
请回答下列问题:
(1)反应①的化学方程式为
(2)反应②的离子方程式为
(3)写出另外一种实验室制取H的化学方程式
(4)D溶液与Pb(NO3)2溶液混合可形成沉淀,此沉淀的Ksp=7.0×10—9。将等体积的D溶液与Pb(NO3)2溶液混合,若D的浓度为1×10—2mo1/L ,则生成沉淀所需Pb(NO3)2溶液的最小浓度为 。
MnO2+4HCl(浓) =MnCl2+Cl2↑+2H2O
6I-+ClO3-+6H+=3I2+Cl-+3H2O(2分)
2H2O2=2H2O+O2↑2KMnO4=K2MnO4+MnO2+O2↑5.6×10-4mol·L-1 例2:有关物质存在如图所示的转化关系(部分产物已省略)。通常C为气体单质,G为紫黑色固体单质。实验室中,常用固体E在B的催化下加热制取气体单质H。例3:工业上常用氨氧化法生产硝酸,其过程包括氨的催化氧化(催化剂为铂铑合金丝网)、一氧化氮的氧化和水吸收二氧化氮生成硝酸。请回答下列问题:
(1)氨催化氧化的化学方程式为 :
(2)原料气中空气必须过量,其主要原因是 ;
(3)将铂铑合金做成薄丝网的主要原因是 ;
(4)水吸收二氧化氮生成硝酸为放热反应,其化学方程式为 ,为了提高水对二氧化氮的吸收率,可采取的措施为 (3分)
提高氨的转化率和一氧化氮的转化率
增大单位质量的催化剂与反应物的接触面积
3NO2+H2O=2HNO3+NO 加压 降温 4NH3+5O2 4NO+6H2O熟记一些特征信息提供思维的起点AgI、 FeS2、S(晶体)
S(↓)、Na2O2、AgBr
Cu
C、FeS、CuS、CuO、MnO2、Fe3O4、FeO
KMnO4、I2
Fe2O3、红磷 Fe(OH)3
BaSO4、BaCO3、CaCO3、AgCl…
Cu(OH)2溶液:Fe2+、Fe3+、Cu2+、
MnO4-、[Fe(SCN)]2+NO2、溴蒸气
Cl21、几种物质的特征颜色1.焰色反应显黄色的元素是__,显紫色(透过钴玻璃)的元素是__
2.有臭鸡蛋气味或能使湿润的________ 试纸变黑的气体是 ______
3.在空气中由无色迅速变为红棕色的气体是_________
4.使品红溶液褪色的往往是 __________
5.能使淀粉变蓝的是 __________
6.与碱溶液反应生成白色沉淀且放置空气中变灰绿色最终变红褐色的离子是_________
7.滴入_____ 溶液显血红色以及遇苯酚显紫色的离子是 _______
8.既能跟酸反应又能跟碱反应且生成气体的物质一般是
_________________________________________________________NOSO2 (Cl2使品红溶液褪色后不恢复)I2 Fe2+Al,NH4HCO3 ,(NH4)2CO3 , NH4HSO3 ,(NH4)2SO3 , (NH4)2S, NH4HS2、几种物质的特征反应现象9.能使湿润的红色石蕊试纸变蓝的气体是_____
10.与碱反应产生气体的物质是_________________
产生气体一般是_________
11.与水反应产生气体的物质一般是_________________
12.既能酸反应,又能与碱反应的物质是
___________________________________________________
13.既产生沉淀又产生气体的物质一般是
__________________________________________________
__________________________________________________
__________________________________________________NH3Na 、F2 、Na2O2Al 、Al2O3、Al(OH)3、弱酸弱碱盐、弱酸的酸式盐Al、Si、铵盐H2、NH3CaC2、Al2S3、Mg3N2 与H2O; S2O32-与H+;
CO32-、HCO3-、 SO32- 、 HSO3-、 S2-、HS- 与Al3+;
CO32-、HCO3-与Fe3+(双水解)例1:下列各组溶液不用任何试剂,能否鉴别出来? ①FeCl3 MgCl2 NaNO3 K2SO4
②Na2CO3 BaCl2 HCl NaCl 练习1:有失去标鉴的四瓶溶液①FeCl3;②MgCl2;③NaCl;④KOH不用任何其他试剂,将其鉴别出来的顺序为 。
练习2:有失去标鉴的三瓶溶液BaCl2、K2CO3、MgSO4,只用一种试剂将它们区别出来,这种试剂可以是 。
练习3:将一包白色粉末,可能含有无水硫酸铜,碳酸钠,硝酸钾,氯化钙,碳酸钡中的一种或几种,将该白色粉末溶于水得到无色透明溶液,向溶液中加入盐酸有气体放出,试推断该白色粉末一定含有
一定没有 可能含有 1、一些特别的连续变化关系A为NH3、H2S、S、CH4、C、Na,D为O2A为P,D为Cl2A为C,D为H2OA为AlO2-,D为H+A为Al3+,D为OH-A为Cl2,D为Fe4、几种物质的特征转化关系A为AgNO3,D为NH3A为Na,D为O2A为乙醇,D为O23、注意几个典型转化关系元素及其化合物的性质是高考试题命题的重要载体,了解近年高考试题的命题特点,是提高解题能力的重要途径,现在就让我们来分析试题的特点: 特点一:与元素周期表相结合命题,推断出相应的元素后,融合化学反应原理考察学生对元素化合物知识的理解和应用能力以及书面表达能力H-C=N例1:(08北京卷)通常状况下,X、Y和Z是三种气态单质。X的组成元素是第三周期原子半径最小的元素(稀有气体元素除外);Y和Z均由元素R组成,反应Y+2I-+2H+===I2+Z+H2O常作为Y的鉴定反应。
(3)举出实例说明X的氧化性比硫单质的氧化性强(用化学方程式表示)。_________________________________________。
(4)气体(CN)2与X化学性质相似,也能与H2反应生成HCN(其水溶液是一种酸)。
①HCN分子中含有4个共价键,
其结构式是____________________。
②KCN溶液显碱性,原因是(用离子方程式表示)
_________________________________。CNˉ+H2O HCN+OHˉ H He
Li Be B C N O F Ne
Na Mg Al Si P S Cl Arc加热褪色后的溶液,若溶液恢复红色,则原通入气体为SO2;若溶液不变红,则原通入气体是O3例1:(08北京卷)通常状况下,X、Y和Z是三种气态单质。X的组成元素是第三周期原子半径最小的元素(稀有气体元素除外);Y和Z均由元素R组成,反应Y+2I-+2H+===I2+Z+H2O常作为Y的鉴定反应。
(1)Y与Z的关系是(选填字母)___________。
a、同位素 b、同系物
c、同素异形体 d、同分异构体
(2)将Y和二氧化硫分别通入品红溶液,都能使品红褪色。简述用褪色的溶液区别二者的实验方法
___________________________________________________________。
H He
Li Be B C N O F Ne
Na Mg Al Si P S Cl Ar特点二:给出元素及其化合的一些性质以及相互转化的一些信息,以推断的形式考察学生对元素及化合物知识的理解、记忆和掌握,同时还要求学生准确的进行书面表达。例2:已知A、B、C、D、E为中学化学常见物质,A、B、C、D、E中均含有同一种元素,A、C均为气体,E为液体,下图中箭头
上的反应物和反应条件均已略去
(1)当A与E反应生成B和C时,则A、E共同含有乙元素。生成的C气体易液化。常温常压下D是气体,冰水冷却D时变成无色晶体,此无色晶体的化学式是 。
根据所学的氧化还原反应知识判断:在A~E各物质中,在一定条件下能与D发生氧化还原反应的物质有 (填字母)。D溶于纯净的E时,能按物质的量比1:1化合,生成物的化学式可表示为
(写成化合物、复合物或氧化物形式均可)。试描述气体C的物理性质
________________________________。SO3 A和BH2S2O7或H2SO4·SO3或2SO3·H2OSO2是无色有刺激性气味的气体,密度比空气大,易溶于水,有毒H He
Li Be B C N O F Ne
Na Mg Al Si P S Cl Ar例2:已知A、B、C、D、E为中学化学常见物质,A、B、C、D、E中均含有同一种元素,A、C均为气体,E为液体,下图中箭头上的反应物和反应条件均已略去
(2)当A与E发生化合反应时,能观察到空气中形成大量的白烟,则A、E共同含有甲元素。通过上述描述可知:A的化学为 ,E的化学式为 。当小心加热A与E化合时的生成物F时,可得到一种无色无味的气体G(G和CO2具有相同的原子数目和电子数目)和一种无色无味的液体H,写出F分解生成的
G+H的化学方程式 。
NH3 HNO3NH4NO3 N2O↑+2H2O
H He
Li Be B C N O F Ne
Na Mg Al Si P S Cl Ar特点三:以实验的设计、评价形式考察元素和化合物知识,试题往往在课本实验基础上有一定的创新,这要求学生对课本实验及其原理有深刻的理解,能应用在新的情景中解决问题例3(04江苏)有两个实验小组的同学为探究过氧化钠与二氧化硫的反应,都用如下图所示的装置进行实验。通入SO2气体,将带余烬的木条插入试管C中,木条复燃。请回答下列问题:
(1)第1小组同学认为 Na2O2与SO2反应生成了Na2SO3和O2,该反应的化学方程式是:
(2)请设计一种实验方案证明 Na2O2与SO2反应生成的白色固体中有 Na2SO3
2Na2O2+2SO2==2Na 2SO3+O2 取白色固体,加稀硫酸,产生能使品红溶液褪色的气体。 例3(04江苏)有两个实验小组的同学为探究过氧化钠与二氧化硫的反应,都用如下图所示的装置进行实验。通入SO2气体,将带余烬的木条插入试管C中,木条复燃。请回答下列问题
(3)第2小组同学认为Na2O2与SO2
反应除了生成Na2SO3和O2外,还
有Na2SO4生成。为检验是否有
Na2SO4生成,他们设计了如下方
案:
上述方案是否合理? 。
请简要说明两点理由:① ;
② 。 不合理 稀硝酸能将亚硫酸钡氧化为硫酸钡如果反应后的固体中还残留Na2O2,它溶于水后能将亚硫酸根氧化成硫酸根 课堂反馈1A、B、C是短周期元素的三种常见非金属单质,常温下B为无色气体,A、C为固体。甲、乙、丙为中学常见的三种化合物,常温下C易溶于乙中。A、B、C与甲、乙、丙之间的转化关系如下图所示:试回答下列问题:
(1)甲的电子式:__________。
(2)写出甲与NaOH溶液反应的离子方程式__________
CO2+2OHˉ=CO32ˉ﹢H2OH He
Li Be B C N O F Ne
Na Mg Al Si P S Cl ArA、B、C是短周期元素的三种常见非金属单质,常温下B为无色气体,A、C为固体。甲、乙、丙为中学常见的三种化合物,常温下C易溶于乙中。A、B、C与甲、乙、丙之间的转化关系如下图所示:试回答下列问题:
(3)下列物质能用来鉴别甲和丙的是:__(填序号)
①溴水;②BaCl2溶液;③Ca(OH)2溶液;④酸性KMnO4溶液;⑤品红溶液;⑥石蕊试液。
(4)写出乙在气体B中燃烧的化学方程式__________
①④⑤CS2+O2 CO2+SO2课堂反馈2已知Q、R、X、Y、Z为前20号元素中的五种,Q的低价氧化物与X单质分子的电子总数相等,R与Q同族,Y和Z的离子与Ar原子的电子结构相同且Y的原子序数小于Z。
(1)Q的最高价氧化物,其固态属于 _______晶体,俗名叫_________
(2)R的氢化物分子的空间构型是______________属于________分子(填“极性”或“非极性”) ;它与X形成的化合物可作为一种重要的陶瓷材料,其化学式是______________;分子干冰正四面体非极性Si3N4 H He
Li Be B C N O F Ne
Na Mg Al Si P S Cl Ar
K Ca课堂反馈2已知Q、R、X、Y、Z为前20号元素中的五种,Q的低价氧化物与X单质分子的电子总数相等,R与Q同族,Y和Z的离子与Ar原子的电子结构相同且Y的原子序数小于Z。
(3)X的常见氢化物的空间构型是________________它的另一氢化物X2H4是一种火箭燃料的成分,其电子式是
__________________;
(4)Q分别与Y、Z形成的共价化合物的化学式是_____________ 和________Q与Y形成的分子的电子式是_____________________,属于 分子(填“极性”或“非极性”)。 CCl4 CS2三角锥非极性 某同学为研究硝酸与镁的反应,进行图示实验,实验现象及相关数据如下:(a)A中为一定浓度的硝酸与Mg片发生反应,生成的气体通过B后,在B中只生成一种盐,剩余气体遇空气不变色,其体积为原体积的一半。(b)从C进入D中的气体有两种,且体积比为1∶1。(c)将D加热一段时间后,E中干燥的红色石蕊试纸逐渐变蓝。(设实验前,装置中的空气已排尽;气体的体积均在同温同压下测定)已知反应中水蒸气的体积忽略不计,实验中的液体药品均过量。请回答:
(1)硝酸与Mg片反应生成的气体成分是______________________(用化学式表示)。
(2)硝酸在装置A的反应中所表现的性质有__________。
。 NO NO2 N2 H2 酸性 氧化性 课堂反馈3某同学为研究硝酸与镁的反应,进行图示实验,实验现象及相关数据如下:(a)A中为一定浓度的硝酸与Mg片发生反应,生成的气体通过B后,在B中只生成一种盐,剩余气体遇空气不变色,其体积为原体积的一半。(b)从C进入D中的气体有两种,且体积比为1∶1。(c)将D加热一段时间后,E中干燥的红色石蕊试纸逐渐变蓝。(设实验前,装置中的空气已排尽;气体的体积均在同温同压下测定)(3)写出D中发生反应的化学方程式________________
(4)若向反应后的A中加入足量的NaOH固体,使产生的气体全部逸出,其体积为硝酸与Mg片反应生成的气体体积的1/4(同温同压),写出符合上述实验事实的硝酸与Mg片反应的离子方程式_________________________
______________________________________________。 12Mg+30H++5NO3-=12Mg2++NH4++NO2↑+NO↑+N2↑+H2↑+12H2OFe2O3+3H2 2Fe+3H2O
N2+3H2 2NH3再见
