化学能与电能的转化-化学电源
图片预览







文档简介
课件26张PPT。1、原电池:将化学能转变为电能的装置。①活泼性不同的两个电极(较活泼的电极做负极,发生氧化反应;不活泼的电极做正极,发生还原反应)。
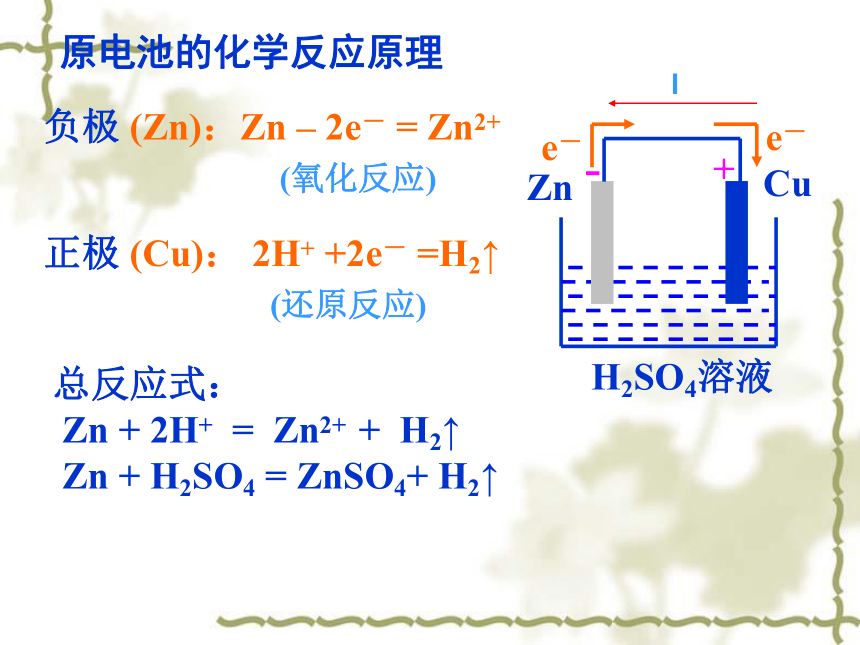
②电解质溶液(能与负极材料发生氧化还原反应) ③形成闭合回路2、形成原电池的条件(自发的氧化还原反应一般都可以形成原电池):复习回顾负极 (Zn):Zn – 2e- = Zn2+正极 (Cu): 2H+ +2e- =H2↑ (氧化反应)(还原反应)-+原电池的化学反应原理总反应式:
Zn + 2H+ = Zn2+ + H2↑
Zn + H2SO4 = ZnSO4+ H2↑ 1、某金属能跟稀盐酸作用发出氢气,该金属与锌组成原电池时,锌为负极,此金属是( )
A.Mg B.Fe C.Al D.CuB反馈练习:专题2 化学反应与能量变化第三单元 化学能与电能的转化化学电源动脑动手有下列材料:Zn片、Cu片、导线、水果 、
电流计,请设计一个装置使电流计指针发生
偏转。
碱性电池 普通锌锰电池镍氢电池 锂离子电池 镍
镉
电
池 人们依据原电池的反应原理,发明并制造了多种多样的化学电源。 空气电池锂电池一.化学电源1.一次电池(如干电池):用过后不能复原
2.二次电池(如蓄电池):充电后能继续使用
3.燃料电池
4.海水电池 常见化学电源1、普通锌锰电池(酸性干电池)
以石墨作正极,外面包有锌片做负极,电解质是糊状的NH4Cl,试写出电极反应方程式和总反应方程式。视野拓展负极(锌筒):Zn-2e-=Zn2+
正极(石墨):2MnO2+2NH4++2e-=Mn2O3+2NH3+H2O
总反应:Zn+ 2MnO2+2NH4+=Zn2++ Mn2O3+2NH3+H2O 锌锰碱性电池是一种新型的干电池。
正极材料为MnO2 ,负极材料为Zn,
还原产物为MnO(OH),电解质是KOH溶液,
总: Zn + 2MnO2 + 2H2O = Zn(OH)2 + 2MnO(OH)
相应的电极反应式如下:负极:Zn + 2OH--2e- = Zn(OH)2
正极:2MnO2 + 2H2O + 2 e- = 2MnO(OH) + 2OH-
总反应: Zn + 2MnO2 + 2H2O = Zn(OH)2 + 2MnO(OH)2.碱性Zn- Mn干电池 银锌电池—钮扣电池??该电池使用寿命较长,广泛用于电子表和电子计算机。其电极分别为Ag2O和Zn,电解质为KOH溶液。发生反应后生成Ag和ZnO,其电极反应式为: 负极:Zn+2OH--2e-?=?ZnO+H2O????????
正极:Ag2O+H2O+2e-=2Ag+2OH-3.银锌纽扣电池总反应式为:Zn+?Ag2O=?ZnO+2Ag4.铅蓄电池(1)电极材料及原料
(2)电解质溶液
(3)电极反应式:正极:PbO2 负极:PbH2SO4溶液负极(Pb): Pb- 2e-+ SO4 2 - =PbSO4Pb+PbO2+2H2SO4 =2PbSO4 +2H2O正极(PbO2): PbO2+4H++SO42 -+ 2e-= PbSO4 +2H2O总反应: 目前汽车上使用的电池,有很多都是铅蓄电池。铅蓄电池的构造是用含锑5%~8%的铅锑合金铸成格板,在格板上分别填充PbO2和Pb作为正极和负极,二者交替排列而成。在电极之间注入30%的H2SO4溶液。 5.海水电池1991年,我国首创以铝-空气-海水为能源的新型电
池,用作航海标志灯。该电池以取之不的海水为电
解质,靠空气中的氧气使铝不断氧化而产生电流。
这种海水电池的能量比“干电池”高20~50倍。电极
反应式为:
负极:
正极:
电池总反应:4Al - 12e-= 4Al 3+3O2+ 6H2O +12e-= 12 OH -4Al+3O2+ 6H2O = 4Al (OH)3↓6.燃料电池 燃料电池的特点:不是把还原剂、氧化剂物质全部贮藏在电池内,而是在工作时,不断从外界输入,同时将电极反应产物不断排出电池。 是一种高效、环境友好的发电装置。氢氧燃料电池1.氢氧燃料电池
(1)碱性介质正负两极都是铂电极或活性炭电极,有催化性能电解液一般为40%的KOH溶液2H2 + 4OH--4e- = 4H2O 正极:O2+2H2O+4e- = 4OH- 2H2 + O2 = 2H2O电池总反应式:负极:有水生成.
电解质溶液的PH将变小(2)酸性介质
正负两极仍是铂电极或活性炭电极,有催化性能
电解液为H2SO4等时,
负极:2H2 -4e- =4H+
正极:O2+4H++4e- =2H2O
总反应式: 2H2+O2 =2H2O
有水生成.电解质溶液的PH将增大1、燃料电池(氢氧燃料电池)
(1)碱性介质
负极:2H2+4OH--4e-=4H2O
正极:O2+2H2O+4e-=4OH-
总反应式:2H2+O2 =2H2O
(2)酸性介质
负极:2H2 -4e- =4H+
正极:O2+4H++4e- =2H2O
总反应式: 2H2+O2 =2H2O2其他燃料电池:
甲烷燃料电池:
该电池用金属铂片插入KOH溶液中作电极,
又在两极上分别通甲烷和氧气。
电极反应:
负极:CH4 + 10OH- - 8e-=CO32- + 7H2O
正极:2O2 + 4H2O + 8e-=8OH-
总反应:CH4 + 2O2 + 2KOH=K2CO3 + 3H2O电解液的PH将变小.1、把a、b、c、d四块金属片浸入稀硫酸中,用导线两两相连组成原电池。若a、b相连时,a为负极;c、d相连时,电流由d到c;a、c相连时,c极上产生大量气泡,b、d相连时,b上有大量气泡产生,则四种金属的活动性顺序由强到弱的为( )
A.a > b > c > d B.a > c > d > b
C.c > a > b .> d D.b > d > c > a B2、一个电池反应的离子方程式是 Zn+Cu2+=Zn2+ +Cu,
该反应的的原电池正确组合是( )C
②电解质溶液(能与负极材料发生氧化还原反应) ③形成闭合回路2、形成原电池的条件(自发的氧化还原反应一般都可以形成原电池):复习回顾负极 (Zn):Zn – 2e- = Zn2+正极 (Cu): 2H+ +2e- =H2↑ (氧化反应)(还原反应)-+原电池的化学反应原理总反应式:
Zn + 2H+ = Zn2+ + H2↑
Zn + H2SO4 = ZnSO4+ H2↑ 1、某金属能跟稀盐酸作用发出氢气,该金属与锌组成原电池时,锌为负极,此金属是( )
A.Mg B.Fe C.Al D.CuB反馈练习:专题2 化学反应与能量变化第三单元 化学能与电能的转化化学电源动脑动手有下列材料:Zn片、Cu片、导线、水果 、
电流计,请设计一个装置使电流计指针发生
偏转。
碱性电池 普通锌锰电池镍氢电池 锂离子电池 镍
镉
电
池 人们依据原电池的反应原理,发明并制造了多种多样的化学电源。 空气电池锂电池一.化学电源1.一次电池(如干电池):用过后不能复原
2.二次电池(如蓄电池):充电后能继续使用
3.燃料电池
4.海水电池 常见化学电源1、普通锌锰电池(酸性干电池)
以石墨作正极,外面包有锌片做负极,电解质是糊状的NH4Cl,试写出电极反应方程式和总反应方程式。视野拓展负极(锌筒):Zn-2e-=Zn2+
正极(石墨):2MnO2+2NH4++2e-=Mn2O3+2NH3+H2O
总反应:Zn+ 2MnO2+2NH4+=Zn2++ Mn2O3+2NH3+H2O 锌锰碱性电池是一种新型的干电池。
正极材料为MnO2 ,负极材料为Zn,
还原产物为MnO(OH),电解质是KOH溶液,
总: Zn + 2MnO2 + 2H2O = Zn(OH)2 + 2MnO(OH)
相应的电极反应式如下:负极:Zn + 2OH--2e- = Zn(OH)2
正极:2MnO2 + 2H2O + 2 e- = 2MnO(OH) + 2OH-
总反应: Zn + 2MnO2 + 2H2O = Zn(OH)2 + 2MnO(OH)2.碱性Zn- Mn干电池 银锌电池—钮扣电池??该电池使用寿命较长,广泛用于电子表和电子计算机。其电极分别为Ag2O和Zn,电解质为KOH溶液。发生反应后生成Ag和ZnO,其电极反应式为: 负极:Zn+2OH--2e-?=?ZnO+H2O????????
正极:Ag2O+H2O+2e-=2Ag+2OH-3.银锌纽扣电池总反应式为:Zn+?Ag2O=?ZnO+2Ag4.铅蓄电池(1)电极材料及原料
(2)电解质溶液
(3)电极反应式:正极:PbO2 负极:PbH2SO4溶液负极(Pb): Pb- 2e-+ SO4 2 - =PbSO4Pb+PbO2+2H2SO4 =2PbSO4 +2H2O正极(PbO2): PbO2+4H++SO42 -+ 2e-= PbSO4 +2H2O总反应: 目前汽车上使用的电池,有很多都是铅蓄电池。铅蓄电池的构造是用含锑5%~8%的铅锑合金铸成格板,在格板上分别填充PbO2和Pb作为正极和负极,二者交替排列而成。在电极之间注入30%的H2SO4溶液。 5.海水电池1991年,我国首创以铝-空气-海水为能源的新型电
池,用作航海标志灯。该电池以取之不的海水为电
解质,靠空气中的氧气使铝不断氧化而产生电流。
这种海水电池的能量比“干电池”高20~50倍。电极
反应式为:
负极:
正极:
电池总反应:4Al - 12e-= 4Al 3+3O2+ 6H2O +12e-= 12 OH -4Al+3O2+ 6H2O = 4Al (OH)3↓6.燃料电池 燃料电池的特点:不是把还原剂、氧化剂物质全部贮藏在电池内,而是在工作时,不断从外界输入,同时将电极反应产物不断排出电池。 是一种高效、环境友好的发电装置。氢氧燃料电池1.氢氧燃料电池
(1)碱性介质正负两极都是铂电极或活性炭电极,有催化性能电解液一般为40%的KOH溶液2H2 + 4OH--4e- = 4H2O 正极:O2+2H2O+4e- = 4OH- 2H2 + O2 = 2H2O电池总反应式:负极:有水生成.
电解质溶液的PH将变小(2)酸性介质
正负两极仍是铂电极或活性炭电极,有催化性能
电解液为H2SO4等时,
负极:2H2 -4e- =4H+
正极:O2+4H++4e- =2H2O
总反应式: 2H2+O2 =2H2O
有水生成.电解质溶液的PH将增大1、燃料电池(氢氧燃料电池)
(1)碱性介质
负极:2H2+4OH--4e-=4H2O
正极:O2+2H2O+4e-=4OH-
总反应式:2H2+O2 =2H2O
(2)酸性介质
负极:2H2 -4e- =4H+
正极:O2+4H++4e- =2H2O
总反应式: 2H2+O2 =2H2O2其他燃料电池:
甲烷燃料电池:
该电池用金属铂片插入KOH溶液中作电极,
又在两极上分别通甲烷和氧气。
电极反应:
负极:CH4 + 10OH- - 8e-=CO32- + 7H2O
正极:2O2 + 4H2O + 8e-=8OH-
总反应:CH4 + 2O2 + 2KOH=K2CO3 + 3H2O电解液的PH将变小.1、把a、b、c、d四块金属片浸入稀硫酸中,用导线两两相连组成原电池。若a、b相连时,a为负极;c、d相连时,电流由d到c;a、c相连时,c极上产生大量气泡,b、d相连时,b上有大量气泡产生,则四种金属的活动性顺序由强到弱的为( )
A.a > b > c > d B.a > c > d > b
C.c > a > b .> d D.b > d > c > a B2、一个电池反应的离子方程式是 Zn+Cu2+=Zn2+ +Cu,
该反应的的原电池正确组合是( )C
