化学:3.2《几种重要的金属的化合物》学案-5(新人教版必修1)
文档属性
| 名称 | 化学:3.2《几种重要的金属的化合物》学案-5(新人教版必修1) | 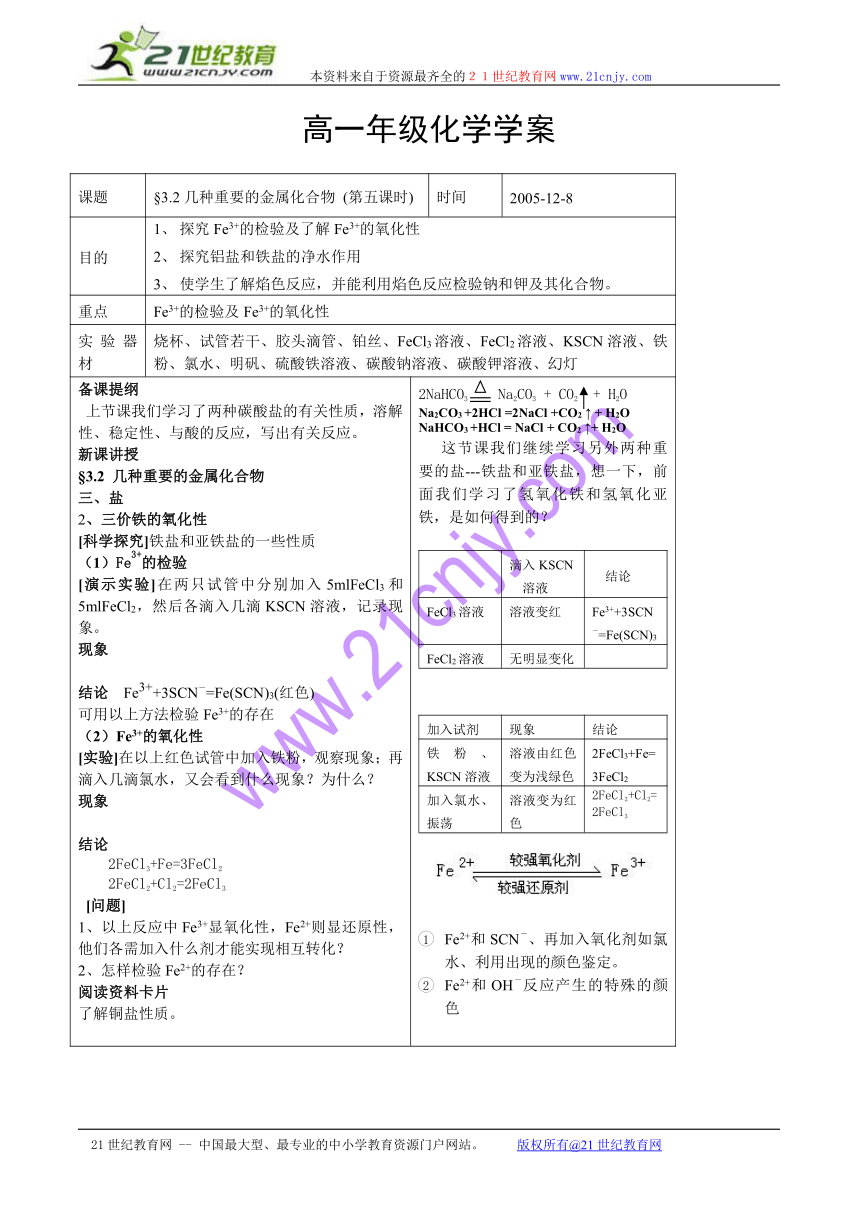 | |
| 格式 | rar | ||
| 文件大小 | 19.8KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2010-06-17 18:23:00 | ||
图片预览

文档简介
本资料来自于资源最齐全的21世纪教育网www.21cnjy.com
高一年级化学学案
课题 §3.2几种重要的金属化合物 (第五课时) 时间 2005-12-8
目的 探究Fe3+的检验及了解Fe3+的氧化性探究铝盐和铁盐的净水作用使学生了解焰色反应,并能利用焰色反应检验钠和钾及其化合物。
重点 Fe3+的检验及Fe3+的氧化性
实验器材 烧杯、试管若干、胶头滴管、铂丝、FeCl3溶液、FeCl2溶液、KSCN溶液、铁粉、氯水、明矾、硫酸铁溶液、碳酸钠溶液、碳酸钾溶液、幻灯
备课提纲上节课我们学习了两种碳酸盐的有关性质,溶解性、稳定性、与酸的反应,写出有关反应。新课讲授§3.2 几种重要的金属化合物三、盐2、三价铁的氧化性[科学探究]铁盐和亚铁盐的一些性质(1)Fe3+的检验[演示实验]在两只试管中分别加入5mlFeCl3和5mlFeCl2,然后各滴入几滴KSCN溶液,记录现象。现象 结论 Fe3++3SCN-=Fe(SCN)3(红色)可用以上方法检验Fe3+的存在(2)Fe3+的氧化性[实验]在以上红色试管中加入铁粉,观察现象;再滴入几滴氯水,又会看到什么现象?为什么?现象结论2FeCl3+Fe=3FeCl2 2FeCl2+Cl2=2FeCl3 [问题]1、以上反应中Fe3+显氧化性,Fe2+则显还原性,他们各需加入什么剂才能实现相互转化?2、怎样检验Fe2+的存在?阅读资料卡片了解铜盐性质。 2NaHCO3 Na2CO3 + CO2 + H2ONa2CO3 +2HCl =2NaCl +CO2 ↑ + H2ONaHCO3 +HCl = NaCl + CO2 ↑+ H2O 这节课我们继续学习另外两种重要的盐---铁盐和亚铁盐,想一下,前面我们学习了氢氧化铁和氢氧化亚铁,是如何得到的?滴入KSCN溶液结论FeCl3溶液溶液变红Fe3++3SCN-=Fe(SCN)3FeCl2溶液无明显变化加入试剂现象结论铁粉、KSCN溶液溶液由红色变为浅绿色2FeCl3+Fe=3FeCl2加入氯水、振荡溶液变为红色2FeCl2+Cl2=2FeCl3Fe2+和SCN-、再加入氧化剂如氯水、利用出现的颜色鉴定。Fe2+和OH-反应产生的特殊的颜色
[科学探究]铝盐和铁盐的净水作用[实验]将含有泥沙得混浊水分装在三只试管中,向其中两只试管加入少量明矾、硫酸铁溶液,静止观察。现象:结论:铝盐和铁盐都有净水作用。解释:溶于水后,分别生成了氢氧化铁与氢氧化铝胶体,具有吸附水中悬浮物或色素的功能。3、焰色反应(1) 很多金属或它们的化合物在灼烧时,使火焰呈现特殊的颜色,这在化学上叫焰色反应。(2)焰色反应的操作[思考]为什么铂丝用稀盐酸洗涤、灼烧后才能做下一个焰色反应实验?回答 氯化物绝大多数都是易溶的,用稀盐酸洗涤灼烧可使铂丝上残留的阳离子除去。[设问]①观察钾的焰色反应,为什么要透过蓝色的钴玻璃?②一种溶液,若其焰色反应呈黄色,能证明它是钠盐溶液吗 焰色反很灵敏,微量的金属都能被检验出来,一般的溶液中都有少量的钠离子,由于钾焰色反应的颜色浅,容易被钠干扰不能,能得出其中含有钠离子,也可能是氢氧化钠小结:焰色反应的操作过程:烧-蘸-洗-烧-蘸几种常见金属的焰色反应颜色:焰色反应是金属元素的性质,可以是单质或化合物,是物理变化。可以检验一些常规方法不能鉴别的金属元素。配套练习 加明矾的出现白色絮状沉淀、加硫酸铁的出现红褐色沉淀;两者静置后沉降,水层澄清。引言 平时我们炒菜时如果不小心把盐水洒在炉火上,火焰会变成黄色。酒精燃烧的火焰本身是淡蓝色的,但我们使用酒精灯时发现酒精灯的火焰实际上也是黄色的,这是为什么?操作将铂丝放在酒精灯上灼烧至与没有颜色为止蘸取碳酸钠溶液,在火焰上灼烧,观察颜色用盐酸洗净铂丝,重复上面的操作,观察钾盐溶液的颜色(透过蓝色钴玻璃)
板书设计:
教 后 感:
21世纪教育网 -- 中国最大型、最专业的中小学教育资源门户网站。 版权所有@21世纪教育网
高一年级化学学案
课题 §3.2几种重要的金属化合物 (第五课时) 时间 2005-12-8
目的 探究Fe3+的检验及了解Fe3+的氧化性探究铝盐和铁盐的净水作用使学生了解焰色反应,并能利用焰色反应检验钠和钾及其化合物。
重点 Fe3+的检验及Fe3+的氧化性
实验器材 烧杯、试管若干、胶头滴管、铂丝、FeCl3溶液、FeCl2溶液、KSCN溶液、铁粉、氯水、明矾、硫酸铁溶液、碳酸钠溶液、碳酸钾溶液、幻灯
备课提纲上节课我们学习了两种碳酸盐的有关性质,溶解性、稳定性、与酸的反应,写出有关反应。新课讲授§3.2 几种重要的金属化合物三、盐2、三价铁的氧化性[科学探究]铁盐和亚铁盐的一些性质(1)Fe3+的检验[演示实验]在两只试管中分别加入5mlFeCl3和5mlFeCl2,然后各滴入几滴KSCN溶液,记录现象。现象 结论 Fe3++3SCN-=Fe(SCN)3(红色)可用以上方法检验Fe3+的存在(2)Fe3+的氧化性[实验]在以上红色试管中加入铁粉,观察现象;再滴入几滴氯水,又会看到什么现象?为什么?现象结论2FeCl3+Fe=3FeCl2 2FeCl2+Cl2=2FeCl3 [问题]1、以上反应中Fe3+显氧化性,Fe2+则显还原性,他们各需加入什么剂才能实现相互转化?2、怎样检验Fe2+的存在?阅读资料卡片了解铜盐性质。 2NaHCO3 Na2CO3 + CO2 + H2ONa2CO3 +2HCl =2NaCl +CO2 ↑ + H2ONaHCO3 +HCl = NaCl + CO2 ↑+ H2O 这节课我们继续学习另外两种重要的盐---铁盐和亚铁盐,想一下,前面我们学习了氢氧化铁和氢氧化亚铁,是如何得到的?滴入KSCN溶液结论FeCl3溶液溶液变红Fe3++3SCN-=Fe(SCN)3FeCl2溶液无明显变化加入试剂现象结论铁粉、KSCN溶液溶液由红色变为浅绿色2FeCl3+Fe=3FeCl2加入氯水、振荡溶液变为红色2FeCl2+Cl2=2FeCl3Fe2+和SCN-、再加入氧化剂如氯水、利用出现的颜色鉴定。Fe2+和OH-反应产生的特殊的颜色
[科学探究]铝盐和铁盐的净水作用[实验]将含有泥沙得混浊水分装在三只试管中,向其中两只试管加入少量明矾、硫酸铁溶液,静止观察。现象:结论:铝盐和铁盐都有净水作用。解释:溶于水后,分别生成了氢氧化铁与氢氧化铝胶体,具有吸附水中悬浮物或色素的功能。3、焰色反应(1) 很多金属或它们的化合物在灼烧时,使火焰呈现特殊的颜色,这在化学上叫焰色反应。(2)焰色反应的操作[思考]为什么铂丝用稀盐酸洗涤、灼烧后才能做下一个焰色反应实验?回答 氯化物绝大多数都是易溶的,用稀盐酸洗涤灼烧可使铂丝上残留的阳离子除去。[设问]①观察钾的焰色反应,为什么要透过蓝色的钴玻璃?②一种溶液,若其焰色反应呈黄色,能证明它是钠盐溶液吗 焰色反很灵敏,微量的金属都能被检验出来,一般的溶液中都有少量的钠离子,由于钾焰色反应的颜色浅,容易被钠干扰不能,能得出其中含有钠离子,也可能是氢氧化钠小结:焰色反应的操作过程:烧-蘸-洗-烧-蘸几种常见金属的焰色反应颜色:焰色反应是金属元素的性质,可以是单质或化合物,是物理变化。可以检验一些常规方法不能鉴别的金属元素。配套练习 加明矾的出现白色絮状沉淀、加硫酸铁的出现红褐色沉淀;两者静置后沉降,水层澄清。引言 平时我们炒菜时如果不小心把盐水洒在炉火上,火焰会变成黄色。酒精燃烧的火焰本身是淡蓝色的,但我们使用酒精灯时发现酒精灯的火焰实际上也是黄色的,这是为什么?操作将铂丝放在酒精灯上灼烧至与没有颜色为止蘸取碳酸钠溶液,在火焰上灼烧,观察颜色用盐酸洗净铂丝,重复上面的操作,观察钾盐溶液的颜色(透过蓝色钴玻璃)
板书设计:
教 后 感:
21世纪教育网 -- 中国最大型、最专业的中小学教育资源门户网站。 版权所有@21世纪教育网
