化学:2.3《化学反应速率和限度》第三课时课件(新人教版必修2)
文档属性
| 名称 | 化学:2.3《化学反应速率和限度》第三课时课件(新人教版必修2) |

|
|
| 格式 | rar | ||
| 文件大小 | 375.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2010-06-25 00:00:00 | ||
图片预览






文档简介
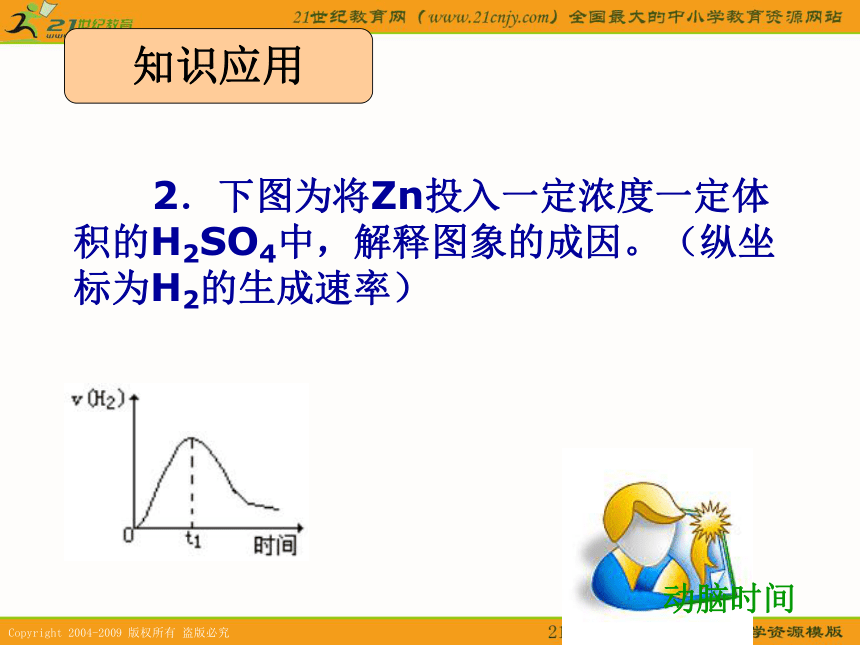
课件17张PPT。新课标人教版化学必修Ⅱ 化学反应限度第1课时1.采用哪些方法可以增加Fe与盐酸反应的化学反应速率? 动脑时间知识应用动脑时间 2.下图为将Zn投入一定浓度一定体积的H2SO4中,解释图象的成因。(纵坐标为H2的生成速率)知识应用一个化学反应在实际进行时,所有反应物能否完全(按照方程式中相应物质的量的关系)转变成生成物? 阅读P50-P51“科学史话”,总结什么是可逆反应1、可逆反应: 在同一条件下,正反应方向和逆反应方向均能进行的化学反应。分析:
1、 和
2、二次电池的充电和放电
3、注:有些化学反应在同一条件下可逆程度很小,通常意义下不把它们称为可逆反应。2、化学平衡:(1)化学平衡状态的建立①反应过程分析A:反应刚开始时
B:随着反应的进行
C:某一时刻②注意点 A:物质变化的趋势:
B:对体系中的某一具体物质,它的生成量和消耗量在平衡的这一刻是相等的
C:当外界条件发生变化时,平衡可能被破坏2、化学平衡:(2)化学平衡的研究对象可逆反应(3)化学平衡的概念 在一定条件下,可逆反应进行到一定程度时,正反应速率和逆反应速率相等,反应物和生成物浓度不再发生变化,这种状态称为化学平衡状态,简称化学平衡理解:①前提:在一定条件下的可逆反应②实质:V正=V逆③标志:混合物中各组分的浓度保持不变(4)化学平衡的特征:逆:
等:
动:
定:
变:
同:建立化学平衡的反应是可逆反应平衡时 V正=V逆化学平衡是一个动态平衡V正=V逆≠0达到平衡状态时,外界条件一定,反应速率一定,混合物中各组分的浓度一定,混合物中各组分的质量分数一定。当外界条件改变时,平衡一般要发生改变不论从正反应开始还是从逆反应开始,在相同的反应条件下,能达到相同的平衡状态。化学平衡的标志化学平衡的标志1、一定温度下,反应H2(g)+I2(g) 2HI(g)达到平衡的标志是( )
A 单位时间内生成nmolH2同时生成nmolHI。
B 单位时间内生成2nmolHI同时生成nmolI2。
C 单位时间内生成nmolH2同时生成nmolI2
D 1mol的H-H键断裂的同时,有1mol的I-I键断裂。【课堂练习】B (5) 平衡转化率(α): 用平衡时已转化了的某反应物的量与反应前(初始时)该反应物的量之比来表示反应在该条件下的最大限度。 产品(C或D)的产率:2、在一定温度下,
2NO2(g) N2O4 (g) (无色)的可逆反应中,下列情况属于平衡状态的是( )
A.N2O4不再分解 B.v(N2O4):v(NO2)=1:2
C.体系的颜色不再改变
D.NO2的浓度与N2O4的浓度之比2:1 C【课堂练习】3、可逆反应达到平衡的重要特征是:
A反应停止了
B正、逆反应的速率都为零
C正、逆反应都还在继续进行
D正、逆反应速率相等【课堂练习】D4、一定条件下,可逆反应达到平衡时:
A单位时间内反应物减少的分子数等于生成物增加的分子数
B反应物浓度等于生成物浓度
C反应物与生成物浓度保持不变
D 混和体系中各组成成份和含量保持不变【课堂练习】CD5、在一定温度下的定容容器中,当下列的物理量不再发生变化时,表明反应
A(s)+2B(g) C(g)+D(g)已达到平衡状态的是:( )
A 混合气体的压强 B 混合气体的密度
C 气体的总物质的量 D A的物质的量浓度【课堂练习】B6、对反应A(g)+B(g) C(g)+D(g)的以下叙述中,能说明恒温下已达平衡状态的
A反应容器中,压强不随时间改变而改变
B反应容器中,A、B、C、D 能共存
C 反应容器中,A、B、C、D质量不再改变
D反应容器中的各物质物质的量不随时间变化
7、在一定温度下,反应 I2(g)+H2(g) 2HI(g),达到平衡的标志是:
A VHI=2VH2
B H2的百分含量不再变化
C容器内的压强不再变化
D[I2]=[H2]=[HI]CDB作业:基训到P33
教材课后习题
1、 和
2、二次电池的充电和放电
3、注:有些化学反应在同一条件下可逆程度很小,通常意义下不把它们称为可逆反应。2、化学平衡:(1)化学平衡状态的建立①反应过程分析A:反应刚开始时
B:随着反应的进行
C:某一时刻②注意点 A:物质变化的趋势:
B:对体系中的某一具体物质,它的生成量和消耗量在平衡的这一刻是相等的
C:当外界条件发生变化时,平衡可能被破坏2、化学平衡:(2)化学平衡的研究对象可逆反应(3)化学平衡的概念 在一定条件下,可逆反应进行到一定程度时,正反应速率和逆反应速率相等,反应物和生成物浓度不再发生变化,这种状态称为化学平衡状态,简称化学平衡理解:①前提:在一定条件下的可逆反应②实质:V正=V逆③标志:混合物中各组分的浓度保持不变(4)化学平衡的特征:逆:
等:
动:
定:
变:
同:建立化学平衡的反应是可逆反应平衡时 V正=V逆化学平衡是一个动态平衡V正=V逆≠0达到平衡状态时,外界条件一定,反应速率一定,混合物中各组分的浓度一定,混合物中各组分的质量分数一定。当外界条件改变时,平衡一般要发生改变不论从正反应开始还是从逆反应开始,在相同的反应条件下,能达到相同的平衡状态。化学平衡的标志化学平衡的标志1、一定温度下,反应H2(g)+I2(g) 2HI(g)达到平衡的标志是( )
A 单位时间内生成nmolH2同时生成nmolHI。
B 单位时间内生成2nmolHI同时生成nmolI2。
C 单位时间内生成nmolH2同时生成nmolI2
D 1mol的H-H键断裂的同时,有1mol的I-I键断裂。【课堂练习】B (5) 平衡转化率(α): 用平衡时已转化了的某反应物的量与反应前(初始时)该反应物的量之比来表示反应在该条件下的最大限度。 产品(C或D)的产率:2、在一定温度下,
2NO2(g) N2O4 (g) (无色)的可逆反应中,下列情况属于平衡状态的是( )
A.N2O4不再分解 B.v(N2O4):v(NO2)=1:2
C.体系的颜色不再改变
D.NO2的浓度与N2O4的浓度之比2:1 C【课堂练习】3、可逆反应达到平衡的重要特征是:
A反应停止了
B正、逆反应的速率都为零
C正、逆反应都还在继续进行
D正、逆反应速率相等【课堂练习】D4、一定条件下,可逆反应达到平衡时:
A单位时间内反应物减少的分子数等于生成物增加的分子数
B反应物浓度等于生成物浓度
C反应物与生成物浓度保持不变
D 混和体系中各组成成份和含量保持不变【课堂练习】CD5、在一定温度下的定容容器中,当下列的物理量不再发生变化时,表明反应
A(s)+2B(g) C(g)+D(g)已达到平衡状态的是:( )
A 混合气体的压强 B 混合气体的密度
C 气体的总物质的量 D A的物质的量浓度【课堂练习】B6、对反应A(g)+B(g) C(g)+D(g)的以下叙述中,能说明恒温下已达平衡状态的
A反应容器中,压强不随时间改变而改变
B反应容器中,A、B、C、D 能共存
C 反应容器中,A、B、C、D质量不再改变
D反应容器中的各物质物质的量不随时间变化
7、在一定温度下,反应 I2(g)+H2(g) 2HI(g),达到平衡的标志是:
A VHI=2VH2
B H2的百分含量不再变化
C容器内的压强不再变化
D[I2]=[H2]=[HI]CDB作业:基训到P33
教材课后习题
