第二单元溶液酸碱性第3课时
图片预览











文档简介
课件36张PPT。酸碱中和滴定(第二单元 溶液的酸碱性第三节)南靖一中沈建忠理解酸碱中和滴定的原理。
掌握酸碱中和滴定的操作方法。
掌握有关酸碱中和滴定的简单计算。
激发创新意识、培养分析问题、解决问题的能力。教学目标一、酸碱中和滴定原理。1、 定义:用已知物质的量浓度的酸或碱(标准溶液)来测定未知物质的量浓度的碱或酸(待测溶液或未知溶液)的方法叫做酸碱中和滴定。
2、 原理:以酸碱中和反应为基础,
H+ + OH- = H2O
在滴定达到终点(即酸碱恰好反应)时:
有 n(H+) = n(OH-) 量取一定体积的待测液,用已知浓度的标准液来滴定,并记录所消耗标准液的体积,就可以计算出待测液的浓度.练习: 用0.1230mol/L的NaOH溶液滴定25.00mL未知浓度的盐酸酸溶液,滴定完成时用去NaOH溶液26.50mL。计算待测盐酸溶液的物质的量浓度。解:这是一元酸和一元碱的中和滴定,据:= 0.1160mol/L答:测得HCl的物质的量浓度为0.1160mol/L。3、酸碱中和滴定的关键(1)准确测定参加反应的两种溶液的体积
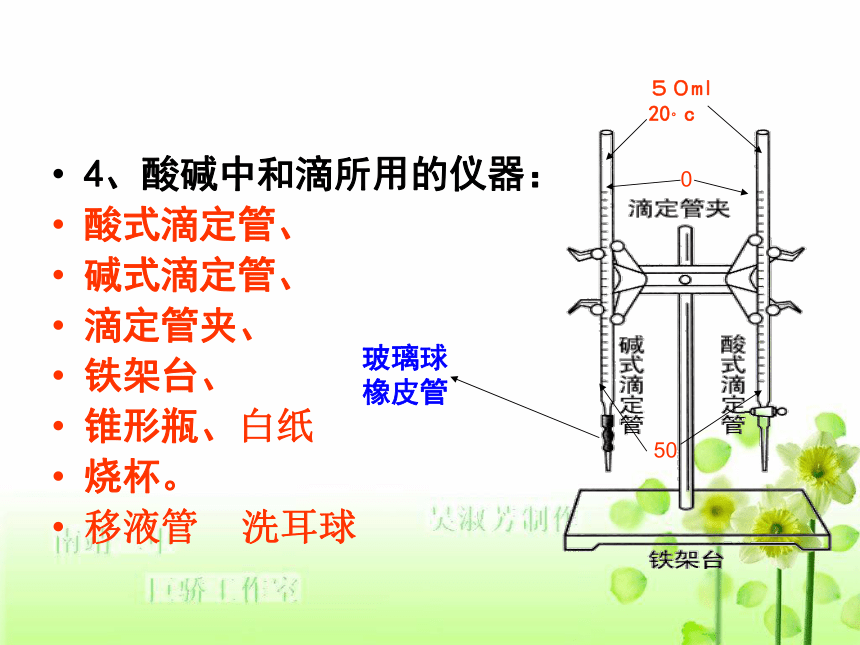
(2)准确判断中和反应是否恰好完全进行4、酸碱中和滴所用的仪器:
酸式滴定管、
碱式滴定管、
滴定管夹、
铁架台、
锥形瓶、白纸
烧杯。
移液管 洗耳球 50ml
20。c050玻璃球
橡皮管(1)、滴定管的构造特点
a、滴定管分酸式滴定管、碱式滴定管
酸式滴定管--玻璃活塞--量取或滴定酸溶液或氧化性试剂。
b、刻度上边的小(有0刻度),下边的大。
c、精确度是百分之一。即可精确到0.01ml
d、下部尖嘴内液体不在刻度内,量取或
滴定溶液时不能将尖嘴内的液体放出。 (2)、使用时的注意事项及方法
a、使用时先检查是否漏液。
b、用滴定管取滴液体时必须洗涤、润洗。
c、读数前要将管内的气泡赶尽、尖嘴内充满液体。
d、读数需有两次,第一次读数时必须先调整液面
在0刻度或0刻度以下。
e、读数时,视线、刻度、液面的凹面最低点在同一水平线上。
f、读数时,边观察实验变化,边控制用量。
g、量取或滴定液体的体积==第二次的读数-第一次读数。 5、滴定前准备工作 a.滴定管:
洗涤---检漏---润洗---注液---赶气泡---调液思考1:中学化学中,哪些仪器在使用前需要检漏?
思考2:滴定管为什么要润洗?
润洗:用标准液或待测液分别润洗酸式滴定管和碱式滴 定管。
调液:调节液面至零或零刻度线以下。如果尖嘴部分有气泡,要排出气泡。
读数:视线和凹液面最低点相切。(1)滴定前准备工作 b.锥形瓶:
洗涤(但不能用所放溶液润洗,为什么?) 注入(用滴定管或移液管)一定体积的溶液(待测液或标准液)到锥形瓶中,并滴加2-3滴指示剂。 6、酸碱中和和滴定指示剂的选择 1。强酸与弱碱相互滴定时,应选用甲基橙。
2。强碱与弱酸相互滴定时,应选用酚酞。
3。强酸与强碱相互滴定时,既可选用甲基橙,也
可选用 酚酞作指示剂。
注意:中和滴定不能用石蕊作指示剂。原因是石蕊的变色 范围(pH5.0~8.0)太宽,到达滴定终点时颜色变化不明显,不易观察。
7、滴定★用滴定管或移液管量取一定体积的待测液放入锥形瓶中★向锥形瓶中加入两到三滴指示剂★左手_________________ ,
右手___________,眼睛注视
__________________________。摇动锥形瓶锥形瓶中溶液颜色的变化和液体的流速控制滴定管活塞终点的判断 溶液颜色发生变化且在半分钟内不再变色。
测定求各体积的平均值 强酸滴定强碱强碱滴定强酸★ 重复做一次,取两次标准液的平均值计算8、数据处理阶段1、取标准盐酸溶液:
用标准液润洗酸式滴定管1~2次;
注入标准液至“0”刻度线以上;
固定在滴定管夹上;
迅速转动活塞将尖嘴气泡排除并调整液面在“0”刻度以下。
记下准确读数。
2、取待测NaOH溶液:
用待测液润洗碱式滴定管1~2次;
注入待测液至“0”刻度线以下;
固定在滴定夹上;
迅速挤压玻璃球,将尖嘴气泡排出;
调整液面在“0”或“0”刻度线以下,准确记下读数。
往洁净的锥形瓶内准确放入25.00毫升的碱液。小结——操作步骤:3、在锥形瓶NaOH溶液中滴入两滴酚酞试液。
4、用标准盐酸溶液滴定:
左手控制酸式滴定管旋塞,右手拿住锥形瓶颈,
边滴入盐酸边不断摇动; 眼睛要始终注视锥形瓶
中溶液的颜色变化。
5、当看到加一滴盐酸时,锥形瓶中溶液红颜色突变
无色时,停止滴定。 待30s不变色,准确记下盐酸读数,并准确求得滴定用去的盐酸体积。
6、滴定操作重复2~3次。
7、将几次滴定用去盐酸体积的平均值代入关系式计算:
总结
酸碱中和滴定的操作步骤和注意事项可用一段口诀来概括:
酸管碱管莫混用,视线刻度要齐平。
尖嘴充液无气泡,液面不要高于零。
莫忘添加指示剂,开始读数要记清。
左手轻轻旋开关,右手摇动锥形瓶。
眼睛紧盯待测液,颜色一变立即停。
数据记录要及时,重复滴定求平均。
误差判断看V(标),规范操作靠多练。 ①洗涤仪器(滴定管、移液管、锥形瓶);
②气泡;
③体积读数(仰视、俯视);
④指示剂选择不当;
⑤杂质的影响;
⑥操作(如用力过猛引起待测液外溅等)。 1、中和滴定过程中,容易产生误差的6个方面是:二、误 差 分 析(以已知浓度的盐酸滴定未知浓度的氢氧化钠为例)3、以标准溶液滴定待测溶液,误差分析看V(标)视数V(标)大,则C(待)
V(标)小,则 C(待)
V(标)不变,则 C(待)偏大偏小无影响2、分析依据:
C(NaOH)==C(HCl).V(HCl)/V(NaOH)4、液体体积测量误差对测量浓度的影响:1、观察滴定管俯视液面看高,读数偏小,测量值<实际值。2、观察滴定管仰视液面看低,读数偏大,测量值>实际值。“仰大俯小”?A俯视小仰视大误差俯视或仰视刻度线对溶液浓度的影响 俯视刻度线,实际加水量未到刻度线,使溶液的物质的量浓度增大;
仰视刻度线,实际加水量超过刻度线,使溶液的物质的量浓度减小。 5、分析结果
(1)、仪器洗涤:
A、酸式滴定管水洗后未用标准液润洗,则C(碱):偏大;
B、移液管水洗后未用待测液润洗,则C(碱):偏小;
C、锥形瓶水洗后用待测液润洗,则C(碱):偏大(2)、量器读数:
A、滴定前俯视酸式滴定管,滴定后平视则C(碱):偏大;
B、滴定前仰视酸式滴定管,滴定后俯视则C(碱):偏小;
(3)、操作不当:
A、滴定前酸式滴定管尖嘴部分有气泡,滴定
结束后气泡消失,则C(碱):偏大;
B、滴定结束,滴定管尖嘴端挂一滴液体未滴
下,则C(碱):偏大;
C、将移液管尖嘴部分的液体吹出,则C(碱):偏大;
D、滴定过程中,摇动锥形瓶时,不小心将溶
液溅出,则C(碱):偏小;
E、用甲基橙作指示剂,当溶液变为橙色时,
半分钟内又还原成黄色,不处理就计算,则
C(碱):偏小. 酸滴定碱时,下列操作会引起碱液浓度如何变化?
(1)酸式滴定管用蒸馏水洗涤后注入标准液盐酸
(2)锥形瓶被蒸馏水洗涤后注入待测液氢氧化钠
(3)锥形瓶在注入碱液前用待测液润洗
(4)滴定过程 中用少量蒸馏水洗涤锥形瓶内壁
(5)滴定过程 中锥形瓶振荡激烈有少量液体溅出
(6)滴定前读数准确,滴定终了俯视读数
(7)滴定前滴定管尖嘴有气泡,滴淀终了气泡消失偏高无影响 偏高无影响偏低偏低偏高(8)滴定完毕滴定管尖嘴外悬挂一滴酸液
(9)用移液管量取液体时,最后一滴吹下
(10 滴定前滴定管中液体在“0”刻度以上偏高偏高偏低习题减小实验误差的三点做法1、半分钟:振荡锥形瓶半分钟颜色不褪去,即为滴定终点。
2、1-2分钟:滴定停止后,必须等待1-2分钟,让附着在滴定管内壁的溶液流下后再读数。
3、重做实验,两次滴定的标准液体积不超过0.02mL,再取平均值。滴定终点,结束时,溶液的pH
是否一定为7? 讨论1.等当点
当滴加的标准溶液和被测物质恰好反应时,这一时刻称为等当点。在酸碱中和滴定中,到达等当点时溶液不一定都是中性的,有时呈酸性、有时呈碱性,这要看中和后生成盐的性质。 2.滴定终点
酸碱中和滴定是否达到等当点,在实际操作中通常是用酸碱指示剂的颜色变化来表示滴定的终点。酸碱指示剂颜色变化半分钟不褪色的时刻,即为滴定终点。等当点和滴定终点一般很难吻合, 1、检查。
2、洗涤、润洗(2~3次)。
3、加液、调节起始刻度。
4、加入指示剂。(并在瓶底衬一张白纸)
5、滴定。
6、判断终点。
7、读数。
8、记录数据。(两次体积差为所消耗体积)
9、计算滴定结果。
总结:酸碱中和滴定的操作步骤滴定前的准备[随堂练习] 1、用0.01 mol·L-1H2SO4滴定0.01 mol·L-1NaOH溶液,中和后加水至100 mL。若滴定时终点判断有误差:①多加了一滴H2SO4;②少加了一滴H2SO4(设一滴为0.05mL)。则① 和②中[H+]之比的值是( )。
(A)10 (B)50
(C)5×103 (D)104[随堂练习] ①多加了一滴H2SO4 :解释②少加了一滴H2SO4: 2、 用标准盐酸滴定待测烧碱,下列错误操作将对V(酸)和C(碱)有何影响?(偏大、偏小和无影响)
A、盛标准酸的滴定管尖嘴部分有气泡未排除就开始滴定 , 。
B、振荡时液体飞溅出来 , 。
C、开始读标准酸时用仰视 , 。
D、终点读标准酸时用俯视 , 。
E、滴定前盛放氢氧化钠溶液的锥形瓶用蒸馏水洗净后没有干燥 , 。 偏大偏大偏小偏小偏小偏小偏小偏小无影响无影响具体分析如下:
(1)滴定前,在用蒸馏水洗涤滴定管后,未用标准液润洗。( )
(2)滴定前,滴定管尖端有气泡,滴定后气泡消失。( )
(3)滴定前,用待测液润洗锥形瓶。( )
(4)取待测液时,滴定管用蒸馏水洗涤后,未用待测液润洗。( )
(5)读取标准液的刻度时,滴定前平视,滴定后俯视。
( )
(6)若用甲基橙作指示剂,最后一滴盐酸滴入使溶液由橙色变为红色。( )
偏高偏高偏低偏低偏高偏高(7)滴定过程中,锥形瓶振荡太剧烈,有少量溶液溅出。
( )
(8)滴定后,滴定管尖端挂有液滴未滴入锥形瓶中( )
(9)滴定前仰视读数,滴定后平视刻度读数。( )
(10)滴定过程中向锥形瓶内加入少量蒸馏水。( )
(11)滴定过程中,滴定管漏液。( )
(12)滴定临近终点时,用洗瓶中的蒸馏水洗下滴定管尖嘴口的半滴标准溶液至锥形瓶中。( )
(13)过早估计滴定终点。( )
(14)过晚估计滴定终点。( )
(15)一滴标准溶液附在锥形瓶壁上未洗下。( ) 偏低偏高偏低无影响偏高操作正确,无影响偏低偏高偏高
掌握酸碱中和滴定的操作方法。
掌握有关酸碱中和滴定的简单计算。
激发创新意识、培养分析问题、解决问题的能力。教学目标一、酸碱中和滴定原理。1、 定义:用已知物质的量浓度的酸或碱(标准溶液)来测定未知物质的量浓度的碱或酸(待测溶液或未知溶液)的方法叫做酸碱中和滴定。
2、 原理:以酸碱中和反应为基础,
H+ + OH- = H2O
在滴定达到终点(即酸碱恰好反应)时:
有 n(H+) = n(OH-) 量取一定体积的待测液,用已知浓度的标准液来滴定,并记录所消耗标准液的体积,就可以计算出待测液的浓度.练习: 用0.1230mol/L的NaOH溶液滴定25.00mL未知浓度的盐酸酸溶液,滴定完成时用去NaOH溶液26.50mL。计算待测盐酸溶液的物质的量浓度。解:这是一元酸和一元碱的中和滴定,据:= 0.1160mol/L答:测得HCl的物质的量浓度为0.1160mol/L。3、酸碱中和滴定的关键(1)准确测定参加反应的两种溶液的体积
(2)准确判断中和反应是否恰好完全进行4、酸碱中和滴所用的仪器:
酸式滴定管、
碱式滴定管、
滴定管夹、
铁架台、
锥形瓶、白纸
烧杯。
移液管 洗耳球 50ml
20。c050玻璃球
橡皮管(1)、滴定管的构造特点
a、滴定管分酸式滴定管、碱式滴定管
酸式滴定管--玻璃活塞--量取或滴定酸溶液或氧化性试剂。
b、刻度上边的小(有0刻度),下边的大。
c、精确度是百分之一。即可精确到0.01ml
d、下部尖嘴内液体不在刻度内,量取或
滴定溶液时不能将尖嘴内的液体放出。 (2)、使用时的注意事项及方法
a、使用时先检查是否漏液。
b、用滴定管取滴液体时必须洗涤、润洗。
c、读数前要将管内的气泡赶尽、尖嘴内充满液体。
d、读数需有两次,第一次读数时必须先调整液面
在0刻度或0刻度以下。
e、读数时,视线、刻度、液面的凹面最低点在同一水平线上。
f、读数时,边观察实验变化,边控制用量。
g、量取或滴定液体的体积==第二次的读数-第一次读数。 5、滴定前准备工作 a.滴定管:
洗涤---检漏---润洗---注液---赶气泡---调液思考1:中学化学中,哪些仪器在使用前需要检漏?
思考2:滴定管为什么要润洗?
润洗:用标准液或待测液分别润洗酸式滴定管和碱式滴 定管。
调液:调节液面至零或零刻度线以下。如果尖嘴部分有气泡,要排出气泡。
读数:视线和凹液面最低点相切。(1)滴定前准备工作 b.锥形瓶:
洗涤(但不能用所放溶液润洗,为什么?) 注入(用滴定管或移液管)一定体积的溶液(待测液或标准液)到锥形瓶中,并滴加2-3滴指示剂。 6、酸碱中和和滴定指示剂的选择 1。强酸与弱碱相互滴定时,应选用甲基橙。
2。强碱与弱酸相互滴定时,应选用酚酞。
3。强酸与强碱相互滴定时,既可选用甲基橙,也
可选用 酚酞作指示剂。
注意:中和滴定不能用石蕊作指示剂。原因是石蕊的变色 范围(pH5.0~8.0)太宽,到达滴定终点时颜色变化不明显,不易观察。
7、滴定★用滴定管或移液管量取一定体积的待测液放入锥形瓶中★向锥形瓶中加入两到三滴指示剂★左手_________________ ,
右手___________,眼睛注视
__________________________。摇动锥形瓶锥形瓶中溶液颜色的变化和液体的流速控制滴定管活塞终点的判断 溶液颜色发生变化且在半分钟内不再变色。
测定求各体积的平均值 强酸滴定强碱强碱滴定强酸★ 重复做一次,取两次标准液的平均值计算8、数据处理阶段1、取标准盐酸溶液:
用标准液润洗酸式滴定管1~2次;
注入标准液至“0”刻度线以上;
固定在滴定管夹上;
迅速转动活塞将尖嘴气泡排除并调整液面在“0”刻度以下。
记下准确读数。
2、取待测NaOH溶液:
用待测液润洗碱式滴定管1~2次;
注入待测液至“0”刻度线以下;
固定在滴定夹上;
迅速挤压玻璃球,将尖嘴气泡排出;
调整液面在“0”或“0”刻度线以下,准确记下读数。
往洁净的锥形瓶内准确放入25.00毫升的碱液。小结——操作步骤:3、在锥形瓶NaOH溶液中滴入两滴酚酞试液。
4、用标准盐酸溶液滴定:
左手控制酸式滴定管旋塞,右手拿住锥形瓶颈,
边滴入盐酸边不断摇动; 眼睛要始终注视锥形瓶
中溶液的颜色变化。
5、当看到加一滴盐酸时,锥形瓶中溶液红颜色突变
无色时,停止滴定。 待30s不变色,准确记下盐酸读数,并准确求得滴定用去的盐酸体积。
6、滴定操作重复2~3次。
7、将几次滴定用去盐酸体积的平均值代入关系式计算:
总结
酸碱中和滴定的操作步骤和注意事项可用一段口诀来概括:
酸管碱管莫混用,视线刻度要齐平。
尖嘴充液无气泡,液面不要高于零。
莫忘添加指示剂,开始读数要记清。
左手轻轻旋开关,右手摇动锥形瓶。
眼睛紧盯待测液,颜色一变立即停。
数据记录要及时,重复滴定求平均。
误差判断看V(标),规范操作靠多练。 ①洗涤仪器(滴定管、移液管、锥形瓶);
②气泡;
③体积读数(仰视、俯视);
④指示剂选择不当;
⑤杂质的影响;
⑥操作(如用力过猛引起待测液外溅等)。 1、中和滴定过程中,容易产生误差的6个方面是:二、误 差 分 析(以已知浓度的盐酸滴定未知浓度的氢氧化钠为例)3、以标准溶液滴定待测溶液,误差分析看V(标)视数V(标)大,则C(待)
V(标)小,则 C(待)
V(标)不变,则 C(待)偏大偏小无影响2、分析依据:
C(NaOH)==C(HCl).V(HCl)/V(NaOH)4、液体体积测量误差对测量浓度的影响:1、观察滴定管俯视液面看高,读数偏小,测量值<实际值。2、观察滴定管仰视液面看低,读数偏大,测量值>实际值。“仰大俯小”?A俯视小仰视大误差俯视或仰视刻度线对溶液浓度的影响 俯视刻度线,实际加水量未到刻度线,使溶液的物质的量浓度增大;
仰视刻度线,实际加水量超过刻度线,使溶液的物质的量浓度减小。 5、分析结果
(1)、仪器洗涤:
A、酸式滴定管水洗后未用标准液润洗,则C(碱):偏大;
B、移液管水洗后未用待测液润洗,则C(碱):偏小;
C、锥形瓶水洗后用待测液润洗,则C(碱):偏大(2)、量器读数:
A、滴定前俯视酸式滴定管,滴定后平视则C(碱):偏大;
B、滴定前仰视酸式滴定管,滴定后俯视则C(碱):偏小;
(3)、操作不当:
A、滴定前酸式滴定管尖嘴部分有气泡,滴定
结束后气泡消失,则C(碱):偏大;
B、滴定结束,滴定管尖嘴端挂一滴液体未滴
下,则C(碱):偏大;
C、将移液管尖嘴部分的液体吹出,则C(碱):偏大;
D、滴定过程中,摇动锥形瓶时,不小心将溶
液溅出,则C(碱):偏小;
E、用甲基橙作指示剂,当溶液变为橙色时,
半分钟内又还原成黄色,不处理就计算,则
C(碱):偏小. 酸滴定碱时,下列操作会引起碱液浓度如何变化?
(1)酸式滴定管用蒸馏水洗涤后注入标准液盐酸
(2)锥形瓶被蒸馏水洗涤后注入待测液氢氧化钠
(3)锥形瓶在注入碱液前用待测液润洗
(4)滴定过程 中用少量蒸馏水洗涤锥形瓶内壁
(5)滴定过程 中锥形瓶振荡激烈有少量液体溅出
(6)滴定前读数准确,滴定终了俯视读数
(7)滴定前滴定管尖嘴有气泡,滴淀终了气泡消失偏高无影响 偏高无影响偏低偏低偏高(8)滴定完毕滴定管尖嘴外悬挂一滴酸液
(9)用移液管量取液体时,最后一滴吹下
(10 滴定前滴定管中液体在“0”刻度以上偏高偏高偏低习题减小实验误差的三点做法1、半分钟:振荡锥形瓶半分钟颜色不褪去,即为滴定终点。
2、1-2分钟:滴定停止后,必须等待1-2分钟,让附着在滴定管内壁的溶液流下后再读数。
3、重做实验,两次滴定的标准液体积不超过0.02mL,再取平均值。滴定终点,结束时,溶液的pH
是否一定为7? 讨论1.等当点
当滴加的标准溶液和被测物质恰好反应时,这一时刻称为等当点。在酸碱中和滴定中,到达等当点时溶液不一定都是中性的,有时呈酸性、有时呈碱性,这要看中和后生成盐的性质。 2.滴定终点
酸碱中和滴定是否达到等当点,在实际操作中通常是用酸碱指示剂的颜色变化来表示滴定的终点。酸碱指示剂颜色变化半分钟不褪色的时刻,即为滴定终点。等当点和滴定终点一般很难吻合, 1、检查。
2、洗涤、润洗(2~3次)。
3、加液、调节起始刻度。
4、加入指示剂。(并在瓶底衬一张白纸)
5、滴定。
6、判断终点。
7、读数。
8、记录数据。(两次体积差为所消耗体积)
9、计算滴定结果。
总结:酸碱中和滴定的操作步骤滴定前的准备[随堂练习] 1、用0.01 mol·L-1H2SO4滴定0.01 mol·L-1NaOH溶液,中和后加水至100 mL。若滴定时终点判断有误差:①多加了一滴H2SO4;②少加了一滴H2SO4(设一滴为0.05mL)。则① 和②中[H+]之比的值是( )。
(A)10 (B)50
(C)5×103 (D)104[随堂练习] ①多加了一滴H2SO4 :解释②少加了一滴H2SO4: 2、 用标准盐酸滴定待测烧碱,下列错误操作将对V(酸)和C(碱)有何影响?(偏大、偏小和无影响)
A、盛标准酸的滴定管尖嘴部分有气泡未排除就开始滴定 , 。
B、振荡时液体飞溅出来 , 。
C、开始读标准酸时用仰视 , 。
D、终点读标准酸时用俯视 , 。
E、滴定前盛放氢氧化钠溶液的锥形瓶用蒸馏水洗净后没有干燥 , 。 偏大偏大偏小偏小偏小偏小偏小偏小无影响无影响具体分析如下:
(1)滴定前,在用蒸馏水洗涤滴定管后,未用标准液润洗。( )
(2)滴定前,滴定管尖端有气泡,滴定后气泡消失。( )
(3)滴定前,用待测液润洗锥形瓶。( )
(4)取待测液时,滴定管用蒸馏水洗涤后,未用待测液润洗。( )
(5)读取标准液的刻度时,滴定前平视,滴定后俯视。
( )
(6)若用甲基橙作指示剂,最后一滴盐酸滴入使溶液由橙色变为红色。( )
偏高偏高偏低偏低偏高偏高(7)滴定过程中,锥形瓶振荡太剧烈,有少量溶液溅出。
( )
(8)滴定后,滴定管尖端挂有液滴未滴入锥形瓶中( )
(9)滴定前仰视读数,滴定后平视刻度读数。( )
(10)滴定过程中向锥形瓶内加入少量蒸馏水。( )
(11)滴定过程中,滴定管漏液。( )
(12)滴定临近终点时,用洗瓶中的蒸馏水洗下滴定管尖嘴口的半滴标准溶液至锥形瓶中。( )
(13)过早估计滴定终点。( )
(14)过晚估计滴定终点。( )
(15)一滴标准溶液附在锥形瓶壁上未洗下。( ) 偏低偏高偏低无影响偏高操作正确,无影响偏低偏高偏高
