专题3第二单元溶液的酸碱性第1、2课时
文档属性
| 名称 | 专题3第二单元溶液的酸碱性第1、2课时 |

|
|
| 格式 | rar | ||
| 文件大小 | 100.2KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2010-07-10 00:00:00 | ||
图片预览








文档简介
课件24张PPT。第二单元 溶液的酸碱性(第一课时:溶液的酸碱性)南靖一中 沈建忠你知道吗人体某些体液的pH范围人体体液的pH必须维持
在一定范围内人才能健康一、溶液的酸碱性
(一)、溶液的酸碱性
H+、OH-是溶液酸碱性的表征微粒,溶液呈
酸性、中性还是碱性,取决于C(H+)、C(OH-)
的相对大小。已知在25℃时,水的离子积Kw=1.0×10-14,请分别计算浓度均为0.01mol﹒L-1的盐酸、氯化钠溶液、氢氧化钠溶液中氢离子及氢氧根离子的浓度。
请根据计算结果讨论溶液的酸碱性与氢离子及氢氧根离子浓度的关系。看书P71图3-9溶液的酸碱性C(H+)与C(OH-)关系中性C(H+)=C(OH-)酸性C(H+)>C(OH-)碱性C(H+)1×10-7C(H+)<1×10-7某水溶液中C(H+)>1×10-7mol/L,则该溶液一定呈酸性,此说法是否正确,为什么?呈酸性本质C(H+)>C(OH-)(二)溶液的pH值
1. pH的定义:溶液的pH为氢离子浓度的负对数,可用来表示溶液的酸碱性。
2. pH = - lg c(H+)如C(H+)=1×10-7mol/L的溶液pH=7通常,当溶液中氢离子浓度很小时,为了更方便表示酸碱性,通常用pH来表示。注意, 但当溶液中c(H+)>1mol/L时,直接用浓度表示。pOH值也有,但不常用。
pOH = - lg c(OH-)看书P72图3-10:PH的适用范围:0--14溶液的pH值酸性增强碱性增强强酸性
弱酸性
中性
弱碱性
强碱性25℃注意1、PH值越小,酸性越强,PH越大,碱性越强。
2、PH范围0---14之间。
3、PH值等于0的溶液不是酸性最强的溶液,
PH值等于14的溶液不是碱性最强的溶液
4、PH值增加一个单位C(H+) 减小10倍故判断溶液的酸碱性还可用PH值:(25℃)
酸性: pH < 7
中性: pH = 7
碱性: pH > 7若100℃时,水的离子积为10-12,求算此时水的pH.
PH=7的溶液不一定是中性溶液;
PH<7的溶液不一定是酸性溶液。
溶液温度不同,水电离出的C(H+)也不同,溶液的PH也会相应改变。3、pH值测定方法(1)定性测量范围: 酸碱指示剂。酸碱指示剂:一般是弱的有机酸或弱的有机碱,他们的颜色变化是在一定的pH值范围内发生的。我们把指示剂发生颜色变化的pH值范围叫做指示剂的变色范围。酸碱指示剂——甲基橙、石蕊、酚酞
常用酸碱指示剂及其变色范围:甲基橙石蕊酚酞583.14.4810红色紫色蓝色红色橙色黄色无色浅红红色(3)定量精确测量: pH计(小数位)。
可精确到:0.01(2)定量粗略测量: pH试纸(整数位)。 pH试纸的使用:
用洁净的玻璃棒蘸取待测溶液滴在PH试纸上将试纸与标准比色卡进行对照得PH。
是否需要先将试纸润湿?
如果先将试纸润湿,将造成什么样的误差?P73:图3-11精密PH试纸和广范PH试纸pH计法:通过电子仪器,把仪器的探棒放入溶液即可在显示屏上读出数据,该法精确度高。(三)、溶液PH计算1、单一溶液的pH值计算c[H+]=0.001mol/L PH=3c[H+]=10-5mol/L PH=5c[OH-]=10-5mol/L PH=9c[OH-]=0.001mol/L PH=11cH2SO4=0.001mol/L PH=cBa(OH)2=0.001mol/L PH=解:pH=-lgc[H+]=-lg(10-5+9×10-7)/10=-lg10-6=6pH=-lgc[H+]=-lg(10-5+999×10-7)/1000=-lg1.1×10-7=7-lg1.1=6.96例题:在25℃时,pH值等于5的盐酸溶液稀释到原来的10倍,pH值等于多少?稀释到1000倍后, pH值等于多少?2、pH值计算—— 酸的稀释解:c(OH-) =(10-5×1+9×10-7)/10≈10-6pH=-lgc[H+]=-lgKW/c[OH-]=-lg10-8=8c(OH-)=(10-5×1+999×10-7)/1000pOH=-lg[OH-]=1.1×10-7=6.96pH=14-6.96=7.04例题:在25℃时,pH值等于9的强碱溶液稀释到原来的10倍,pH值等于多少?稀释到1000倍后, pH值等于多少?3、pH值计算—— 碱的稀释①将pH为a的强碱溶液稀释到原体积的10m倍,稀释后溶液的pH=a-m。
将pH为a的弱碱溶液稀释到原体积的10m倍,稀释后溶液的pH>a-m。溶液的稀释、混合,pH值的求算基本原则:酸按H+ 、 碱按OH-,再利用KW来求H+
注:当a-m<7时,溶液的pH近似为7。
②将pH为b的强酸溶液稀释到原体积的10n倍,稀释后溶液的pH=b+n。
将pH为b的弱酸溶液稀释到原体积的10n倍,稀释后溶液的pH 注:当b+n>7时,溶液的pH近似为7。4、pH计算—— 强酸与强酸混合例题:在25℃时,pH值等于1的盐酸溶液1L和pH值等于4的硫酸溶液1000L混合pH值等于多少?解:pH=-lg[H+]=-lg(1×10-1+1000×10-4)/(1+1000)=-lg2×10-4=4-lg2=3.7pH计算—强酸与强酸等体积混合例题:在25℃时,pH值等于1的盐酸溶液和pH值等于4的硫酸溶液等体积混合pH值等于多少?解:pH=-lg[H+]=-lg(1×10-1+1×10-4)/(1+1)=-lg5×10-2=2-lg5=1.3pH混= pH小+0.35、pH计算—强碱与强碱混合解:=4-lg5=3.3例题:在25℃时,pH值等于9和pH值等于11的两种氢氧化钠溶液等体积混合pH值等于多少?c[OH-]=( 1 × 10-5+1×10-3)/(1+1)pOH=-lg[OH-]pOH=-lg5×10-4pH=14-pOH=10.7pH混= pH大-0.36、pH计算—强酸与强碱混合先利用化学方程式求出那个过量,然后再求PH值。如果恰好完全反应,就呈中性。在25℃时,100ml 0.6mol/L的盐酸与等体积0.4mol/L的氢氧化钠溶液混合后,溶液呈 性(酸、碱、中)?溶液的pH值等于多少?解: NaOH + HCl = NaCl + H2O0.04mol 0.06molpH=-lg[H+] =-lg0.02/(0.1+0.1)=-lg10-1=1关键:酸过量抓住氢离子进行计算!酸过量,溶液呈酸性。注意:①酸溶液的稀释:先求稀释后C(H+),再求pH。②碱溶液的稀释:先求稀释后C(OH-),后
求稀释后C(H+),再求pH。③当酸碱溶液电离出的C(H+)或C(OH-) 与水电离出的C(H+ )或C(OH-) 接近时,不能忽视水的电离。(四)、关于两强(强酸或强碱)溶液等体
积混合,且PH相差2个或2个以上单位时的PH
的计算:
1、若混合前,PH小+PH大>=15时,PH混=PH大—0.3;
2、若混合前,PH小+PH大=14时,PH混=7;
3、若混合前,PH小+PH大<=13时,PH混=PH小+0.3
在一定范围内人才能健康一、溶液的酸碱性
(一)、溶液的酸碱性
H+、OH-是溶液酸碱性的表征微粒,溶液呈
酸性、中性还是碱性,取决于C(H+)、C(OH-)
的相对大小。已知在25℃时,水的离子积Kw=1.0×10-14,请分别计算浓度均为0.01mol﹒L-1的盐酸、氯化钠溶液、氢氧化钠溶液中氢离子及氢氧根离子的浓度。
请根据计算结果讨论溶液的酸碱性与氢离子及氢氧根离子浓度的关系。看书P71图3-9溶液的酸碱性C(H+)与C(OH-)关系中性C(H+)=C(OH-)酸性C(H+)>C(OH-)碱性C(H+)
1. pH的定义:溶液的pH为氢离子浓度的负对数,可用来表示溶液的酸碱性。
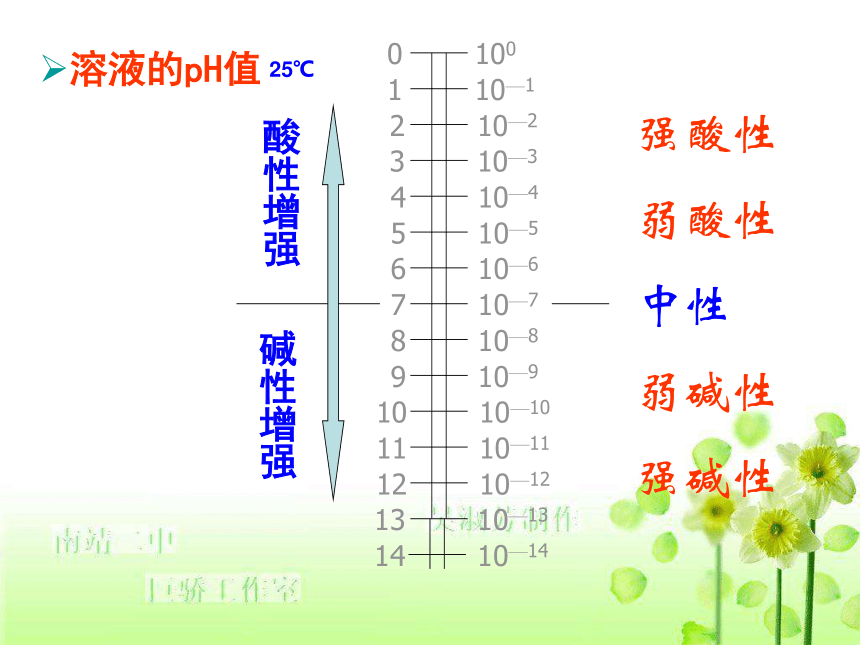
2. pH = - lg c(H+)如C(H+)=1×10-7mol/L的溶液pH=7通常,当溶液中氢离子浓度很小时,为了更方便表示酸碱性,通常用pH来表示。注意, 但当溶液中c(H+)>1mol/L时,直接用浓度表示。pOH值也有,但不常用。
pOH = - lg c(OH-)看书P72图3-10:PH的适用范围:0--14溶液的pH值酸性增强碱性增强强酸性
弱酸性
中性
弱碱性
强碱性25℃注意1、PH值越小,酸性越强,PH越大,碱性越强。
2、PH范围0---14之间。
3、PH值等于0的溶液不是酸性最强的溶液,
PH值等于14的溶液不是碱性最强的溶液
4、PH值增加一个单位C(H+) 减小10倍故判断溶液的酸碱性还可用PH值:(25℃)
酸性: pH < 7
中性: pH = 7
碱性: pH > 7若100℃时,水的离子积为10-12,求算此时水的pH.
PH=7的溶液不一定是中性溶液;
PH<7的溶液不一定是酸性溶液。
溶液温度不同,水电离出的C(H+)也不同,溶液的PH也会相应改变。3、pH值测定方法(1)定性测量范围: 酸碱指示剂。酸碱指示剂:一般是弱的有机酸或弱的有机碱,他们的颜色变化是在一定的pH值范围内发生的。我们把指示剂发生颜色变化的pH值范围叫做指示剂的变色范围。酸碱指示剂——甲基橙、石蕊、酚酞
常用酸碱指示剂及其变色范围:甲基橙石蕊酚酞583.14.4810红色紫色蓝色红色橙色黄色无色浅红红色(3)定量精确测量: pH计(小数位)。
可精确到:0.01(2)定量粗略测量: pH试纸(整数位)。 pH试纸的使用:
用洁净的玻璃棒蘸取待测溶液滴在PH试纸上将试纸与标准比色卡进行对照得PH。
是否需要先将试纸润湿?
如果先将试纸润湿,将造成什么样的误差?P73:图3-11精密PH试纸和广范PH试纸pH计法:通过电子仪器,把仪器的探棒放入溶液即可在显示屏上读出数据,该法精确度高。(三)、溶液PH计算1、单一溶液的pH值计算c[H+]=0.001mol/L PH=3c[H+]=10-5mol/L PH=5c[OH-]=10-5mol/L PH=9c[OH-]=0.001mol/L PH=11cH2SO4=0.001mol/L PH=cBa(OH)2=0.001mol/L PH=解:pH=-lgc[H+]=-lg(10-5+9×10-7)/10=-lg10-6=6pH=-lgc[H+]=-lg(10-5+999×10-7)/1000=-lg1.1×10-7=7-lg1.1=6.96例题:在25℃时,pH值等于5的盐酸溶液稀释到原来的10倍,pH值等于多少?稀释到1000倍后, pH值等于多少?2、pH值计算—— 酸的稀释解:c(OH-) =(10-5×1+9×10-7)/10≈10-6pH=-lgc[H+]=-lgKW/c[OH-]=-lg10-8=8c(OH-)=(10-5×1+999×10-7)/1000pOH=-lg[OH-]=1.1×10-7=6.96pH=14-6.96=7.04例题:在25℃时,pH值等于9的强碱溶液稀释到原来的10倍,pH值等于多少?稀释到1000倍后, pH值等于多少?3、pH值计算—— 碱的稀释①将pH为a的强碱溶液稀释到原体积的10m倍,稀释后溶液的pH=a-m。
将pH为a的弱碱溶液稀释到原体积的10m倍,稀释后溶液的pH>a-m。溶液的稀释、混合,pH值的求算基本原则:酸按H+ 、 碱按OH-,再利用KW来求H+
注:当a-m<7时,溶液的pH近似为7。
②将pH为b的强酸溶液稀释到原体积的10n倍,稀释后溶液的pH=b+n。
将pH为b的弱酸溶液稀释到原体积的10n倍,稀释后溶液的pH
求稀释后C(H+),再求pH。③当酸碱溶液电离出的C(H+)或C(OH-) 与水电离出的C(H+ )或C(OH-) 接近时,不能忽视水的电离。(四)、关于两强(强酸或强碱)溶液等体
积混合,且PH相差2个或2个以上单位时的PH
的计算:
1、若混合前,PH小+PH大>=15时,PH混=PH大—0.3;
2、若混合前,PH小+PH大=14时,PH混=7;
3、若混合前,PH小+PH大<=13时,PH混=PH小+0.3
