专题3第4单元沉淀溶液平衡第1课时
图片预览










文档简介
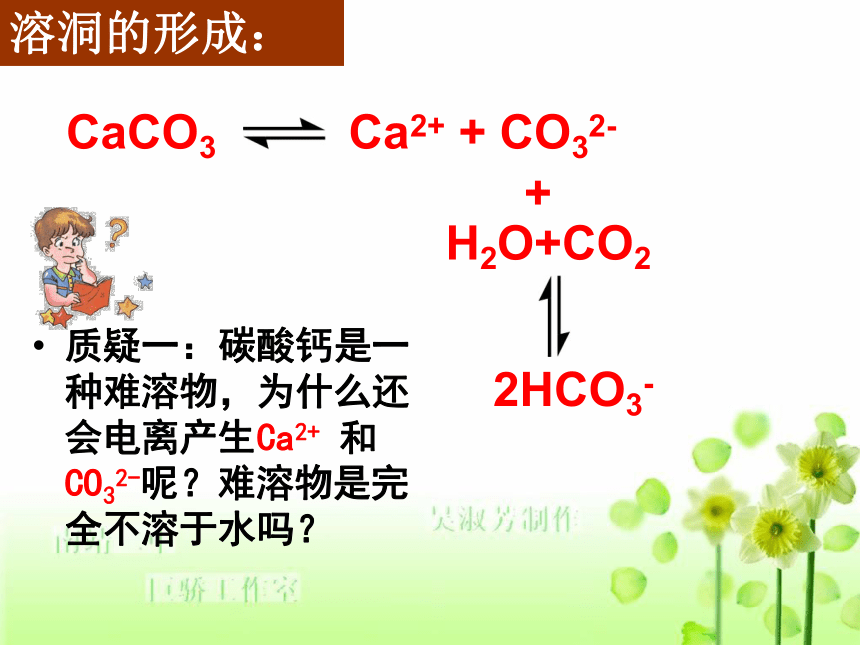
课件42张PPT。第四单元 难溶电解质的沉淀溶解平衡(第一课时:沉淀溶解平衡原理)南靖一中 沈建忠陕西商洛柞水县柞水溶洞山东淄博博山溶洞 当我们外出旅游,沉醉于秀美的湖光山色时,一定会惊叹大自然的鬼斧神工。石灰石岩层在经历了数万年的岁月侵蚀之后,会形成各种奇形异状的溶洞。你知道它是如何形成的吗?2HCO3-溶洞的形成:质疑一:碳酸钙是一种难溶物,为什么还会电离产生Ca2+ 和CO32-呢?难溶物是完全不溶于水吗?
一、沉淀溶解平衡大于10g易溶;1g~10g可溶;0.01g~1g微溶;小于0.01g,难溶20℃时,溶解度:? 难溶物如AgCl在水中一点都不溶吗?资料在线——溶解度(定义)在一定温度下,某物质在100克水里达到饱和状态时所溶解的质量。表达式:
S=(m溶质/m溶剂)X100g实验操作
1.将少量PbI2加入盛有一定量水的50mL烧杯中,用玻璃棒充分搅拌,静置一段时间。
2.取上层清液少量加入试管中,逐滴加入硝酸银溶液,振荡,观察现象。活动与探究P87 质疑二:
上述实验现象又为什么能发生呢?有黄色沉淀生成
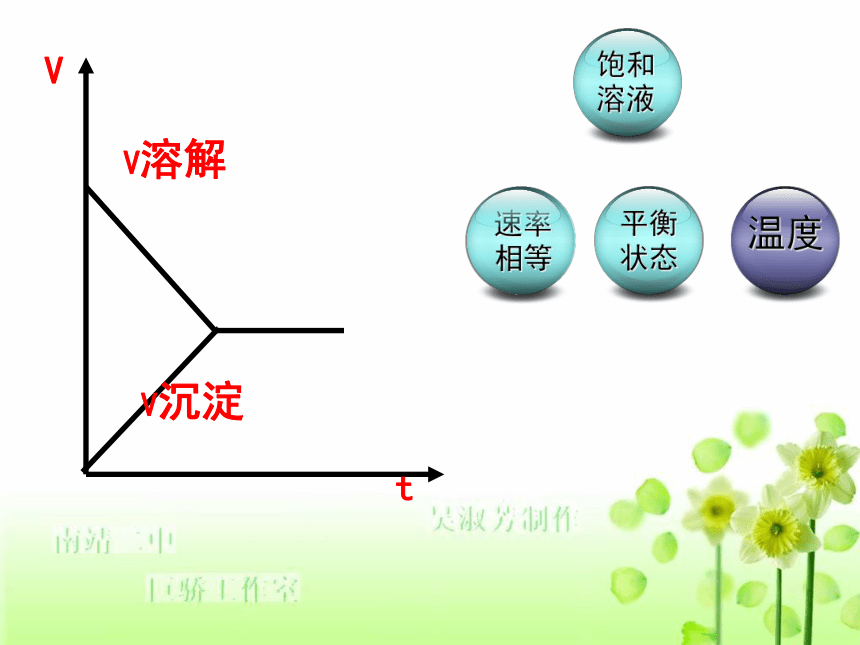
PbI2 (s)25℃时,AgCl的溶解度为1.5×10-4g1. 生成沉淀的离子反应能发生的原因?生成物的溶解度很小AgCl溶解度虽然很小,但并不是绝对不溶,生成AgCl沉淀也有极少量的溶解。思考以下问题2. 沉淀是绝对不溶于水吗?3、在上述可逆反应中,我们把正反应的速率(v正)看成AgCl的溶解过程,逆反应速率(v逆)看成Ag+和Cl-结合成AgCl的过程,那么,请大家画出将AgCl固体投入水中后,v正和v逆随时间的变化曲线。 试通过这个图像和课本上的内容,归纳总结出沉淀溶解平衡的形成过程。1. 溶解平衡的建立 一定温度下,将AgCl溶于水中,当v(溶解)=v(沉淀)时,得到饱和AgCl溶液,建立溶解平衡沉淀溶解平衡原理2. 表示方法外界条件一定,溶液中各粒子的浓度保持不变 外界条件改变,溶解平衡发生移动。 等:
定:
变:3. 溶解平衡的特征根据我们前面所学的知识,请同学们归纳出溶解平衡的特征 。动:动态平衡 几昼夜后饱和CuSO4溶液沉淀溶解平衡属于动态平衡。一定T 时: 溶解 溶解
BaSO4(s) ? BaSO4(aq) ? Ba2+(aq) + SO42-(aq)
沉淀 沉淀如: BaSO4 (s) BaSO4(aq)全
部
电
离Ba2+(aq) + SO42-(aq) BaSO4 (s)Ba2+(aq) + SO42-(aq)简写为 BaSO4 (s)Ba2+ + SO42- 1、下列有关AgCl的说法正确的是( )
A. AgCl难溶于水,溶液中没有Ag+和Cl—
B. 在AgCl饱和溶液中,AgCl没有再溶解了
C. AgCl是一种难溶物,所以是弱电解质
D.在AgCl饱和溶液中,AgCl生成和溶解不
断进行,但速率相等。D课堂习题2、书写如下难溶电解质的沉淀溶解平衡方程式:
PbI2 Fe(OH)3 3、 判断正误:
(1)饱和溶液中,沉淀溶解为离子和离子结合成沉淀的过程都停止了.
(2)一定条件下,当沉淀溶解平衡建立时,溶液中离子的浓度不再发生变化.二、影响沉淀溶解平衡的条件 想一想:我们学过哪些因素能够影响化学平衡,其中哪一些会对沉淀溶解平衡有影响呢?1.内因:
2.外因:沉淀本身的性质温度升高,多数溶解平衡向溶解方向移动。向溶解方向移动加入相同的离子,向生成沉淀的方向移动1、石灰乳中存在下列平衡:
Ca(OH)2(s) Ca2+(aq)+2 OH― (aq),加入下列溶液,可使Ca(OH)2减少的是( )
A. Na2CO3溶液 B. AlCl3溶液
C. NaOH溶液 D. CaCl2溶液大展身手A B2、完成P88页:问题解决 习惯上,把溶解度小于0.01g的电解质称作难溶电解质难溶电解质与易溶电解质之间并无严格的界限。而且对于常量化学来说,0.01g已是个非常小的量。所以通常情况下,当离子之间反应生成难溶电解质,可以认为反应已经完全。如:AgCl、AgBr、AgI、Ag2S、BaSO4、BaCO3、Fe(OH)3、Mg(OH)2等。试模仿化学平衡常数写出该反应的平衡常数。写出饱和CaCO3溶液中的溶解平衡表达式1、定义:
2、符号:
三、溶度积常数在一定温度下,在难溶电解质的饱和溶液中,达到沉淀溶解平衡状态时,各离子浓度幂之乘积为一常数.Ksp3、表示方法:Ksp = cm(An+)cn(Bm-)固体浓度视为定值 = c(Ag+)c(Cl-) Ksp 与其他平衡常数一样,在一定温度下,Ksp为一常数。写出难溶物AgI 、 Fe(OH)3的溶度积表达式 如:问题探究溶度积的大小表示物质的溶解能力,请根据
下表分析,溶度积与溶解度有什么关系?想一想:有人说Ksp越小,其物质的溶解度就越小,你认为正确吗?4、意义:反映了难溶电解质在水中的溶解能力;阴离子和阳离子个数比相同的物质, Ksp数值越大,难溶电解质在水中的溶解能力越强。5、影响因素:只与难溶电解质本身的性质和温度有关。与溶液浓度无关。常见难溶电解质的溶度积常数和溶解度(25℃)6、注意事项:
(1)、 Ksp是描述沉淀溶解平衡的常数,
Ksp的大小反映了难溶电解质在水中
的溶解能力。不同温度时, Ksp不同
。使用时注意下面两点:(a)、
溶液中离子浓度改变时,平衡移动
而Ksp 不变;(b)、不能仅根据Ksp的大小
比较溶解能力的强弱,只有当化学式
所表示的组成中阴阳离子个数比相同
时, Ksp的数值越大,才表示溶解能力越
强。
(2)、溶度积常数Ksp都有特定单位,如:
Ksp =[Ba2+ ][SO42- ]故单位是mol2.L2,
但实际应中通常只表示出其数值。7、溶度积规则: 一定温度下,AgCl的溶度积为Ksp,
①当Qc = Ksp时,
②当Qc < Ksp时,
③当Qc > Ksp时,
已达沉淀溶解平衡,此时饱和溶液。右移,表现为沉淀正在不断溶解;此时溶液为不饱和;左移,表现为溶液中的离子不断沉淀出来;此时溶液为过饱和;课堂练习1:在AgCl的饱和溶液中,有AgCl固体存在,当分别向溶液中加入下列物质时,将有何种变化? 加入物质 平衡 AgCl 溶液中浓度
移动 溶解度 [Ag+] [Cl-]HCl(0.1 mol·L-1)→ 不变 不变 不变不移动 不变 不变 不变→ ↑ ↑ ↑ Ksp增大 ← ↓ ↑ ↓ 同离子效应AgNO3(0.1 mol·L-1) 升温AgClH2O← ↓ ↓ ↑ 同离子效应课堂练习2请用溶度积规则解释沉淀溶解平衡的移动:
1 向PbI2(难溶于水)上层清液中滴加KI溶液会产生黄色沉淀,为什么?
2 将相同质量的AgCl(过量)分别溶于少量水和盐酸中,则水中C(Ag+)大于盐酸中C(Ag+),为什么? 课堂练习3某温度下AgCl的KSP=1.8×10—10,将0.001mol/LNaCl溶液和0.001mol/LAgNO3溶液等体积混合,是否有AgCl沉淀生成? 解:等体积混合后, c(Ag+) 和c(Cl—)均减半,即
c(Ag+) = 0.001mol/L× 1/2
c(Cl—) = 0.001mol/L× 1/2
Qc = c (Ag+)× c(Cl—) = 2.5×10-7
Qc > Ksp ∴有沉淀析出。
答:能析出AgCl沉淀。课堂练习4已知AgI的KSP=8.5×10—17, AgCl的KSP=1.8×10—10,在含有0.01mol/LNaI和0.01mol/LNaCl的混合溶液中,逐滴加入AgNO3溶液,先析出什么沉淀? (假设加入的AgNO3浓度较大,引起的体积变化不计)下列说法正确的是( )
A.在一定温度下AgCl水溶液中,Ag+和Cl-浓度的
乘积是一个常数;
B.AgCl的Ksp=1.8×10-10 mol·L-1,在任何含
AgCl固体的溶液中,c(Ag+)=c(Cl-)且Ag+与Cl-
浓度的乘积等于1.8×10-10 mol·L-1;
C.温度一定时,当溶液中Ag+和Cl-浓度的乘积等于
Ksp值时,此溶液为AgCl的饱和溶液;
D.向饱和AgCl水溶液中加入盐酸,Ksp值变大。C课堂练习51、利用Ksp判断沉淀的溶解与生成
例1:将等体积4×10-3mol/L的AgNO3溶液和4×10-3mol/L的K2CrO4溶液混合,是否析出Ag2CrO4沉淀?[已Ksp(Ag2CrO4)=9.0×10-12]答案:等体积混合后,
c 2(Ag+) ×c(CrO42-)
=[(4×10-3)/2 ]2×(4×10-3)/2
= 8×10-9 > 9.0×10-12 ,所以有析出Ag2CrO4沉淀。四、溶度积的应用2、溶度积规则利用Ksp判断沉淀的溶解与生成 ①离子积Q >Ksp 时,
(2) Q = Ksp 时,
(3)Q < Ksp 时,②溶度积规则 沉淀从溶液中析出(溶液过饱和),
体系中不断析出沉淀,直至达到平衡沉淀与饱和溶液的平衡
溶液不饱和,若体系中有沉淀,则沉淀会溶解直至达到平衡。
在100mL 0.01mol/LKCl 溶液中,加入 1mL 0.01mol/L AgNO3 溶液,下列说法正确的是( )
(AgCl KSP=1.8×10-10)
A.有AgCl沉淀析出 B. 无AgCl沉淀
C. 无法确定 D. 有沉淀但不是AgClA大展身手下列情况下,有无CaCO3沉淀生成?
(1)往盛有1.0 L纯水中加入0.1 mL浓度为0.01 mol /L 的CaCl2和Na2CO3;
(2)改变CaCl2和Na2CO3的浓度为1.0 mol /L 呢? [Ca2+] = [CO32-] = 0.1?10-3 ? 0.01/1.0 = 10-6 mol /L Q= [Ca2+]×[CO32-] = 10-12 < Ksp,CaCO3=4.96 ?10-9
因此无 CaCO3沉淀生成。[Ca2+]×[CO32-] = 10-4 mol /L
Q = [Ca2+]×[CO32-] = 10-8 > Ksp,CaCO3
因此有CaCO3沉淀生成。
大展身手溶解度s的单位g/L或mol/L,即饱和时的浓度。
AmBn(s)?mAn++nBm-
s ms ns
Ksp=[An+]m[Bm-]n=[ms]m[ns]n=mmnnsm+n 3.利用Ksp计算难溶物的溶解度例2、已知Ksp,AgCl= 1.56 ? 10-10, 试求AgCl溶解度(用g/L表示)例3:室温下,AgCl的溶解度是1.93×10-3g/L,求AgCl的溶度积。已知AgCl的摩尔质量为143.3g/mol。
解:
①把AgCl溶解度单位(g/L)换算成mol·L-1
s=1.93×10-3g/L÷143.3g/mol
=1.35×10-5mol·L-1
②求Ksp
AgCl(s) ? Ag+ + Cl-
饱和、平衡 1.35×10-5 1.35×10-5
Ksp(AgCl)=[Ag+][Cl-]
=(1.35×10-5)2
=1.82×10-10
答:AgCl的Ksp为1.82×10-10例4:Mg(OH)2的Ksp=1.20×10-11在298K时,Mg(OH)2的溶解度为多少?
解:Mg(OH)2(s) ?Mg2++2OH-
设溶解度为s
平衡时 s 2s
Ksp=[Mg2+][OH-]2
=s(2s)2
=4s3
=1.2×10-11
∴ s=1.44×10-4mol·L-1
答:氢氧化镁在298K时的溶解度为
1.44×10-4mol·L-1。例5:Ag2CrO4在298K时溶解度s=1.34×10-4mol·L-1求:Ksp
解:
Ag2CrO4(s) ?2Ag+ + CrO42-
平衡时 2×1.34×10-4 1.34×10-4
Ksp=[Ag+]2[CrO42-]
=(2×1.34×10-4)2×1.34×10-4
=9.62×10-12
答:铬酸银在298K时的Ksp=9.62×10-12
由以上三个例题的结果可得到如下结论:
①同种类型的难溶电解质,在一定温度下,Ksp越大则溶解度越大。
②不同类型则不能用Ksp的大小来比较溶解度的大小,必须经过换算才能得出结论。
一、沉淀溶解平衡大于10g易溶;1g~10g可溶;0.01g~1g微溶;小于0.01g,难溶20℃时,溶解度:? 难溶物如AgCl在水中一点都不溶吗?资料在线——溶解度(定义)在一定温度下,某物质在100克水里达到饱和状态时所溶解的质量。表达式:
S=(m溶质/m溶剂)X100g实验操作
1.将少量PbI2加入盛有一定量水的50mL烧杯中,用玻璃棒充分搅拌,静置一段时间。
2.取上层清液少量加入试管中,逐滴加入硝酸银溶液,振荡,观察现象。活动与探究P87 质疑二:
上述实验现象又为什么能发生呢?有黄色沉淀生成
PbI2 (s)25℃时,AgCl的溶解度为1.5×10-4g1. 生成沉淀的离子反应能发生的原因?生成物的溶解度很小AgCl溶解度虽然很小,但并不是绝对不溶,生成AgCl沉淀也有极少量的溶解。思考以下问题2. 沉淀是绝对不溶于水吗?3、在上述可逆反应中,我们把正反应的速率(v正)看成AgCl的溶解过程,逆反应速率(v逆)看成Ag+和Cl-结合成AgCl的过程,那么,请大家画出将AgCl固体投入水中后,v正和v逆随时间的变化曲线。 试通过这个图像和课本上的内容,归纳总结出沉淀溶解平衡的形成过程。1. 溶解平衡的建立 一定温度下,将AgCl溶于水中,当v(溶解)=v(沉淀)时,得到饱和AgCl溶液,建立溶解平衡沉淀溶解平衡原理2. 表示方法外界条件一定,溶液中各粒子的浓度保持不变 外界条件改变,溶解平衡发生移动。 等:
定:
变:3. 溶解平衡的特征根据我们前面所学的知识,请同学们归纳出溶解平衡的特征 。动:动态平衡 几昼夜后饱和CuSO4溶液沉淀溶解平衡属于动态平衡。一定T 时: 溶解 溶解
BaSO4(s) ? BaSO4(aq) ? Ba2+(aq) + SO42-(aq)
沉淀 沉淀如: BaSO4 (s) BaSO4(aq)全
部
电
离Ba2+(aq) + SO42-(aq) BaSO4 (s)Ba2+(aq) + SO42-(aq)简写为 BaSO4 (s)Ba2+ + SO42- 1、下列有关AgCl的说法正确的是( )
A. AgCl难溶于水,溶液中没有Ag+和Cl—
B. 在AgCl饱和溶液中,AgCl没有再溶解了
C. AgCl是一种难溶物,所以是弱电解质
D.在AgCl饱和溶液中,AgCl生成和溶解不
断进行,但速率相等。D课堂习题2、书写如下难溶电解质的沉淀溶解平衡方程式:
PbI2 Fe(OH)3 3、 判断正误:
(1)饱和溶液中,沉淀溶解为离子和离子结合成沉淀的过程都停止了.
(2)一定条件下,当沉淀溶解平衡建立时,溶液中离子的浓度不再发生变化.二、影响沉淀溶解平衡的条件 想一想:我们学过哪些因素能够影响化学平衡,其中哪一些会对沉淀溶解平衡有影响呢?1.内因:
2.外因:沉淀本身的性质温度升高,多数溶解平衡向溶解方向移动。向溶解方向移动加入相同的离子,向生成沉淀的方向移动1、石灰乳中存在下列平衡:
Ca(OH)2(s) Ca2+(aq)+2 OH― (aq),加入下列溶液,可使Ca(OH)2减少的是( )
A. Na2CO3溶液 B. AlCl3溶液
C. NaOH溶液 D. CaCl2溶液大展身手A B2、完成P88页:问题解决 习惯上,把溶解度小于0.01g的电解质称作难溶电解质难溶电解质与易溶电解质之间并无严格的界限。而且对于常量化学来说,0.01g已是个非常小的量。所以通常情况下,当离子之间反应生成难溶电解质,可以认为反应已经完全。如:AgCl、AgBr、AgI、Ag2S、BaSO4、BaCO3、Fe(OH)3、Mg(OH)2等。试模仿化学平衡常数写出该反应的平衡常数。写出饱和CaCO3溶液中的溶解平衡表达式1、定义:
2、符号:
三、溶度积常数在一定温度下,在难溶电解质的饱和溶液中,达到沉淀溶解平衡状态时,各离子浓度幂之乘积为一常数.Ksp3、表示方法:Ksp = cm(An+)cn(Bm-)固体浓度视为定值 = c(Ag+)c(Cl-) Ksp 与其他平衡常数一样,在一定温度下,Ksp为一常数。写出难溶物AgI 、 Fe(OH)3的溶度积表达式 如:问题探究溶度积的大小表示物质的溶解能力,请根据
下表分析,溶度积与溶解度有什么关系?想一想:有人说Ksp越小,其物质的溶解度就越小,你认为正确吗?4、意义:反映了难溶电解质在水中的溶解能力;阴离子和阳离子个数比相同的物质, Ksp数值越大,难溶电解质在水中的溶解能力越强。5、影响因素:只与难溶电解质本身的性质和温度有关。与溶液浓度无关。常见难溶电解质的溶度积常数和溶解度(25℃)6、注意事项:
(1)、 Ksp是描述沉淀溶解平衡的常数,
Ksp的大小反映了难溶电解质在水中
的溶解能力。不同温度时, Ksp不同
。使用时注意下面两点:(a)、
溶液中离子浓度改变时,平衡移动
而Ksp 不变;(b)、不能仅根据Ksp的大小
比较溶解能力的强弱,只有当化学式
所表示的组成中阴阳离子个数比相同
时, Ksp的数值越大,才表示溶解能力越
强。
(2)、溶度积常数Ksp都有特定单位,如:
Ksp =[Ba2+ ][SO42- ]故单位是mol2.L2,
但实际应中通常只表示出其数值。7、溶度积规则: 一定温度下,AgCl的溶度积为Ksp,
①当Qc = Ksp时,
②当Qc < Ksp时,
③当Qc > Ksp时,
已达沉淀溶解平衡,此时饱和溶液。右移,表现为沉淀正在不断溶解;此时溶液为不饱和;左移,表现为溶液中的离子不断沉淀出来;此时溶液为过饱和;课堂练习1:在AgCl的饱和溶液中,有AgCl固体存在,当分别向溶液中加入下列物质时,将有何种变化? 加入物质 平衡 AgCl 溶液中浓度
移动 溶解度 [Ag+] [Cl-]HCl(0.1 mol·L-1)→ 不变 不变 不变不移动 不变 不变 不变→ ↑ ↑ ↑ Ksp增大 ← ↓ ↑ ↓ 同离子效应AgNO3(0.1 mol·L-1) 升温AgClH2O← ↓ ↓ ↑ 同离子效应课堂练习2请用溶度积规则解释沉淀溶解平衡的移动:
1 向PbI2(难溶于水)上层清液中滴加KI溶液会产生黄色沉淀,为什么?
2 将相同质量的AgCl(过量)分别溶于少量水和盐酸中,则水中C(Ag+)大于盐酸中C(Ag+),为什么? 课堂练习3某温度下AgCl的KSP=1.8×10—10,将0.001mol/LNaCl溶液和0.001mol/LAgNO3溶液等体积混合,是否有AgCl沉淀生成? 解:等体积混合后, c(Ag+) 和c(Cl—)均减半,即
c(Ag+) = 0.001mol/L× 1/2
c(Cl—) = 0.001mol/L× 1/2
Qc = c (Ag+)× c(Cl—) = 2.5×10-7
Qc > Ksp ∴有沉淀析出。
答:能析出AgCl沉淀。课堂练习4已知AgI的KSP=8.5×10—17, AgCl的KSP=1.8×10—10,在含有0.01mol/LNaI和0.01mol/LNaCl的混合溶液中,逐滴加入AgNO3溶液,先析出什么沉淀? (假设加入的AgNO3浓度较大,引起的体积变化不计)下列说法正确的是( )
A.在一定温度下AgCl水溶液中,Ag+和Cl-浓度的
乘积是一个常数;
B.AgCl的Ksp=1.8×10-10 mol·L-1,在任何含
AgCl固体的溶液中,c(Ag+)=c(Cl-)且Ag+与Cl-
浓度的乘积等于1.8×10-10 mol·L-1;
C.温度一定时,当溶液中Ag+和Cl-浓度的乘积等于
Ksp值时,此溶液为AgCl的饱和溶液;
D.向饱和AgCl水溶液中加入盐酸,Ksp值变大。C课堂练习51、利用Ksp判断沉淀的溶解与生成
例1:将等体积4×10-3mol/L的AgNO3溶液和4×10-3mol/L的K2CrO4溶液混合,是否析出Ag2CrO4沉淀?[已Ksp(Ag2CrO4)=9.0×10-12]答案:等体积混合后,
c 2(Ag+) ×c(CrO42-)
=[(4×10-3)/2 ]2×(4×10-3)/2
= 8×10-9 > 9.0×10-12 ,所以有析出Ag2CrO4沉淀。四、溶度积的应用2、溶度积规则利用Ksp判断沉淀的溶解与生成 ①离子积Q >Ksp 时,
(2) Q = Ksp 时,
(3)Q < Ksp 时,②溶度积规则 沉淀从溶液中析出(溶液过饱和),
体系中不断析出沉淀,直至达到平衡沉淀与饱和溶液的平衡
溶液不饱和,若体系中有沉淀,则沉淀会溶解直至达到平衡。
在100mL 0.01mol/LKCl 溶液中,加入 1mL 0.01mol/L AgNO3 溶液,下列说法正确的是( )
(AgCl KSP=1.8×10-10)
A.有AgCl沉淀析出 B. 无AgCl沉淀
C. 无法确定 D. 有沉淀但不是AgClA大展身手下列情况下,有无CaCO3沉淀生成?
(1)往盛有1.0 L纯水中加入0.1 mL浓度为0.01 mol /L 的CaCl2和Na2CO3;
(2)改变CaCl2和Na2CO3的浓度为1.0 mol /L 呢? [Ca2+] = [CO32-] = 0.1?10-3 ? 0.01/1.0 = 10-6 mol /L Q= [Ca2+]×[CO32-] = 10-12 < Ksp,CaCO3=4.96 ?10-9
因此无 CaCO3沉淀生成。[Ca2+]×[CO32-] = 10-4 mol /L
Q = [Ca2+]×[CO32-] = 10-8 > Ksp,CaCO3
因此有CaCO3沉淀生成。
大展身手溶解度s的单位g/L或mol/L,即饱和时的浓度。
AmBn(s)?mAn++nBm-
s ms ns
Ksp=[An+]m[Bm-]n=[ms]m[ns]n=mmnnsm+n 3.利用Ksp计算难溶物的溶解度例2、已知Ksp,AgCl= 1.56 ? 10-10, 试求AgCl溶解度(用g/L表示)例3:室温下,AgCl的溶解度是1.93×10-3g/L,求AgCl的溶度积。已知AgCl的摩尔质量为143.3g/mol。
解:
①把AgCl溶解度单位(g/L)换算成mol·L-1
s=1.93×10-3g/L÷143.3g/mol
=1.35×10-5mol·L-1
②求Ksp
AgCl(s) ? Ag+ + Cl-
饱和、平衡 1.35×10-5 1.35×10-5
Ksp(AgCl)=[Ag+][Cl-]
=(1.35×10-5)2
=1.82×10-10
答:AgCl的Ksp为1.82×10-10例4:Mg(OH)2的Ksp=1.20×10-11在298K时,Mg(OH)2的溶解度为多少?
解:Mg(OH)2(s) ?Mg2++2OH-
设溶解度为s
平衡时 s 2s
Ksp=[Mg2+][OH-]2
=s(2s)2
=4s3
=1.2×10-11
∴ s=1.44×10-4mol·L-1
答:氢氧化镁在298K时的溶解度为
1.44×10-4mol·L-1。例5:Ag2CrO4在298K时溶解度s=1.34×10-4mol·L-1求:Ksp
解:
Ag2CrO4(s) ?2Ag+ + CrO42-
平衡时 2×1.34×10-4 1.34×10-4
Ksp=[Ag+]2[CrO42-]
=(2×1.34×10-4)2×1.34×10-4
=9.62×10-12
答:铬酸银在298K时的Ksp=9.62×10-12
由以上三个例题的结果可得到如下结论:
①同种类型的难溶电解质,在一定温度下,Ksp越大则溶解度越大。
②不同类型则不能用Ksp的大小来比较溶解度的大小,必须经过换算才能得出结论。
