化学反应中的热效应第3课时
图片预览






文档简介
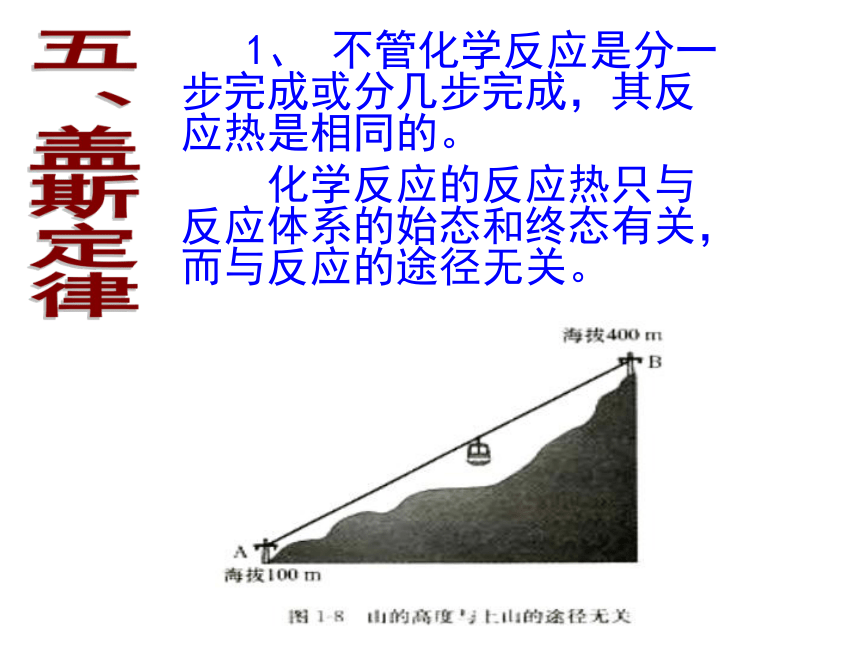
课件25张PPT。第一单元 化学反应中的热效应(第三课时)南靖一中 沈建忠五、盖斯定律 1、 不管化学反应是分一步完成或分几步完成,其反应热是相同的。
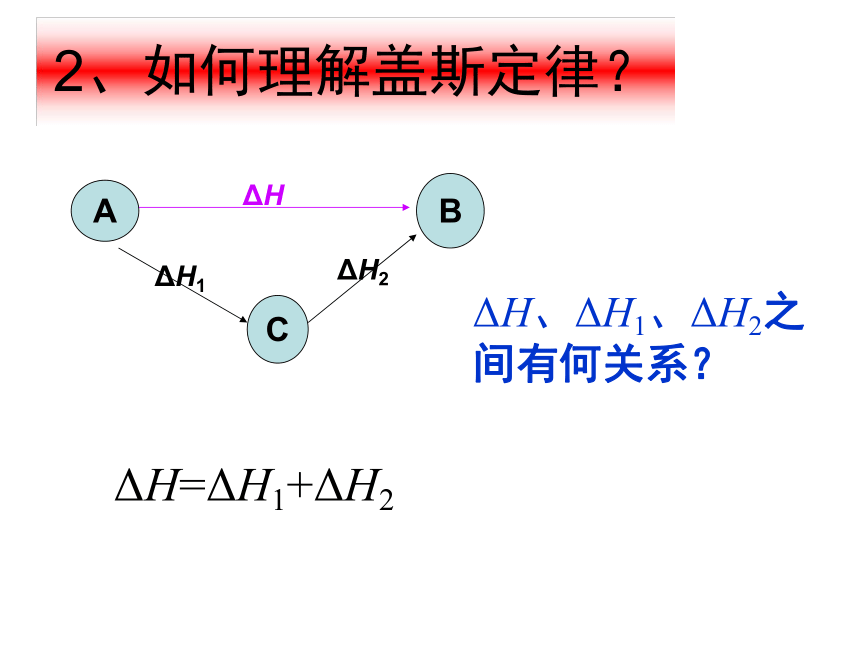
化学反应的反应热只与反应体系的始态和终态有关,而与反应的途径无关。2、如何理解盖斯定律?ΔH、ΔH1、ΔH2之间有何关系?ΔH=ΔH1+ΔH2BΔH如何测出这个反应的反应热:
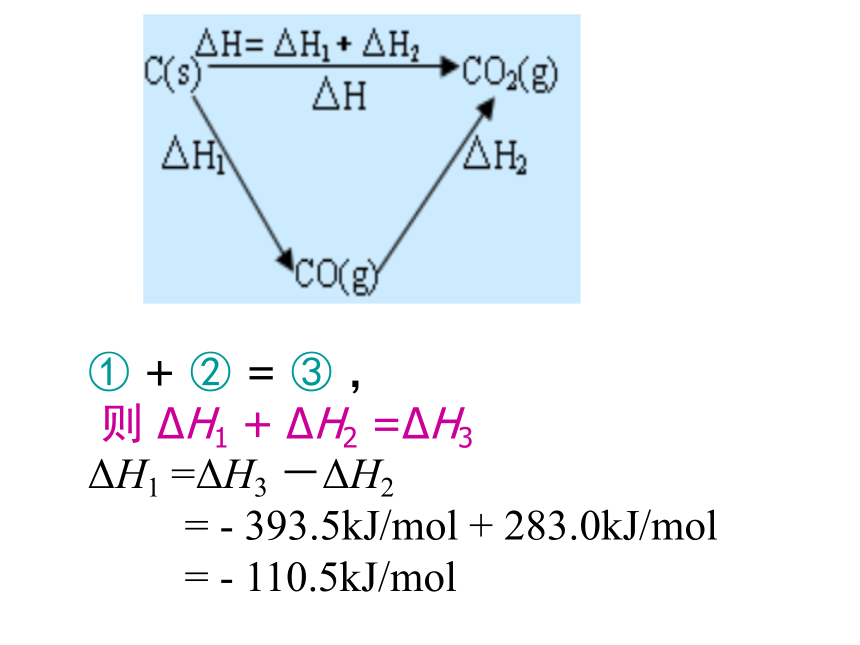
C(s)+1/2O2(g) = CO(g) ΔH1=?你知道吗?①C(s)+1/2O2(g)==CO(g) ΔH1=?
②CO(g)+1/2O2(g)== CO2(g) ΔH2=—283.0kJ/mol
③C(s)+O2(g)==CO2(g) ΔH3=—393.5kJ/mol
① + ② = ③ ,
则 ΔH1 + ΔH2 =ΔH3
ΔH1 =ΔH3 -ΔH2
= - 393.5kJ/mol + 283.0kJ/mol
= - 110.5kJ/mol 若多步化学反应相加可得到新的化学反应,则新反应的反应热即为上述多步反应的反应热之和。3、【总结规律】注意:
1、计量数的变化与反应热数值的变化要对应
2、反应方向发生改变反应热的符号也要改变总结思考:
在用方程式叠加计算反应热时要注意哪些问题?盖斯定律的应用根据下列反应的焓变,计算C(石墨)与H2(g)反应生成1molC2H2(g)的焓变:
C(石墨)+O2(g)=CO2(g) △H=-393.5KJ/mol
2H2(g)+O2(g)=2H2O(l) △H=-571.6KJ/mol
2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l) △H=-2599.2KJ/mol ∵ (①×4 +② -③) ÷2
得到2C(石墨)(s)+H2(g) =C2H2(g)
∴ △H=(△H1 ×4 + △H2- △H3) ÷2①②③=+226.8KJ/mol你知道神六的火箭燃料是什么吗?例2、某次发射火箭,用N2H4(肼)在NO2中燃烧,生成N2、液态H2O。已知:
N2(g)+2O2(g)==2NO2(g) △H1=+67.2kJ/mol
N2H4(g)+O2(g)==N2(g)+2H2O(l) △H2=-534kJ/mol
假如都在相同状态下,请写出发射火箭反应的热化学方程式。2 N2H4(g)+ 2NO2(g)= 3N2(g)+4H2O(l)
△H=-1135.2kJ/mol 课后拓展4.盖斯定律应用条件:注意:
① 某化学反应是在等压(或等容)下一步完成的,在分步完成时,各分步也要在等压(或等容)下进行;
② 要消去某同一物质时,不仅要求物质的种类相同,其物质的聚集状态也相同。
请同学们阅读P8页例2例 2:求反应 C(石墨)+1/2 O2(g) ? CO(g) 的反应热?
始态 C(石墨)+O2(g) ? 终态 CO2(g)
CO(g) + 1/2O2
已知: C(石墨) + O2(g) ? CO2(g) ?
?rHm? = - 393.5 kJ·mol-1
CO(g) +1/2O2(g) ? CO2(g) ?
?rHm? 2 = - 283.0 kJ·mol-1
则? - ?得:C(石墨)+1/2 O2(g) ? CO(g) 的?rHm? 1 为:
?rHm? = ?rHm? 1 - ?rHm? 2 = -110.5 kJ·mol-1
化学反应中的能量变化,通常表现为
热量的变化。 其它:电能/光能/功等六、燃料的充分燃烧请同学们完成P8页:问题解决使用化石燃料的利弊及新能源的开发 广义地讲,能够发生燃烧反应放出热量的物质都可称为燃料。
煤、石油、天然气;它们的燃烧热都很高。
以煤为例,从资源蕴藏、开采、运输、资源综合利用以及环境保护等方面,对使用化石燃料的利弊进行研讨。 介绍我国能源利用现状与节能的探讨。远古时代,燃烧这一最早被利用的氧化还原反应促进了人类的进化。
地球上,植物通过光合作用每年储存了大约1017 kJ 能量,同时将1010 t 碳转化为碳水化合物。
人体中氧通过与血红蛋白的结合形成氧合血红蛋白,并在需要时缓慢释放,氧化葡萄糖,放出能量。
现代社会,金属冶炼、高能燃料和众多化工产品的合成都涉及氧化还原反应和能量变化。能源的分类能量消耗前六名的国家图 世界六国消耗的一次能源比例及总比例(占世界)趋势(比例):
石油和天然气下降;
煤炭上升;
核电上升。1.人类当前所需能源的主要来源是化石燃料――煤、石油、天然气。
2.人类应当树立节能意识:
(1)化石燃烧无法再生;
(2)提高燃烧效率,节约能源。
3.使燃料充分燃烧的措施:
(1)通入充足且适量的空气;
(2)固体燃料粉碎、液体燃料喷雾以增大燃料与空气的接触面。
4.煤炭的气化和液化,既防止污染,又提高燃烧效率。 新能源的开发 1.燃料电池,2.氢能,
3.太阳能, 4.风能,
5.生物能、 6.核能、
7.地热能、 8.潮汐能等 燃料电池锂锰电池:锂离子电池:碱性(Zn-MnO2)电池(一次性)图 秦山核电厂外景秦山核电站二期工程施工现场 鸟 瞰 一 期 沸腾炉接触法制硫酸例:在同温、同压下,比较下列反应放出热量Q1、Q2的大小A:2H2(g)+O2(g)=2H2O(g)+Q1
2H2(g)+O2(g)=2H2O(l)+Q2分析:反应物的状态,数量和生成物的数量都相同,但由于气态水转化为液态要放出一定数量的热量∴Q2>Q1B: S(g)+O2(g)=SO2(g)+Q1
S(S)+O2(g)=SO2(g)+Q2两式数量相同,S由固态吸收热量转化为气态,在氧化燃烧生成SO2。其放出热量的总和小于由气态S直接燃烧所放出的热量C: C(S)+1/2O2(g)=CO(g)+Q1
C(S)+O2(g)=CO2(g)+Q2固态C氧化为CO,释放出热量Q1,CO是气体燃料,和O2反应生成CO2,又释放热量Q3,两次释放热量的总和Q1+Q3,等于固态C氧化为气态CO2释放的热量Q2,∴Q2>Q1D: H2(g)+Cl2(g)=2HCl(g)+Q1
1/2H2(g)+1/2Cl2(g)= HCl(g)+Q2状态相同,但数量后式仅是前式的一半,释放的热量也应是前式的一半,Q2<Q112g石墨与O2反应生成CO2放出393.51KJ热量; 12g金刚石与O2反应生成CO2放出395.41KJ热量,试比较,石墨与金刚石哪个稳定?比较相同状态、相同数量的金刚石和石墨,与O2完全反应,生成相同状态、相同数量的CO2,金刚石释放出的热量更多,说明金刚石具有的总能量高,不稳定例题2:
化学反应的反应热只与反应体系的始态和终态有关,而与反应的途径无关。2、如何理解盖斯定律?ΔH、ΔH1、ΔH2之间有何关系?ΔH=ΔH1+ΔH2BΔH如何测出这个反应的反应热:
C(s)+1/2O2(g) = CO(g) ΔH1=?你知道吗?①C(s)+1/2O2(g)==CO(g) ΔH1=?
②CO(g)+1/2O2(g)== CO2(g) ΔH2=—283.0kJ/mol
③C(s)+O2(g)==CO2(g) ΔH3=—393.5kJ/mol
① + ② = ③ ,
则 ΔH1 + ΔH2 =ΔH3
ΔH1 =ΔH3 -ΔH2
= - 393.5kJ/mol + 283.0kJ/mol
= - 110.5kJ/mol 若多步化学反应相加可得到新的化学反应,则新反应的反应热即为上述多步反应的反应热之和。3、【总结规律】注意:
1、计量数的变化与反应热数值的变化要对应
2、反应方向发生改变反应热的符号也要改变总结思考:
在用方程式叠加计算反应热时要注意哪些问题?盖斯定律的应用根据下列反应的焓变,计算C(石墨)与H2(g)反应生成1molC2H2(g)的焓变:
C(石墨)+O2(g)=CO2(g) △H=-393.5KJ/mol
2H2(g)+O2(g)=2H2O(l) △H=-571.6KJ/mol
2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l) △H=-2599.2KJ/mol ∵ (①×4 +② -③) ÷2
得到2C(石墨)(s)+H2(g) =C2H2(g)
∴ △H=(△H1 ×4 + △H2- △H3) ÷2①②③=+226.8KJ/mol你知道神六的火箭燃料是什么吗?例2、某次发射火箭,用N2H4(肼)在NO2中燃烧,生成N2、液态H2O。已知:
N2(g)+2O2(g)==2NO2(g) △H1=+67.2kJ/mol
N2H4(g)+O2(g)==N2(g)+2H2O(l) △H2=-534kJ/mol
假如都在相同状态下,请写出发射火箭反应的热化学方程式。2 N2H4(g)+ 2NO2(g)= 3N2(g)+4H2O(l)
△H=-1135.2kJ/mol 课后拓展4.盖斯定律应用条件:注意:
① 某化学反应是在等压(或等容)下一步完成的,在分步完成时,各分步也要在等压(或等容)下进行;
② 要消去某同一物质时,不仅要求物质的种类相同,其物质的聚集状态也相同。
请同学们阅读P8页例2例 2:求反应 C(石墨)+1/2 O2(g) ? CO(g) 的反应热?
始态 C(石墨)+O2(g) ? 终态 CO2(g)
CO(g) + 1/2O2
已知: C(石墨) + O2(g) ? CO2(g) ?
?rHm? = - 393.5 kJ·mol-1
CO(g) +1/2O2(g) ? CO2(g) ?
?rHm? 2 = - 283.0 kJ·mol-1
则? - ?得:C(石墨)+1/2 O2(g) ? CO(g) 的?rHm? 1 为:
?rHm? = ?rHm? 1 - ?rHm? 2 = -110.5 kJ·mol-1
化学反应中的能量变化,通常表现为
热量的变化。 其它:电能/光能/功等六、燃料的充分燃烧请同学们完成P8页:问题解决使用化石燃料的利弊及新能源的开发 广义地讲,能够发生燃烧反应放出热量的物质都可称为燃料。
煤、石油、天然气;它们的燃烧热都很高。
以煤为例,从资源蕴藏、开采、运输、资源综合利用以及环境保护等方面,对使用化石燃料的利弊进行研讨。 介绍我国能源利用现状与节能的探讨。远古时代,燃烧这一最早被利用的氧化还原反应促进了人类的进化。
地球上,植物通过光合作用每年储存了大约1017 kJ 能量,同时将1010 t 碳转化为碳水化合物。
人体中氧通过与血红蛋白的结合形成氧合血红蛋白,并在需要时缓慢释放,氧化葡萄糖,放出能量。
现代社会,金属冶炼、高能燃料和众多化工产品的合成都涉及氧化还原反应和能量变化。能源的分类能量消耗前六名的国家图 世界六国消耗的一次能源比例及总比例(占世界)趋势(比例):
石油和天然气下降;
煤炭上升;
核电上升。1.人类当前所需能源的主要来源是化石燃料――煤、石油、天然气。
2.人类应当树立节能意识:
(1)化石燃烧无法再生;
(2)提高燃烧效率,节约能源。
3.使燃料充分燃烧的措施:
(1)通入充足且适量的空气;
(2)固体燃料粉碎、液体燃料喷雾以增大燃料与空气的接触面。
4.煤炭的气化和液化,既防止污染,又提高燃烧效率。 新能源的开发 1.燃料电池,2.氢能,
3.太阳能, 4.风能,
5.生物能、 6.核能、
7.地热能、 8.潮汐能等 燃料电池锂锰电池:锂离子电池:碱性(Zn-MnO2)电池(一次性)图 秦山核电厂外景秦山核电站二期工程施工现场 鸟 瞰 一 期 沸腾炉接触法制硫酸例:在同温、同压下,比较下列反应放出热量Q1、Q2的大小A:2H2(g)+O2(g)=2H2O(g)+Q1
2H2(g)+O2(g)=2H2O(l)+Q2分析:反应物的状态,数量和生成物的数量都相同,但由于气态水转化为液态要放出一定数量的热量∴Q2>Q1B: S(g)+O2(g)=SO2(g)+Q1
S(S)+O2(g)=SO2(g)+Q2两式数量相同,S由固态吸收热量转化为气态,在氧化燃烧生成SO2。其放出热量的总和小于由气态S直接燃烧所放出的热量C: C(S)+1/2O2(g)=CO(g)+Q1
C(S)+O2(g)=CO2(g)+Q2固态C氧化为CO,释放出热量Q1,CO是气体燃料,和O2反应生成CO2,又释放热量Q3,两次释放热量的总和Q1+Q3,等于固态C氧化为气态CO2释放的热量Q2,∴Q2>Q1D: H2(g)+Cl2(g)=2HCl(g)+Q1
1/2H2(g)+1/2Cl2(g)= HCl(g)+Q2状态相同,但数量后式仅是前式的一半,释放的热量也应是前式的一半,Q2<Q112g石墨与O2反应生成CO2放出393.51KJ热量; 12g金刚石与O2反应生成CO2放出395.41KJ热量,试比较,石墨与金刚石哪个稳定?比较相同状态、相同数量的金刚石和石墨,与O2完全反应,生成相同状态、相同数量的CO2,金刚石释放出的热量更多,说明金刚石具有的总能量高,不稳定例题2:
