《金属的化学性质》第一课时说课
文档属性
| 名称 | 《金属的化学性质》第一课时说课 |  | |
| 格式 | rar | ||
| 文件大小 | 1.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2010-07-12 20:41:00 | ||
图片预览








文档简介
课件20张PPT。金属的化学性质
第一课时株洲市一中 苏金华教材简析
本节“金属的化学性质”是在初中介绍的金属和金属材料的基础上,进一步加深和提高。金属种类主要选了“钠、铝、铁”,通过金属与非金属的反应,金属与酸和水的反应,及铝与氢氧化钠溶液的反应,对金属的化学性质较系统的作了阐述,学好这部分知识对以后学习元素周期律等有很大帮助。本节最后还安排了“物质的量在化学方程式计算中的应用”,引导学生进一步从量的方面认识化学。学情分析
本节内容是学生进入高中以来学习的第一部分元素化合物的知识,通过上一章的理论学习转到本章的元素化合物的学习,从认知程度上学生觉得学习起来更有兴趣。初中阶段所学的相关内容使学生已具备了必要的相关学习经验和知识,且本节中除钠外的铁、铝是生活中常见的金属,学生已有感性认识。通过本节学习学生将会对金属的化学性质有一个较系统的认识。教学思路
将本节内容定为三课时,第一课时 以钠为例介绍金属的有关性质,第二课时 铝、铁的有关性质,第三课时 物质的量在化学方程式计算中的应用。通过思考、实验、观察、分析、得出结论的方法进行探究式教学,注重培养学生探究、分析、推理和判断的能力,引导学生善于思索,与人合作,掌握知识的同时,提高化学素养。教学目标
知识与技能:掌握钠的化学性质;了解钠的物理性质及其保存方法。
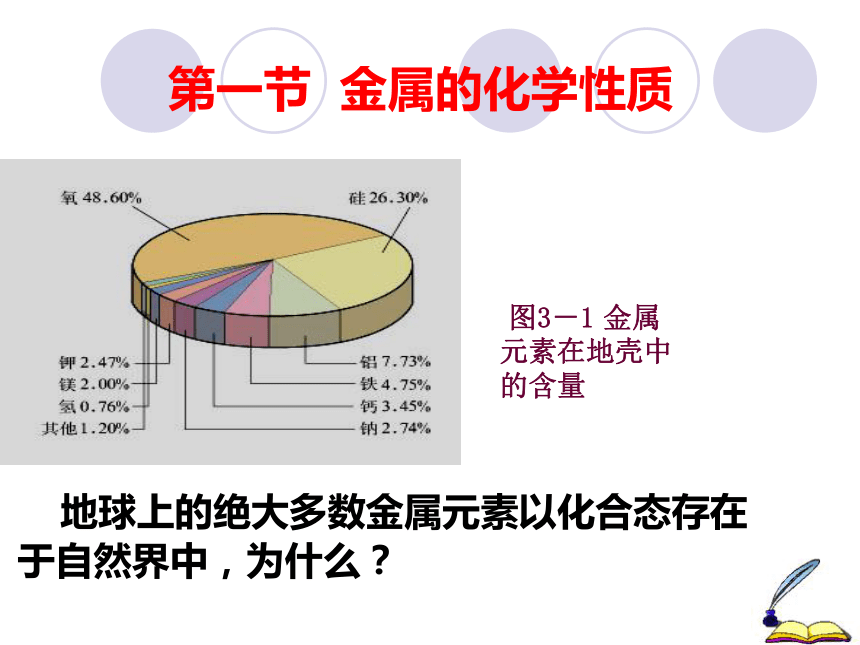
过程与方法:通过思考、实验、观察、分析、得出结论的方法进行探究式教学,培养探究、分析、推理和判断的能力。情感态度与价值观:通过多种活动培养学生的问题意识、探究意识和合作意识,激发学习化学的兴趣。教学过程请比较:金、银、铜哪种金属更贵重?第一节 金属的化学性质 地球上的绝大多数金属元素以化合态存在于自然界中,为什么? 图3-1 金属元素在地壳中的含量思考与交流1.人类已发现的元素中是金属元素多还是非金属元素多?
2.金属有哪些物理共性?
3.举例说明金属能发生哪些化学反应?
4.观察下列图片,分析反应,写出化学方程式。 金属的性质 1.与氧气反应 2.与酸反应 3.与某些盐溶液反应 结论
绝大多数的金属化学性质活泼,易与自然界中
的氧气,酸等反应,故绝大多数金属以化合态存在
于自然界中。一.金属钠与非金属的反应【实验探究Ⅰ】切割金属钠,观察钠表面的光泽和颜色变化。现象: 切口处可观察到银白色的金属光泽,在空气中很快变暗讨论:以上实验,体现了金属钠哪些物理和化学性质? 物理性质: 化学性质: 化学性质很活泼 ,常温下能与氧气反应.1.为银白色的固体2.质软(硬度小) 4Na + O2 === 2Na2O一.金属钠与非金属的反应【实验探究Ⅱ】把一小块金属钠放在坩埚上,加热,有何现象发生?现象 可观察到钠先熔化后燃烧,燃烧时火焰呈黄色,生成淡黄色的固体 2Na + O2 === Na2O2 加热一.金属钠与非金属的反应二.金属钠与水的反应 【实验探究Ⅲ】 将一小块金属钠投入滴有酚酞的水中学生描述现象及分析现象产生的原因 现 象 及 解 释浮游熔响红金属钠的密度小于水产生的气体推动金属钠来回游动反应放热,钠的熔点较低剧烈反应,产生气体有碱性物质生成 2Na + 2H2O == 2NaOH + H2总结:钠的物理性质和化学性质 物理性质:为银白色的固体,质软,密度比水还小(0.97g/cm3),熔点较低(97.87℃) 化学性质: 化学性质很活泼 1.与氧气反应4Na + O2 == 2Na2O2Na + O2 === Na2O2 点燃2.与水反应2Na + 2H2O == 2NaOH + H2思考: ①钠着火能否用水灭火?
②金属钠应如何保存?课堂练习:
1、列关于钠的叙述中,不正确的是( )
A.钠燃烧时发出黄色的火焰B.钠燃烧生成氧化钠
C.钠有很强的还原性
D.钠原子的最外层只有一个电子2、写出钠与氧气、水反应的化学方程式,是离子反应的还要写出离子方程式。 【课后作业】【拓展、探究】
1. 试分析钠在空气中久置所发生的变化现象?2.将钠投入到硫酸铜溶液中会有什么现象? 设计反思
通过这堂课的教学设计,我觉得新课程标准虽然对教师和学校的要求较高,但只要我们充分挖掘课本的资源、紧扣课程标准,立足课本,又不拘泥于课本,能灵活处理教材,紧密联系生活,采用多种教学方法,充分调动学生学习热情、让学生积极动脑动手,高质量实现新教材的理念是可以做到的。
第一课时株洲市一中 苏金华教材简析
本节“金属的化学性质”是在初中介绍的金属和金属材料的基础上,进一步加深和提高。金属种类主要选了“钠、铝、铁”,通过金属与非金属的反应,金属与酸和水的反应,及铝与氢氧化钠溶液的反应,对金属的化学性质较系统的作了阐述,学好这部分知识对以后学习元素周期律等有很大帮助。本节最后还安排了“物质的量在化学方程式计算中的应用”,引导学生进一步从量的方面认识化学。学情分析
本节内容是学生进入高中以来学习的第一部分元素化合物的知识,通过上一章的理论学习转到本章的元素化合物的学习,从认知程度上学生觉得学习起来更有兴趣。初中阶段所学的相关内容使学生已具备了必要的相关学习经验和知识,且本节中除钠外的铁、铝是生活中常见的金属,学生已有感性认识。通过本节学习学生将会对金属的化学性质有一个较系统的认识。教学思路
将本节内容定为三课时,第一课时 以钠为例介绍金属的有关性质,第二课时 铝、铁的有关性质,第三课时 物质的量在化学方程式计算中的应用。通过思考、实验、观察、分析、得出结论的方法进行探究式教学,注重培养学生探究、分析、推理和判断的能力,引导学生善于思索,与人合作,掌握知识的同时,提高化学素养。教学目标
知识与技能:掌握钠的化学性质;了解钠的物理性质及其保存方法。
过程与方法:通过思考、实验、观察、分析、得出结论的方法进行探究式教学,培养探究、分析、推理和判断的能力。情感态度与价值观:通过多种活动培养学生的问题意识、探究意识和合作意识,激发学习化学的兴趣。教学过程请比较:金、银、铜哪种金属更贵重?第一节 金属的化学性质 地球上的绝大多数金属元素以化合态存在于自然界中,为什么? 图3-1 金属元素在地壳中的含量思考与交流1.人类已发现的元素中是金属元素多还是非金属元素多?
2.金属有哪些物理共性?
3.举例说明金属能发生哪些化学反应?
4.观察下列图片,分析反应,写出化学方程式。 金属的性质 1.与氧气反应 2.与酸反应 3.与某些盐溶液反应 结论
绝大多数的金属化学性质活泼,易与自然界中
的氧气,酸等反应,故绝大多数金属以化合态存在
于自然界中。一.金属钠与非金属的反应【实验探究Ⅰ】切割金属钠,观察钠表面的光泽和颜色变化。现象: 切口处可观察到银白色的金属光泽,在空气中很快变暗讨论:以上实验,体现了金属钠哪些物理和化学性质? 物理性质: 化学性质: 化学性质很活泼 ,常温下能与氧气反应.1.为银白色的固体2.质软(硬度小) 4Na + O2 === 2Na2O一.金属钠与非金属的反应【实验探究Ⅱ】把一小块金属钠放在坩埚上,加热,有何现象发生?现象 可观察到钠先熔化后燃烧,燃烧时火焰呈黄色,生成淡黄色的固体 2Na + O2 === Na2O2 加热一.金属钠与非金属的反应二.金属钠与水的反应 【实验探究Ⅲ】 将一小块金属钠投入滴有酚酞的水中学生描述现象及分析现象产生的原因 现 象 及 解 释浮游熔响红金属钠的密度小于水产生的气体推动金属钠来回游动反应放热,钠的熔点较低剧烈反应,产生气体有碱性物质生成 2Na + 2H2O == 2NaOH + H2总结:钠的物理性质和化学性质 物理性质:为银白色的固体,质软,密度比水还小(0.97g/cm3),熔点较低(97.87℃) 化学性质: 化学性质很活泼 1.与氧气反应4Na + O2 == 2Na2O2Na + O2 === Na2O2 点燃2.与水反应2Na + 2H2O == 2NaOH + H2思考: ①钠着火能否用水灭火?
②金属钠应如何保存?课堂练习:
1、列关于钠的叙述中,不正确的是( )
A.钠燃烧时发出黄色的火焰B.钠燃烧生成氧化钠
C.钠有很强的还原性
D.钠原子的最外层只有一个电子2、写出钠与氧气、水反应的化学方程式,是离子反应的还要写出离子方程式。 【课后作业】【拓展、探究】
1. 试分析钠在空气中久置所发生的变化现象?2.将钠投入到硫酸铜溶液中会有什么现象? 设计反思
通过这堂课的教学设计,我觉得新课程标准虽然对教师和学校的要求较高,但只要我们充分挖掘课本的资源、紧扣课程标准,立足课本,又不拘泥于课本,能灵活处理教材,紧密联系生活,采用多种教学方法,充分调动学生学习热情、让学生积极动脑动手,高质量实现新教材的理念是可以做到的。
