第三节化学平衡之平衡常数(余敬忠)
文档属性
| 名称 | 第三节化学平衡之平衡常数(余敬忠) |  | |
| 格式 | rar | ||
| 文件大小 | 6.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2010-07-12 20:47:00 | ||
图片预览








文档简介
课件40张PPT。第三节(第2课时)
化学平衡常数(Equilibrium constant)人教版高中新课程选修4《化学反应原理》第二章《化学反应速率与化学平衡》长沙市第一中学 余敬忠(yujz2118@163.com)课时分析与安排人教版化学选修4《化学反应原理》
第二章《化学反应速率与化学平衡》第一节化学反应速率;(一课时)
第二节影响化学反应速率的因素;(一课时)
第三节化学平衡;(两课时)
第四节化学反应进行的方向;(一课时)
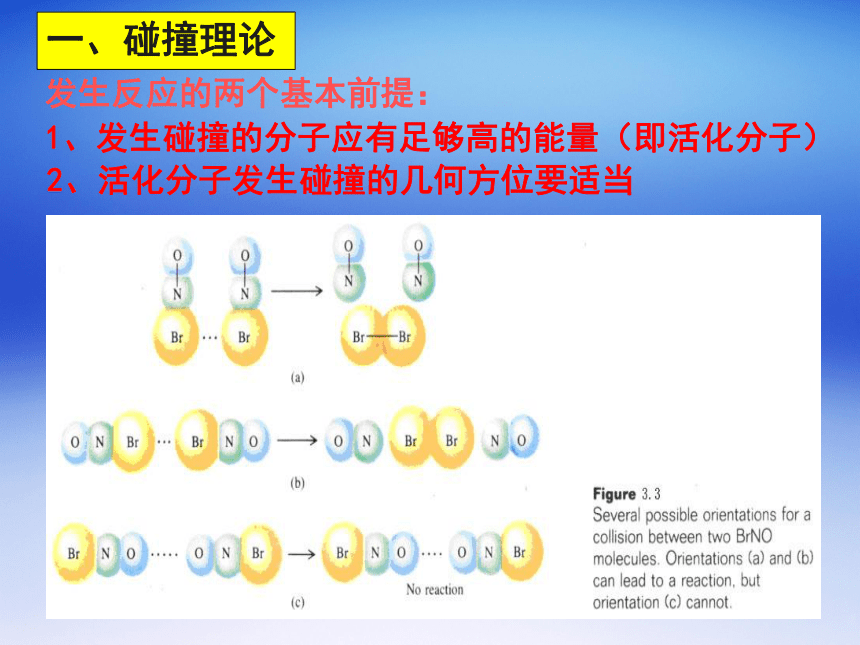
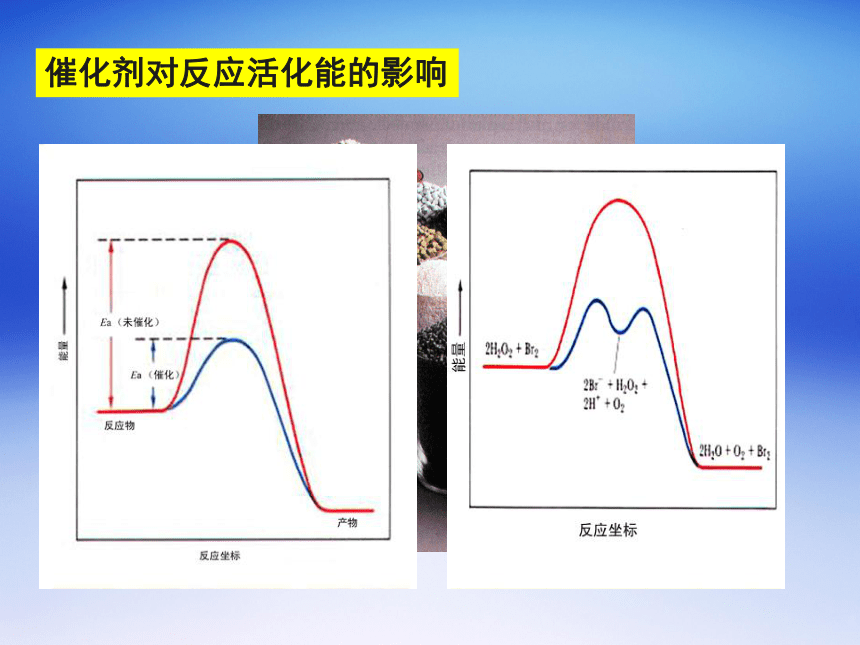
归纳与总结;(一课时)一、新课知识背景说明新课知识背景说明新课知识背景说明新课知识背景说明新课知识背景说明发生反应的两个基本前提:1、发生碰撞的分子应有足够高的能量(即活化分子)2、活化分子发生碰撞的几何方位要适当一、碰撞理论例如:反应化学反应过程中能量变化曲线及活化能二、影响化学反应速率的因素浓度影响:当温度一定,某反应的活化能也一定时, 浓度增大, 分子总数增加,活化分子数随之增多,反应速率增大。温度影响:当浓度一定,温度升高,活化分子分数增多, 反应速率增大。催化剂对反应活化能的影响三、化学平衡状态 (chemical equilibrium state ) 化学平衡状态的建立化学平衡状态的移动旧的平衡破坏了,又会建立起新的平衡. 如果改变维持化学平衡的
条件(浓度、压力和温度),平衡就会向着减弱这种改变的方向移动.
Le Chatelier原理适用于处于平衡状态的体系,也适用于相平衡体系. 1848年,法国著名科学家
Le Chatelier 提出:勒沙特列(Le Chatelier )原理勒沙特列
(Le Chatelier H,1850-1936)
法国无机化学家
巴黎大学教授.1、并不是改变任何条件,化学平衡都会移动,而只有改变维持平衡的条件,平衡才会移动。
2、勒沙特列原理指明的只是平衡移动的方向。
3、Le Chatelier原理只是说的是热力学的自发趋势,是一种可能性。
4、勒沙特列原理不能首先判断体系是否处于平衡状态,不能进行定量计算。注意:正确使用勒沙特列(Le Chatelier )原理对于一般的化学反应: α,β—反应级数:若α=1,A为一级反应; β=2,B为二级反应,则α+β=3,总反应级数为3。α,β必须通过实验确定其值,可以为正整数,负整数或分数。通常α≠a,β≠b。
k —反应速率系数:零级反应 mol·L-1 ·s-1; 一级反应 s-1;二级反应 (mol·L -1)-1 ·s-1; k 不随浓度而变,但受温度的影响,通常温度升高, k 增大。一、化学动力学部分知识支撑(The Basis of Chemical Dynamics) 该式称为反应速率方程或质量作用定律(mass action law) 1、质量作用定律:Arrhenius方程:A—指前参量,又叫指前因子
Ea—实验活化能,单位为kJ·mol-1。2、反应速率与温度的关系(The Relationship of Rates and Temperature) 两式相减,整理得到:Arrhenius方程式的应用二、化学热力学部分(The Basis of Chemical Thermodynamics) 1、范特霍夫( Van’t Hoff)等温方程,即非标准状态下的自由能变化(ΔG)(自由焓变)计算式: 反应的等温式:浓度商:对于稀溶液中进行的反应: Van’t Hoff 方程的另一表达式:改变浓度或压力能使平衡点改变。温度的变化,却可以导致平衡常数数值的改变。温度对化学平衡的影响可以归纳如下:升高温度,使平衡向吸热方向移动;降低温度,使平衡向放热方向移动。2、标准平衡常数(standard equilibrium constant)● 当反应达到平衡状态时?rGm ?(T)负值越大,则K?值越大,正反应进行的程度越大;若?rGm ?(T)正值越大,则K?值越小,正反应进行的程度越小。
在一定的温度(T)时,上式中?rGm ?(T) 、R和T都是定值,即K?是一个常数,称为标准平衡常数;将任意给定态时物质的Qc或Qp与K?进行比较,可用来判断反应自发进行的方向:
若Qc或Qp< K?,则?rGm <0,反应正向自发进行
若Qc或Qp= K?,则?rGm=0,反应处于平衡
若Qc或Qp> K?,则?rGm >0,反应逆向自发进行Kθ 是无量纲的量;
Kθ 是温度的函数,与浓度、分压无关;
标准平衡常数表达式必须与化学反应计量式相对应;
pθ是标态压力,p是各气体的分压;
Cθ是标态浓度,C是溶液中各物质浓度;
纯物质(包括纯固体或纯液体)不写在平衡常数表达式中!3、化学平衡常数的表达式
(The general equilibrium equation) 本节内容教材展示【例1】向20mL6.8mol·L-1的CaCl2溶液中加入1.0mol·L-1的Na2SO4溶液至不再产生沉淀为止,静置,将浊液过滤,向滤液中加入1.0mol·L-1的Na2CO3溶液,发现仍产生了白色沉淀,继续加入Na2CO3溶液直至过量,最后将所得沉淀过滤、烘干并称重得沉淀质量为5.44g。
(1)试解释以上现象产生的原因;
(2)此实验中CaCl2在第一步实验中的转化率为多少? 【提问】
1、原料的利用率与可逆反应正向反应的进行程度之间有何关系?
2、在工业生产中常采取何种措施提高价格较高原料的转化率,以降低生产的成本?
3、平衡体系可能用转化率进行描述,但很不方便(各不相同),是否可以建立其他更方便的描述形式呢? 【例3】下表是 500oC时的合成氨反应达到平衡后所测得的一组数据,试填出表中空白处的数据:再次“兵棋推演”,是否仍有以上规律:师生一起分析教材表格数据:457.6℃时,以上反应体系中各物质的浓度的有关数据:K只是温度的函数,与反应物或生成物的浓度或分压无关;
平衡常数表达式必须与化学反应计量式相对应;
c是反应达到平衡时各物质对应的平衡浓度,单位为mol·L-1;
纯物质(包括纯固体或纯液体)不写在平衡常数表达式中!1、化学平衡常数的表达式
(The general equilibrium equation) 2、书写的平衡常数表达式应注意的几个问题 K = c(CO2) 在应用平衡常数表达式时,稀溶液中的水分子浓度可不写,水的浓度是一个常数,此常数可归并到平衡常数中去 。例如:对于非水溶液中的反应,水的浓度要写入平衡表达式中,例如: 当反应中有固体物质参加时,固体的“浓度”常作为常数归并入平衡常数表达式中,例如:K = c4(H2O)/ c4(H2)【例4】实验测得氯气溶于水后约有三分之一的Cl2发生歧化转化为盐酸和次氯酸,求该反应的平衡常数。293K下氯气在水中的溶解度为0.09mol·L-1。 起始/mol·L-1 0.09 0 0 0
平衡/mol·L-1 0.09-x x x xx=1/3×0.09=0.03mol·L-1K愈大,反应进行得愈完全,反应物的转化率越大;当K值不太大也不太小(如 10-3< K <103)时,反应物部分地转化为生成物,也就是我们常说的“可逆反应”。K愈小,反应进行得愈不完全,反应物的转化率越小;一般地说,K >105时,常认为该反应基本完全进行;值得广大教师注意的是选修4中的化学平衡常数还仅仅只是一种平衡常数的初级形式,即涉及到的反应对象要么全为气态,要么全为溶液态,至于混合态的情况,我们暂不要求学生了解,因此也就不需要讲解,但老师自己要清楚!3、平衡常数的意义只要知道一定温度下某一反应的平衡常数,并且知道反应物及生成物的浓度,就能判断该反应是处于平衡状态,还是向某一方向进行。已转化掉的 [CO]为0.015mol ·dm-3,所以CO此时的转化率为:二、反应商 (reaction quotient)【设问】反应商有什么样的作用呢?Q称为反应商 (reaction quotient)Q < K时:反应正向进行
Q = K时:体系处于平衡状态
Q > K时:反应逆向进行反应商 (reaction quotient)Q可作为反应进行方向的判据.对于(1):Q = 2.25 = K,所以反应正好处于平衡状态;对于(2):Q = 2.09 < K,所以反应正向进行;对于(3):Q = 2.25 = K,所以反应正好处于平衡状态;对于(4):Q = 3.03 > K,所以反应逆向进行;平衡因浓度的改变而被破坏时,Q发生变化:1、浓度变化对化学平衡的影响 改变浓度将使平衡移动,增加一种反应物的浓度,可使另一种反应物的转化率提高。 这是工业上一项重要措施。 根据气体状态方程,可知温度恒定时将体系总压扩大两倍时,各对应物质的浓度均扩大为原来的两倍;解:设原平衡时各物质的浓度分别为:c(NH3)、c(H2)和c(N2),对应温度时的平衡常数为K,于是有:【结论】压强变化的影响可以归结为浓度变化的影响。2、压强变化对化学平衡的影响 谢谢!
化学平衡常数(Equilibrium constant)人教版高中新课程选修4《化学反应原理》第二章《化学反应速率与化学平衡》长沙市第一中学 余敬忠(yujz2118@163.com)课时分析与安排人教版化学选修4《化学反应原理》
第二章《化学反应速率与化学平衡》第一节化学反应速率;(一课时)
第二节影响化学反应速率的因素;(一课时)
第三节化学平衡;(两课时)
第四节化学反应进行的方向;(一课时)
归纳与总结;(一课时)一、新课知识背景说明新课知识背景说明新课知识背景说明新课知识背景说明新课知识背景说明发生反应的两个基本前提:1、发生碰撞的分子应有足够高的能量(即活化分子)2、活化分子发生碰撞的几何方位要适当一、碰撞理论例如:反应化学反应过程中能量变化曲线及活化能二、影响化学反应速率的因素浓度影响:当温度一定,某反应的活化能也一定时, 浓度增大, 分子总数增加,活化分子数随之增多,反应速率增大。温度影响:当浓度一定,温度升高,活化分子分数增多, 反应速率增大。催化剂对反应活化能的影响三、化学平衡状态 (chemical equilibrium state ) 化学平衡状态的建立化学平衡状态的移动旧的平衡破坏了,又会建立起新的平衡. 如果改变维持化学平衡的
条件(浓度、压力和温度),平衡就会向着减弱这种改变的方向移动.
Le Chatelier原理适用于处于平衡状态的体系,也适用于相平衡体系. 1848年,法国著名科学家
Le Chatelier 提出:勒沙特列(Le Chatelier )原理勒沙特列
(Le Chatelier H,1850-1936)
法国无机化学家
巴黎大学教授.1、并不是改变任何条件,化学平衡都会移动,而只有改变维持平衡的条件,平衡才会移动。
2、勒沙特列原理指明的只是平衡移动的方向。
3、Le Chatelier原理只是说的是热力学的自发趋势,是一种可能性。
4、勒沙特列原理不能首先判断体系是否处于平衡状态,不能进行定量计算。注意:正确使用勒沙特列(Le Chatelier )原理对于一般的化学反应: α,β—反应级数:若α=1,A为一级反应; β=2,B为二级反应,则α+β=3,总反应级数为3。α,β必须通过实验确定其值,可以为正整数,负整数或分数。通常α≠a,β≠b。
k —反应速率系数:零级反应 mol·L-1 ·s-1; 一级反应 s-1;二级反应 (mol·L -1)-1 ·s-1; k 不随浓度而变,但受温度的影响,通常温度升高, k 增大。一、化学动力学部分知识支撑(The Basis of Chemical Dynamics) 该式称为反应速率方程或质量作用定律(mass action law) 1、质量作用定律:Arrhenius方程:A—指前参量,又叫指前因子
Ea—实验活化能,单位为kJ·mol-1。2、反应速率与温度的关系(The Relationship of Rates and Temperature) 两式相减,整理得到:Arrhenius方程式的应用二、化学热力学部分(The Basis of Chemical Thermodynamics) 1、范特霍夫( Van’t Hoff)等温方程,即非标准状态下的自由能变化(ΔG)(自由焓变)计算式: 反应的等温式:浓度商:对于稀溶液中进行的反应: Van’t Hoff 方程的另一表达式:改变浓度或压力能使平衡点改变。温度的变化,却可以导致平衡常数数值的改变。温度对化学平衡的影响可以归纳如下:升高温度,使平衡向吸热方向移动;降低温度,使平衡向放热方向移动。2、标准平衡常数(standard equilibrium constant)● 当反应达到平衡状态时?rGm ?(T)负值越大,则K?值越大,正反应进行的程度越大;若?rGm ?(T)正值越大,则K?值越小,正反应进行的程度越小。
在一定的温度(T)时,上式中?rGm ?(T) 、R和T都是定值,即K?是一个常数,称为标准平衡常数;将任意给定态时物质的Qc或Qp与K?进行比较,可用来判断反应自发进行的方向:
若Qc或Qp< K?,则?rGm <0,反应正向自发进行
若Qc或Qp= K?,则?rGm=0,反应处于平衡
若Qc或Qp> K?,则?rGm >0,反应逆向自发进行Kθ 是无量纲的量;
Kθ 是温度的函数,与浓度、分压无关;
标准平衡常数表达式必须与化学反应计量式相对应;
pθ是标态压力,p是各气体的分压;
Cθ是标态浓度,C是溶液中各物质浓度;
纯物质(包括纯固体或纯液体)不写在平衡常数表达式中!3、化学平衡常数的表达式
(The general equilibrium equation) 本节内容教材展示【例1】向20mL6.8mol·L-1的CaCl2溶液中加入1.0mol·L-1的Na2SO4溶液至不再产生沉淀为止,静置,将浊液过滤,向滤液中加入1.0mol·L-1的Na2CO3溶液,发现仍产生了白色沉淀,继续加入Na2CO3溶液直至过量,最后将所得沉淀过滤、烘干并称重得沉淀质量为5.44g。
(1)试解释以上现象产生的原因;
(2)此实验中CaCl2在第一步实验中的转化率为多少? 【提问】
1、原料的利用率与可逆反应正向反应的进行程度之间有何关系?
2、在工业生产中常采取何种措施提高价格较高原料的转化率,以降低生产的成本?
3、平衡体系可能用转化率进行描述,但很不方便(各不相同),是否可以建立其他更方便的描述形式呢? 【例3】下表是 500oC时的合成氨反应达到平衡后所测得的一组数据,试填出表中空白处的数据:再次“兵棋推演”,是否仍有以上规律:师生一起分析教材表格数据:457.6℃时,以上反应体系中各物质的浓度的有关数据:K只是温度的函数,与反应物或生成物的浓度或分压无关;
平衡常数表达式必须与化学反应计量式相对应;
c是反应达到平衡时各物质对应的平衡浓度,单位为mol·L-1;
纯物质(包括纯固体或纯液体)不写在平衡常数表达式中!1、化学平衡常数的表达式
(The general equilibrium equation) 2、书写的平衡常数表达式应注意的几个问题 K = c(CO2) 在应用平衡常数表达式时,稀溶液中的水分子浓度可不写,水的浓度是一个常数,此常数可归并到平衡常数中去 。例如:对于非水溶液中的反应,水的浓度要写入平衡表达式中,例如: 当反应中有固体物质参加时,固体的“浓度”常作为常数归并入平衡常数表达式中,例如:K = c4(H2O)/ c4(H2)【例4】实验测得氯气溶于水后约有三分之一的Cl2发生歧化转化为盐酸和次氯酸,求该反应的平衡常数。293K下氯气在水中的溶解度为0.09mol·L-1。 起始/mol·L-1 0.09 0 0 0
平衡/mol·L-1 0.09-x x x xx=1/3×0.09=0.03mol·L-1K愈大,反应进行得愈完全,反应物的转化率越大;当K值不太大也不太小(如 10-3< K <103)时,反应物部分地转化为生成物,也就是我们常说的“可逆反应”。K愈小,反应进行得愈不完全,反应物的转化率越小;一般地说,K >105时,常认为该反应基本完全进行;值得广大教师注意的是选修4中的化学平衡常数还仅仅只是一种平衡常数的初级形式,即涉及到的反应对象要么全为气态,要么全为溶液态,至于混合态的情况,我们暂不要求学生了解,因此也就不需要讲解,但老师自己要清楚!3、平衡常数的意义只要知道一定温度下某一反应的平衡常数,并且知道反应物及生成物的浓度,就能判断该反应是处于平衡状态,还是向某一方向进行。已转化掉的 [CO]为0.015mol ·dm-3,所以CO此时的转化率为:二、反应商 (reaction quotient)【设问】反应商有什么样的作用呢?Q称为反应商 (reaction quotient)Q < K时:反应正向进行
Q = K时:体系处于平衡状态
Q > K时:反应逆向进行反应商 (reaction quotient)Q可作为反应进行方向的判据.对于(1):Q = 2.25 = K,所以反应正好处于平衡状态;对于(2):Q = 2.09 < K,所以反应正向进行;对于(3):Q = 2.25 = K,所以反应正好处于平衡状态;对于(4):Q = 3.03 > K,所以反应逆向进行;平衡因浓度的改变而被破坏时,Q发生变化:1、浓度变化对化学平衡的影响 改变浓度将使平衡移动,增加一种反应物的浓度,可使另一种反应物的转化率提高。 这是工业上一项重要措施。 根据气体状态方程,可知温度恒定时将体系总压扩大两倍时,各对应物质的浓度均扩大为原来的两倍;解:设原平衡时各物质的浓度分别为:c(NH3)、c(H2)和c(N2),对应温度时的平衡常数为K,于是有:【结论】压强变化的影响可以归结为浓度变化的影响。2、压强变化对化学平衡的影响 谢谢!
