专题2第三单元等效平衡的判断
图片预览






文档简介
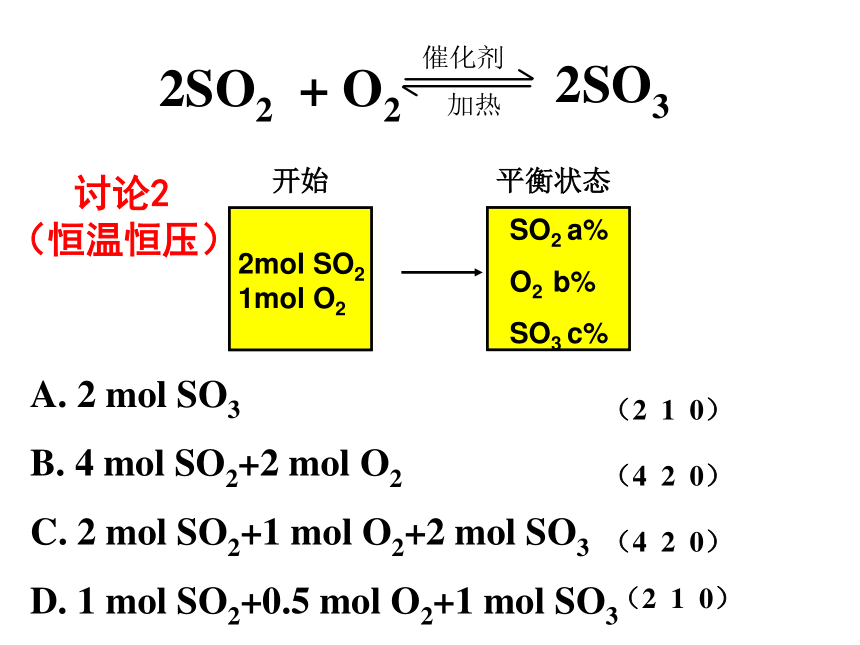
课件25张PPT。第三单元 化学平衡(第四课时:等效平衡)南靖一中 沈建忠在一定条件下(定温、定容或定温、定压),同一可逆反应可以从不同途径建立相同平衡,这些平衡互称为等效平衡。 讨论1(恒温恒容) A. 2 mol SO3 B. 4 mol SO2+2 mol O2(2 1 0)(4 2 0)恒温恒容 讨论1(恒温恒容)D. 1 mol SO2+0.5 mol O2+1 mol SO3(A、D) A. 2 mol SO3 B. 4 mol SO2+2 mol O2C. 2 mol SO2+1 mol O2+2 mol SO3 (2 1 0)(4 2 0)(4 2 0)(2 1 0) 讨论2(恒温恒压)A. 2 mol SO3
B. 4 mol SO2+2 mol O2
C. 2 mol SO2+1 mol O2+2 mol SO3
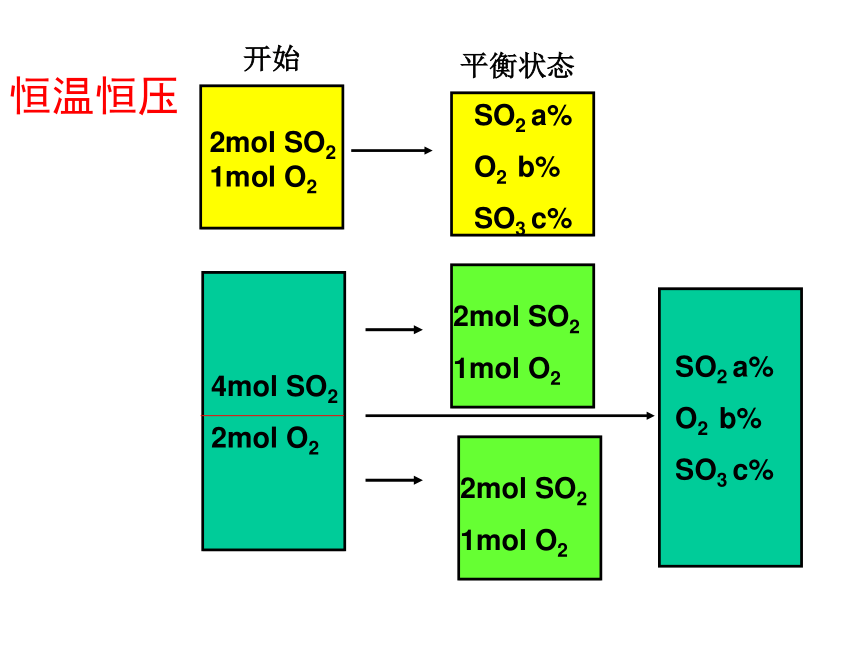
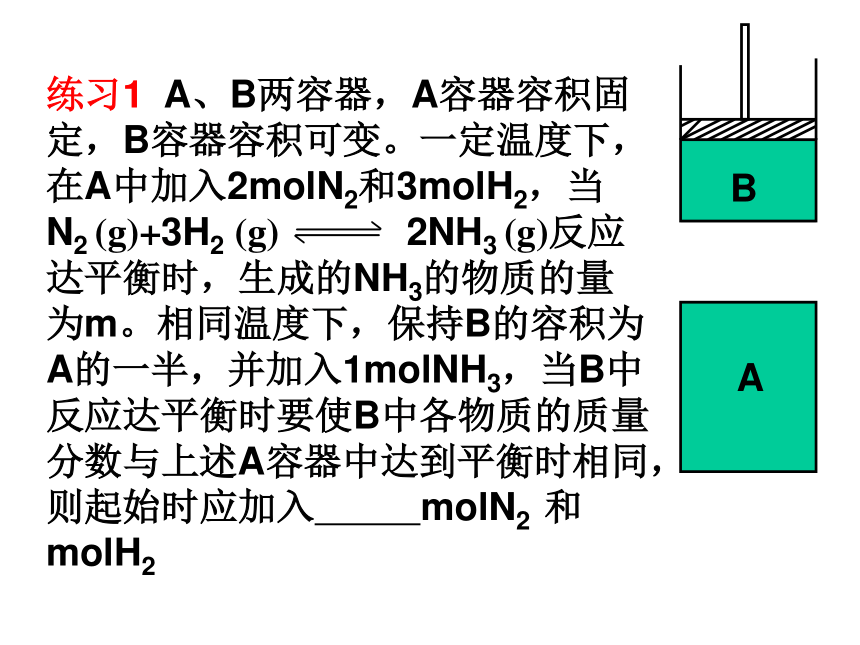
D. 1 mol SO2+0.5 mol O2+1 mol SO3恒温恒压对于反应前后气体分子数有变化的可逆反应:恒温恒容——进行等效转化后,投料量与原平衡起始量对应物质完全相同,则两平衡等效。恒温恒压——进行等效转化后,投料量与原平衡起始量对应物质成比例,则两平衡等效。练习1 A、B两容器,A容器容积固定,B容器容积可变。一定温度下,在A中加入2molN2和3molH2,当 N2 (g)+3H2 (g) 2NH3 (g)反应达平衡时,生成的NH3的物质的量为m。相同温度下,保持B的容积为A的一半,并加入1molNH3,当B中反应达平衡时要使B中各物质的质量分数与上述A容器中达到平衡时相同,则起始时应加入 molN2 和 molH2AB2molN2
3molH21molN2
1.5molH2AB 1 1.5X==0.5 Y==0 讨论3(恒温恒容)A. 2 mol HI
B. 2 mol H2+2 mol I2
C. 1 mol H2+1 mol I2+2 mol HI
D. 0.5 mol H2+0.5 mol I2+1 mol HI(1 1 0)(2 2 0)(2 2 0)(1 1 0)恒温恒容 讨论3(恒温恒容)A. 2 mol HI
B. 2 mol H2+2 mol I2
C. 1 mol H2+1 mol I2+2 mol HI
D. 0.5 mol H2+0.5 mol I2+1 mol HI(1 1 0)(2 2 0)(2 2 0)(1 1 0)A B C D对于反应前后气体分子数不变的可逆反应:恒温恒容、恒温恒压——进行等效转化后,投料量与原平衡起始量对应物质成比例,则两平衡等效。恒温恒压呢?
ADD(6 2 0 0)
(3 1 2 0)
(3 2 0 0)
(3 1 0 0)练习3 恒温恒压下,在一个可变容积的容器中发生如下反应: A(g) + B(g) C(g)
若开始时放入1molA和1molB,达到平衡后,生成amolC。
(1)若开始时放入3molA和3molB,到达平衡后,生成C的物质的量为 mol
(2)若开始时放入xmolA、2molB和1molC,到达平衡后,C的物质的量是3amol,x= mol.
(3)若在(2)的平衡混合物中再加入3molC,待再次到达平衡后,C的物质的量是 mol.
3a26an(A)=1
n(B)=1n(A)=1-a
n(B)=1-a
n(C)=a
起始'平衡'n(A)=3
n(B)=3n(A)=3-3a
n(B)=3-3a
n(C)=3a
等温(T)
等压(p)起始平衡恒温恒压恒温恒容等效平衡特征:任何相同组分的百分含量相同。等效平衡的情况小结:1、反应前后气体分子数不等的可逆反应
恒温恒容时,等效平衡间相同物质的物质的量、浓度和百分含量一定相同;恒温恒压时,浓度和百分含量一定相同。2、反应前后气体分子数相等的可逆反应
恒温恒容时,等效平衡间相同物质百分含量一定相同;恒温恒压时,浓度和百分含量一定相同。(C)C 若是恒温恒压呢?( )B2SO2(g)+O2(g) 2SO3(g)起始(mol): a SO2,b O2 ,c SO32SO2(g)+O2(g) 2SO3(g) 2 1 0恒温恒压讨论4
B. 4 mol SO2+2 mol O2
C. 2 mol SO2+1 mol O2+2 mol SO3
D. 1 mol SO2+0.5 mol O2+1 mol SO3恒温恒压对于反应前后气体分子数有变化的可逆反应:恒温恒容——进行等效转化后,投料量与原平衡起始量对应物质完全相同,则两平衡等效。恒温恒压——进行等效转化后,投料量与原平衡起始量对应物质成比例,则两平衡等效。练习1 A、B两容器,A容器容积固定,B容器容积可变。一定温度下,在A中加入2molN2和3molH2,当 N2 (g)+3H2 (g) 2NH3 (g)反应达平衡时,生成的NH3的物质的量为m。相同温度下,保持B的容积为A的一半,并加入1molNH3,当B中反应达平衡时要使B中各物质的质量分数与上述A容器中达到平衡时相同,则起始时应加入 molN2 和 molH2AB2molN2
3molH21molN2
1.5molH2AB 1 1.5X==0.5 Y==0 讨论3(恒温恒容)A. 2 mol HI
B. 2 mol H2+2 mol I2
C. 1 mol H2+1 mol I2+2 mol HI
D. 0.5 mol H2+0.5 mol I2+1 mol HI(1 1 0)(2 2 0)(2 2 0)(1 1 0)恒温恒容 讨论3(恒温恒容)A. 2 mol HI
B. 2 mol H2+2 mol I2
C. 1 mol H2+1 mol I2+2 mol HI
D. 0.5 mol H2+0.5 mol I2+1 mol HI(1 1 0)(2 2 0)(2 2 0)(1 1 0)A B C D对于反应前后气体分子数不变的可逆反应:恒温恒容、恒温恒压——进行等效转化后,投料量与原平衡起始量对应物质成比例,则两平衡等效。恒温恒压呢?
ADD(6 2 0 0)
(3 1 2 0)
(3 2 0 0)
(3 1 0 0)练习3 恒温恒压下,在一个可变容积的容器中发生如下反应: A(g) + B(g) C(g)
若开始时放入1molA和1molB,达到平衡后,生成amolC。
(1)若开始时放入3molA和3molB,到达平衡后,生成C的物质的量为 mol
(2)若开始时放入xmolA、2molB和1molC,到达平衡后,C的物质的量是3amol,x= mol.
(3)若在(2)的平衡混合物中再加入3molC,待再次到达平衡后,C的物质的量是 mol.
3a26an(A)=1
n(B)=1n(A)=1-a
n(B)=1-a
n(C)=a
起始'平衡'n(A)=3
n(B)=3n(A)=3-3a
n(B)=3-3a
n(C)=3a
等温(T)
等压(p)起始平衡恒温恒压恒温恒容等效平衡特征:任何相同组分的百分含量相同。等效平衡的情况小结:1、反应前后气体分子数不等的可逆反应
恒温恒容时,等效平衡间相同物质的物质的量、浓度和百分含量一定相同;恒温恒压时,浓度和百分含量一定相同。2、反应前后气体分子数相等的可逆反应
恒温恒容时,等效平衡间相同物质百分含量一定相同;恒温恒压时,浓度和百分含量一定相同。(C)C 若是恒温恒压呢?( )B2SO2(g)+O2(g) 2SO3(g)起始(mol): a SO2,b O2 ,c SO32SO2(g)+O2(g) 2SO3(g) 2 1 0恒温恒压讨论4
