专题2第一单元化学反应速率第2课时
图片预览









文档简介
课件39张PPT。第一单元 化学反应速率(第二课时:影响化学反应速率的因素)南靖一中 沈建忠课程目标:
1、理解浓度、压强、温度和催化剂等因素对化学反应的影响,认识其一般规律。
2、知道活化分子、活化能、有效碰撞等概念,能用碰撞理论解释外界条件对化学反应速率的影响。
3、认识催化剂在生产和科学研究领域中的重大作用。
4、初步学会实验数据的记录与处理。3、单位:mol/(L·min)或mol/(L·s)
4、速率之比=方程式中计量数之比2、数学表达式为:5、测定方法:比色法、量气法知识回顾
1、化学反应速率定义思考?影响化学反应速率的因素有哪些?四、影响化学反应速率的因素 内因:反应物的性质不同化学反应反应物性质同一化学反应反应的条件外因: 浓度、温度、压强、催化剂等(一)、浓度对化学反应速率的影响完成课本P.35活动与探究实验,思考浓度对化学反应速率的影响。实验活动与探究一实验现象:[结论] 其他条件相同时,增大反应物的浓度,反应速率增大;减小反应物的浓度,反应速率减小注意:此规律只适用于气体或溶液的反应。(对于纯固体或纯液体的反应物,一般情况下其浓度是常数,因此改变它们的量不会改变化学反应速率。)反应速率理论——碰撞理论(阅读P36)
1、什么是有效碰撞?
2、什么是活化分子?
3、什么是活化能?
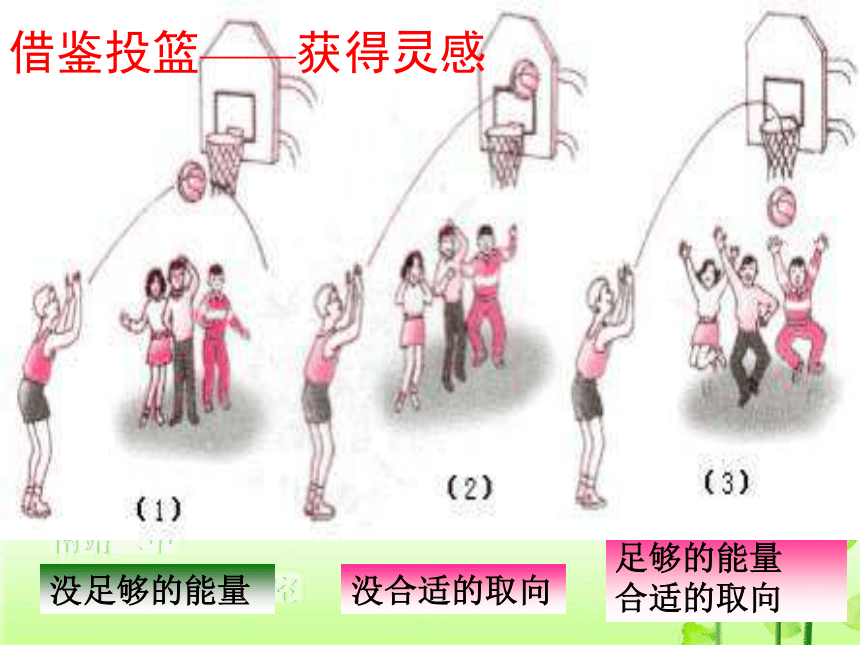
4、什么是活化分子百分数? 活化分子百分数= (活化分子数/反应物总分子数)×100%没合适的取向没足够的能量足够的能量
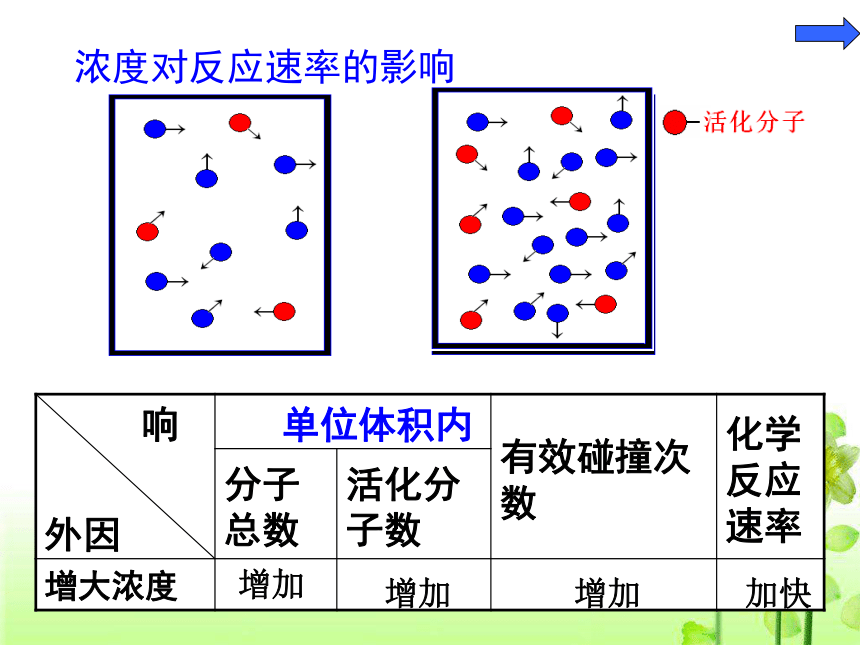
合适的取向借鉴投篮——获得灵感浓度对反应速率的影响增加增加增加加快用碰撞理论来解释浓度对化学反应速率的影响浓度增大单位体积内活化分子的数目增大
(分子总数增大,活化分子百分比不变)分子发生有效碰撞次数增多化学反应速率增大(二)、压强对化学反应速率的影响结论:对于有气体参加的反应,其它条件不变时,压强对化学反应速率影响的本质是:
浓度对化学反应速率的影响!增大压强,反应速率加快;减小压强,反应速率减慢。注意:a、压强影响,只适用于讨论有气体参加的反应,当然并不一定全部是气体参加的反应。 b、压强影响反应速率,必须伴随有压强改变时体积的改变现象。否则,压强的变化并没有作用到反应的体系上。即压强变则体积变,实际是浓度的变化。若容器的体积不变,因为各气体的浓度没有变,则速率不变。如在密闭容器中通入惰性气体。压强对反应速率的影响增加增加增加加快碰撞理论解释用碰撞理论来解释压强对化学反应速率的影响压强增大气体的体积缩小浓度增大有效碰撞次数增多单位体积内活化分子数目增多化学反应速率增大[讨论]恒容条件下,往合成氨的反应N2+3H2=2NH3中充入He气,体系的压强如何改变?反应速率是否改变?为什么?对于压强的改变,只有引起反应体系中物质浓度的变化,才对反应速率产生影响。N2 H2Ar取一个容积固定的密闭容器,充入Ar后,对v如何影响?总气压增大N2、H2浓度不变这种做法绝不是教材中所说“增压”范畴,(教材中的增压必须缩容)速率不变向容积可变的容器中充入惰性气体,分析速率变化情况实验活动与探究二P37页已知2KMnO4+5H2C2O4+3H2SO4==K2SO4+2MnSO4+8H2O+10CO2↑,取3支试管,向试管中分别加入
2mL 0.01mol·L-1酸性KMnO4溶液,再向试管中分别加入2mL 0. 1mol·L-1H2C2O4溶液。将其中一支试管放入冰水中,一支试管放入约80度的热水中,另一支试管置于室温下。(三)、温度对反应速率的影响KMnO4+ H2C2O4KMnO4+ H2C2O4热水水水实验现象:[结论] 其他条件相同时,升高温度,反应速率增大;
降低温度,反应速率减小经验规律:温度每升高10K,其反应速率增加2-4倍。 V‘ =2------------- Vt 2– t110特别提醒:
1、温度对反应速率的影响,无论是放热反应,还是吸热反应都适用。
2、温度对反应速率的影响,无论固体、液体、气体都适用。注意:
温度对反应速率的影响,无论对什么反应,什么物质都适用。温度对反应速率的影响不变增加增加加快碰撞理论解释用碰撞理论来解释温度对化学反应速率的影响升高温度活化分子百分数增加单位体积内活化分子数目增多有效碰撞次数增多反应速率加快实验活动与探究P38页其他条件相同时,使用催化剂,一般能加快化学反应速率 使用催化剂,能够成千上万倍的改变反应速率加FeCl3(四)、催化剂对化学反应速率的影响结论:催化剂可以大大改变化学反应的速率
正催化剂:能够加快反应速率的催化剂 负催化剂:能够减慢反应速率的催化剂。
如不特意说明,指正催化剂。不变增加加快增加用碰撞理论来解释催化剂对化学反应速率的影响正催化剂降低了反应活化能(即降低反应所需的能量)
分子只需具有较低的能量就能变成活化分子活化分子百分比增大、活化分子数增多化学反应速率加快有效碰撞次数增多生成物过渡状态反应物能量反应物能量有催化剂有催化剂生成物无催化剂能量反应物平均能量生成物平均能量能量使用催化剂活化分子能量(五)、其他因素:3、化学反应速率理论
——过渡态理论如光照、反应物固体的颗粒大小、电磁波、超声波、溶剂的性质等,也会对化学反应的速率产生影响。内因:物质本身的性质小结:影响化学反应速率的因素外因:浓度、压强、温度、催化剂、其它因素(主要因素)影响化学反应速率的因素 增大反应物的浓度使用催化剂增大压强升高温度_____反应速率加快增加增加增加加快增加增加增加加快不变增加加快影响化学反应速率的因素不变增加加快加快加快增加加快加快增加增加你知道吗? 将食品置于低温条件下,常常可以保存更长的时间。为什么? 你知道吗? 工业上用氮气与氢气反应合成氨时,常在高温、高压下进行,
并使用适当的催化剂。这些反应条件对于合成氨的反应速率
有什么影响? 你知道吗? 月饼,糕点等往往在包装盒内装入小包脱氧保鲜剂,这样做
有什么用? 你知道吗? 衣物上的油渍用普通洗衣粉很难洗去,但如果用加有酶
的洗衣粉,则较容易就能洗去。为什么? 影响化学反应速率的因素
1、理解浓度、压强、温度和催化剂等因素对化学反应的影响,认识其一般规律。
2、知道活化分子、活化能、有效碰撞等概念,能用碰撞理论解释外界条件对化学反应速率的影响。
3、认识催化剂在生产和科学研究领域中的重大作用。
4、初步学会实验数据的记录与处理。3、单位:mol/(L·min)或mol/(L·s)
4、速率之比=方程式中计量数之比2、数学表达式为:5、测定方法:比色法、量气法知识回顾
1、化学反应速率定义思考?影响化学反应速率的因素有哪些?四、影响化学反应速率的因素 内因:反应物的性质不同化学反应反应物性质同一化学反应反应的条件外因: 浓度、温度、压强、催化剂等(一)、浓度对化学反应速率的影响完成课本P.35活动与探究实验,思考浓度对化学反应速率的影响。实验活动与探究一实验现象:[结论] 其他条件相同时,增大反应物的浓度,反应速率增大;减小反应物的浓度,反应速率减小注意:此规律只适用于气体或溶液的反应。(对于纯固体或纯液体的反应物,一般情况下其浓度是常数,因此改变它们的量不会改变化学反应速率。)反应速率理论——碰撞理论(阅读P36)
1、什么是有效碰撞?
2、什么是活化分子?
3、什么是活化能?
4、什么是活化分子百分数? 活化分子百分数= (活化分子数/反应物总分子数)×100%没合适的取向没足够的能量足够的能量
合适的取向借鉴投篮——获得灵感浓度对反应速率的影响增加增加增加加快用碰撞理论来解释浓度对化学反应速率的影响浓度增大单位体积内活化分子的数目增大
(分子总数增大,活化分子百分比不变)分子发生有效碰撞次数增多化学反应速率增大(二)、压强对化学反应速率的影响结论:对于有气体参加的反应,其它条件不变时,压强对化学反应速率影响的本质是:
浓度对化学反应速率的影响!增大压强,反应速率加快;减小压强,反应速率减慢。注意:a、压强影响,只适用于讨论有气体参加的反应,当然并不一定全部是气体参加的反应。 b、压强影响反应速率,必须伴随有压强改变时体积的改变现象。否则,压强的变化并没有作用到反应的体系上。即压强变则体积变,实际是浓度的变化。若容器的体积不变,因为各气体的浓度没有变,则速率不变。如在密闭容器中通入惰性气体。压强对反应速率的影响增加增加增加加快碰撞理论解释用碰撞理论来解释压强对化学反应速率的影响压强增大气体的体积缩小浓度增大有效碰撞次数增多单位体积内活化分子数目增多化学反应速率增大[讨论]恒容条件下,往合成氨的反应N2+3H2=2NH3中充入He气,体系的压强如何改变?反应速率是否改变?为什么?对于压强的改变,只有引起反应体系中物质浓度的变化,才对反应速率产生影响。N2 H2Ar取一个容积固定的密闭容器,充入Ar后,对v如何影响?总气压增大N2、H2浓度不变这种做法绝不是教材中所说“增压”范畴,(教材中的增压必须缩容)速率不变向容积可变的容器中充入惰性气体,分析速率变化情况实验活动与探究二P37页已知2KMnO4+5H2C2O4+3H2SO4==K2SO4+2MnSO4+8H2O+10CO2↑,取3支试管,向试管中分别加入
2mL 0.01mol·L-1酸性KMnO4溶液,再向试管中分别加入2mL 0. 1mol·L-1H2C2O4溶液。将其中一支试管放入冰水中,一支试管放入约80度的热水中,另一支试管置于室温下。(三)、温度对反应速率的影响KMnO4+ H2C2O4KMnO4+ H2C2O4热水水水实验现象:[结论] 其他条件相同时,升高温度,反应速率增大;
降低温度,反应速率减小经验规律:温度每升高10K,其反应速率增加2-4倍。 V‘ =2------------- Vt 2– t110特别提醒:
1、温度对反应速率的影响,无论是放热反应,还是吸热反应都适用。
2、温度对反应速率的影响,无论固体、液体、气体都适用。注意:
温度对反应速率的影响,无论对什么反应,什么物质都适用。温度对反应速率的影响不变增加增加加快碰撞理论解释用碰撞理论来解释温度对化学反应速率的影响升高温度活化分子百分数增加单位体积内活化分子数目增多有效碰撞次数增多反应速率加快实验活动与探究P38页其他条件相同时,使用催化剂,一般能加快化学反应速率 使用催化剂,能够成千上万倍的改变反应速率加FeCl3(四)、催化剂对化学反应速率的影响结论:催化剂可以大大改变化学反应的速率
正催化剂:能够加快反应速率的催化剂 负催化剂:能够减慢反应速率的催化剂。
如不特意说明,指正催化剂。不变增加加快增加用碰撞理论来解释催化剂对化学反应速率的影响正催化剂降低了反应活化能(即降低反应所需的能量)
分子只需具有较低的能量就能变成活化分子活化分子百分比增大、活化分子数增多化学反应速率加快有效碰撞次数增多生成物过渡状态反应物能量反应物能量有催化剂有催化剂生成物无催化剂能量反应物平均能量生成物平均能量能量使用催化剂活化分子能量(五)、其他因素:3、化学反应速率理论
——过渡态理论如光照、反应物固体的颗粒大小、电磁波、超声波、溶剂的性质等,也会对化学反应的速率产生影响。内因:物质本身的性质小结:影响化学反应速率的因素外因:浓度、压强、温度、催化剂、其它因素(主要因素)影响化学反应速率的因素 增大反应物的浓度使用催化剂增大压强升高温度_____反应速率加快增加增加增加加快增加增加增加加快不变增加加快影响化学反应速率的因素不变增加加快加快加快增加加快加快增加增加你知道吗? 将食品置于低温条件下,常常可以保存更长的时间。为什么? 你知道吗? 工业上用氮气与氢气反应合成氨时,常在高温、高压下进行,
并使用适当的催化剂。这些反应条件对于合成氨的反应速率
有什么影响? 你知道吗? 月饼,糕点等往往在包装盒内装入小包脱氧保鲜剂,这样做
有什么用? 你知道吗? 衣物上的油渍用普通洗衣粉很难洗去,但如果用加有酶
的洗衣粉,则较容易就能洗去。为什么? 影响化学反应速率的因素
