专题1化学反应与能量变化第二单元化学能与电能的转化第3课时
文档属性
| 名称 | 专题1化学反应与能量变化第二单元化学能与电能的转化第3课时 |  | |
| 格式 | rar | ||
| 文件大小 | 1.8MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2010-07-12 21:18:00 | ||
图片预览









文档简介
课件46张PPT。第二单元 化学能与电能的转化(第三课时:电解池的工作原理)南靖一中 沈建忠1、原电池:把化学能转化为电能的装置。
2、原电池的正负极、电子流动方向、电流
流动方向、溶液中离子的移动方向、溶液
中的PH值;
3、燃料电池:正、负极;酸、碱性介质。知识回顾:四、电解池的工作原理及应用(一)、电解原理
1、电解的定义:在直流电的作用下,在两电极上分别发生氧化反应和还原反应的过程叫做电解。
2、电解池的定义:把电能转化为化学能的装置。3、电解池的构成条件(1)外接直流电源(2)与电源相连的两个电极
(3)电解质溶液或熔化的电解质 (4) 形成闭合回路4、电极名称:
阴极:与电源负极相连的电极 发生还原反应
阳极:与电源正极相连的电极 发生氧化反应5、阴阳极的材料:
阴极材料:活性电极(性质比较活泼的物质:
如Fe、Ag、Cu),也可用惰性电极(如:Ti、
Au、Pt、石墨)
阳极材料:(阳极应是还原性很弱的、易导电
的物质,否则阳极本身就要被氧化而溶解)故:
石墨、Ti、Au、Pt。6、实验探究电解原理
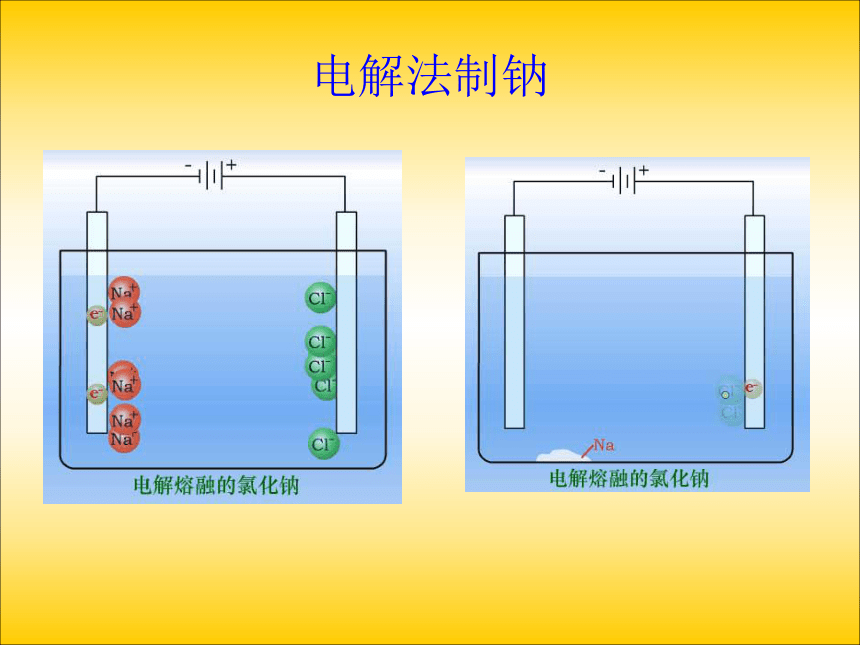
(1)、电解熔融的氯化钠请同学们阅读P18页:交流与讨论电解法制钠分析:通电前:分析熔融电解质中的离子情况
阳离子:
阴离子:
做无规则运动通电后:(直流电)
确定电极名称:
阳极(接电源正极)
阴极(接电源负极)
与电极材料无关
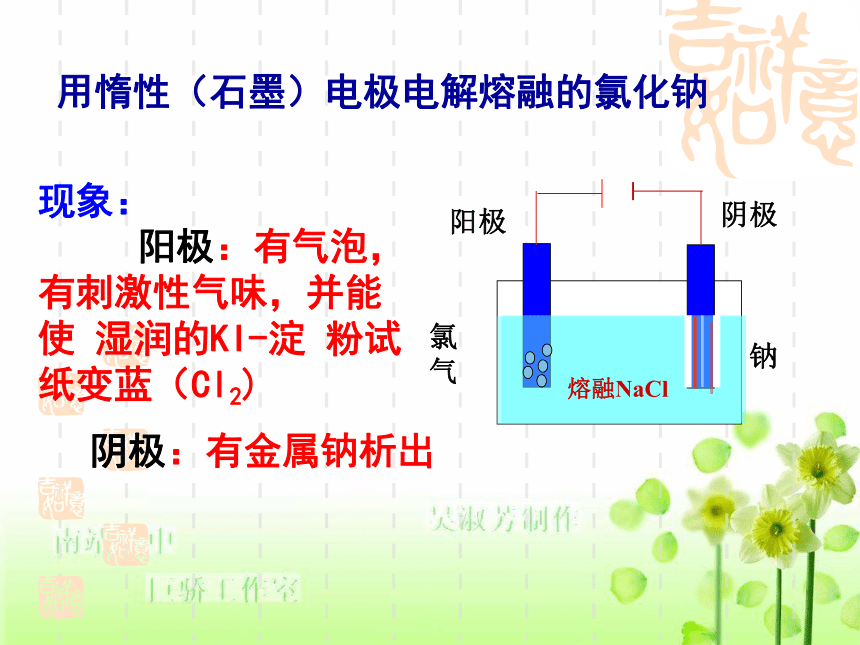
Na+Cl-用惰性(石墨)电极电解熔融的氯化钠现象:
阳极:有气泡,有刺激性气味,并能使 湿润的KI-淀 粉试纸变蓝(Cl2) 阴极:有金属钠析出阴极阳极氯
气钠熔融NaCl 通电前, Na+ Cl- 在 __________运动。
通电后, Na+向__ 极(与电源____相连)移动,Cl-向___极(与电源____相连)移动。
电子从电源负极流向_________极,电极反应为__________,发生_______反应。
电子从电解池阳极流向_______极,电极反应为__________,发生_______反应。
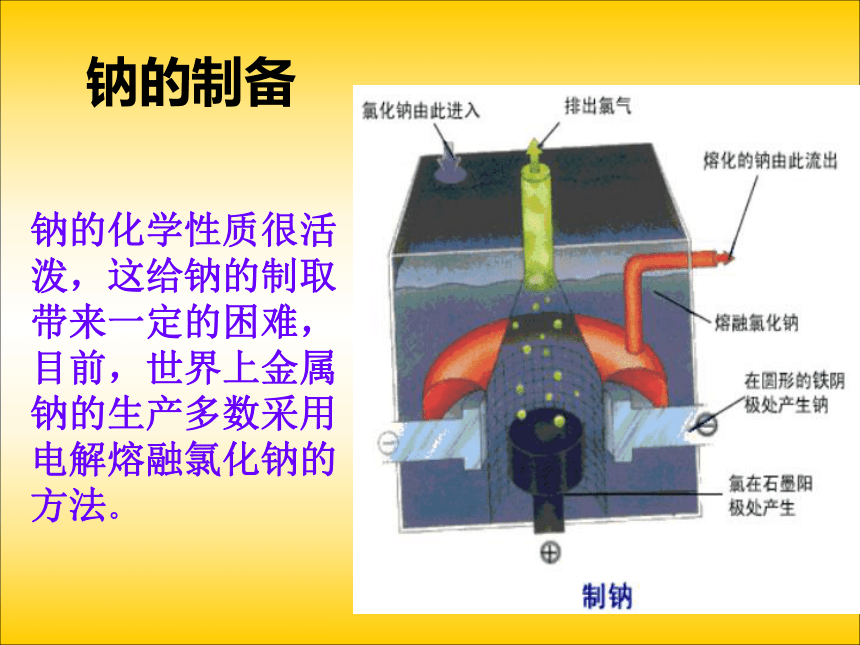
总反应为_______________________。 阴无规则自由负极阳正极电解池阴氧化还原电源正2Na++ 2e- == 2Na2Cl --2e-==Cl2↑总结与归纳钠的制备钠的化学性质很活泼,这给钠的制取带来一定的困难,目前,世界上金属钠的生产多数采用电解熔融氯化钠的方法。(2)、向氯化铜溶液中通入直流电实验:将两根石墨棒分别跟直流电源的正极和负极连接,浸入U型管的CuCl2溶液中 ,再接通12V直流电,观察现象。约3~5min后切断电源。电解电解质溶液又会发生什么反应呢?下面以石墨为电极电解氯化铜溶液为例来分析。请同学们阅读P19页:活动与探究分析:①通电前:CuCl2 = Cu2+ + 2Cl-,
Cu2+、Cl-为自由移动的离子;②通电后:Cu2+移向阴极得到电子,
Cl-移向阳极失去电子;Ⅰ通电前有红色的固体Cu有气泡产生O2? Cl2? 电解:CuCl2 Cu+Cl2 ↑2Cl--2 e- =Cl2阴离子移向阳离子移向电子流向阳极阴极CuCl2溶液e-e-氧化反应还原反应Cu2++ 2e-=2Cu原理分析7、③电极反应:阴极---Cu2++2e-=Cu 发生还原反应阳极---2Cl--2e-=Cl2↑ 发生氧化反应 总反应式:2Cl-+Cu2+= Cl2 ↑ +Cu通电8、9、10、离子移动方向
电解质溶液中阳离子移向阴极;
电解质溶液中阴离子移向阳极。放电顺序:阴极:氧化性强的离子先得电子金属越不活泼的对应阳离子氧化性越强,越容易得电子。(二)、常见离子在水溶液中的放电顺序>Al3+>Mg2+>Na+Fe3+酸水阳极:失电子,发生氧化反应,离子还原性越强,反应越容易。
①当阳极为惰性电极(石墨、铂、金)时,常见阴离子放电顺序:
S2- > I- > Br- > Cl- > OH- > 含氧酸根 > F-
②当阳极为金属电极(除铂、金)时,金属电极优先放电。
以碳棒为电极,电解下列物质的水溶液时,在阴、阳两极上分别是什么离子放电?总结有什么特点或规律?动脑筋HCl、CuCl2、H2O
2. NaCl、AgNO3、CuSO4
3. Na2SO4、H2SO4、NaOH实质电解的只是溶质本身实质电解的是溶质和H2O实质电解的就是H2O(三)、电解规律(惰性电极)1、 阳极:S2- > I- > Br- > Cl- > OH- > 含氧酸根 > F- Ⅰ与Ⅲ区:电解本身型 如CuCl2
Ⅰ与Ⅳ区:放氢生碱型 如NaCl
Ⅱ与Ⅲ区:放氧生酸型 如CuSO4、AgNO3
Ⅱ与Ⅳ区:电解水型 如Na2SO4、 H2SO4 、NaOH阴极:Ag+>Fe3+>Cu2+>H+>Fe2+>Zn2+>H+>Al3+>Mg2+>Na+归纳与总结(四)、电解原理的应用
1、氯碱工业请同学们阅读P20页:交流与讨论以石墨为电极电解饱和食盐水分析电解反应的一般思路:明确溶液中存在哪些离子根据阳极氧化,阴极还原分析得出产物阴阳两极附近有哪些离子现象:阳极——产生Cl2 阴极——产生H2 和酚酞变红【问题】①写出电极反应式,电解总反应方程式;
②为什么NaOH 在阴极区产生?
③若产生1molH2,则产生Cl2、 NaOH质量各
多少? 转移几摩电子? 阴极:
阳极:2H+ + 2e- = H2↑ 还原反应2Cl- -2e- = Cl2↑ 氧化反应阴极区阳极区该装置的缺点:1.H2和Cl2 混合不安全。
2.Cl2会和NaOH反应,会使得到的NaOH不纯。1.离子交换膜电解槽的简单构造如何? 2.离子交换膜的作用是什么? 3.工业制碱的简单生产流程怎样?思考:2、离子交换膜法制烧碱(1)、生产设备名称:
阳极:
阴极:
阳离子交换膜:a将电解槽隔成阴极室和阳极室,它只允许阳离子(Na+)
通过,而阻止阴离子(Cl-、OH-)和气体通过。
b防止氯气和氢气混合而引起爆炸。
c避免氯气与氢氧化钠反应生成次氯酸钠影响氢氧化钠
的产量。(2)、离子交换膜的作用:金属钛网(涂钛钌氧化物)碳钢网(有镍涂层) 只允许阳离子(Na+)通过,把
电解槽隔成阴极室和阳极室。离子交换膜电解槽(3)、生产流程1.用什么方法除去泥沙?
2.用什么试剂除去Ca2+、Mg2+、SO42-?
3.所用试剂只有过量才能除净这些杂质,你能
设计一个合理的顺序逐一除杂吗?
思考:①加入稍过量的NaOH溶液
②加入稍过量BaCl2溶液(其中①、②顺序可以交换。) ③加入稍过量的Na2CO3溶液 ④过滤(除去Mg(OH)2、BaSO4、CaCO3、BaCO3
及泥沙等);
⑤在滤液中加适量盐酸(除去过量的CO32—,调节溶液
的pH); 工业上⑥通过阳离子交换树脂(除去残留的微量Ca2+、Mg2+等离子)。 精制食盐水的操作步骤2、电解精炼铜
(1)、电解精炼的目的
粗铜中含有锌、铁、镍、银、金等
多种杂质,通过电解精炼可获得纯
度达99。95%-99。98%的铜。
(2)、电解精炼铜的装置装置特点:
以粗铜作阳极、精铜作阴极,电解质含Cu2+ e-? 纯铜作阴极,粗铜作阳极; e- e-(3)、粗铜的原理①阳极: Zn -2e-=Zn2+ Fe-2e-=Fe2+
Ni -2e-=Ni2+ Cu-2e-=Cu2+ ②阴极: Cu2+ +2e-=Cu③比铜不活泼的金属:Au、Pt不溶解,而以单质沉积形成阳极泥;④电解质溶液中CuSO4的浓度基本不变。
3、电镀:(1)、电镀铜的装置:镀件作阴极,镀层金属作阳极,
含镀层金属离子的电解质配成电镀液;(2)、电镀铜的原理:阳极(镀层金属):Cu - 2e— = Cu2+
阴极(镀件): Cu2+ + 2e— = Cu
电镀液浓度不变;需注意的几个问题:(1)实质:阳极参加反应的电解(2)、4、电能转化为化学能阳极(接电源正极)阴极(接电源负极)阴离子向阳极迁移
阳离子向阴极迁移化学能转化为电能负极正极阴离子向负极迁移
阳离子向正极迁移都是氧化还原反应
2、原电池的正负极、电子流动方向、电流
流动方向、溶液中离子的移动方向、溶液
中的PH值;
3、燃料电池:正、负极;酸、碱性介质。知识回顾:四、电解池的工作原理及应用(一)、电解原理
1、电解的定义:在直流电的作用下,在两电极上分别发生氧化反应和还原反应的过程叫做电解。
2、电解池的定义:把电能转化为化学能的装置。3、电解池的构成条件(1)外接直流电源(2)与电源相连的两个电极
(3)电解质溶液或熔化的电解质 (4) 形成闭合回路4、电极名称:
阴极:与电源负极相连的电极 发生还原反应
阳极:与电源正极相连的电极 发生氧化反应5、阴阳极的材料:
阴极材料:活性电极(性质比较活泼的物质:
如Fe、Ag、Cu),也可用惰性电极(如:Ti、
Au、Pt、石墨)
阳极材料:(阳极应是还原性很弱的、易导电
的物质,否则阳极本身就要被氧化而溶解)故:
石墨、Ti、Au、Pt。6、实验探究电解原理
(1)、电解熔融的氯化钠请同学们阅读P18页:交流与讨论电解法制钠分析:通电前:分析熔融电解质中的离子情况
阳离子:
阴离子:
做无规则运动通电后:(直流电)
确定电极名称:
阳极(接电源正极)
阴极(接电源负极)
与电极材料无关
Na+Cl-用惰性(石墨)电极电解熔融的氯化钠现象:
阳极:有气泡,有刺激性气味,并能使 湿润的KI-淀 粉试纸变蓝(Cl2) 阴极:有金属钠析出阴极阳极氯
气钠熔融NaCl 通电前, Na+ Cl- 在 __________运动。
通电后, Na+向__ 极(与电源____相连)移动,Cl-向___极(与电源____相连)移动。
电子从电源负极流向_________极,电极反应为__________,发生_______反应。
电子从电解池阳极流向_______极,电极反应为__________,发生_______反应。
总反应为_______________________。 阴无规则自由负极阳正极电解池阴氧化还原电源正2Na++ 2e- == 2Na2Cl --2e-==Cl2↑总结与归纳钠的制备钠的化学性质很活泼,这给钠的制取带来一定的困难,目前,世界上金属钠的生产多数采用电解熔融氯化钠的方法。(2)、向氯化铜溶液中通入直流电实验:将两根石墨棒分别跟直流电源的正极和负极连接,浸入U型管的CuCl2溶液中 ,再接通12V直流电,观察现象。约3~5min后切断电源。电解电解质溶液又会发生什么反应呢?下面以石墨为电极电解氯化铜溶液为例来分析。请同学们阅读P19页:活动与探究分析:①通电前:CuCl2 = Cu2+ + 2Cl-,
Cu2+、Cl-为自由移动的离子;②通电后:Cu2+移向阴极得到电子,
Cl-移向阳极失去电子;Ⅰ通电前有红色的固体Cu有气泡产生O2? Cl2? 电解:CuCl2 Cu+Cl2 ↑2Cl--2 e- =Cl2阴离子移向阳离子移向电子流向阳极阴极CuCl2溶液e-e-氧化反应还原反应Cu2++ 2e-=2Cu原理分析7、③电极反应:阴极---Cu2++2e-=Cu 发生还原反应阳极---2Cl--2e-=Cl2↑ 发生氧化反应 总反应式:2Cl-+Cu2+= Cl2 ↑ +Cu通电8、9、10、离子移动方向
电解质溶液中阳离子移向阴极;
电解质溶液中阴离子移向阳极。放电顺序:阴极:氧化性强的离子先得电子金属越不活泼的对应阳离子氧化性越强,越容易得电子。(二)、常见离子在水溶液中的放电顺序>Al3+>Mg2+>Na+Fe3+酸水阳极:失电子,发生氧化反应,离子还原性越强,反应越容易。
①当阳极为惰性电极(石墨、铂、金)时,常见阴离子放电顺序:
S2- > I- > Br- > Cl- > OH- > 含氧酸根 > F-
②当阳极为金属电极(除铂、金)时,金属电极优先放电。
以碳棒为电极,电解下列物质的水溶液时,在阴、阳两极上分别是什么离子放电?总结有什么特点或规律?动脑筋HCl、CuCl2、H2O
2. NaCl、AgNO3、CuSO4
3. Na2SO4、H2SO4、NaOH实质电解的只是溶质本身实质电解的是溶质和H2O实质电解的就是H2O(三)、电解规律(惰性电极)1、 阳极:S2- > I- > Br- > Cl- > OH- > 含氧酸根 > F- Ⅰ与Ⅲ区:电解本身型 如CuCl2
Ⅰ与Ⅳ区:放氢生碱型 如NaCl
Ⅱ与Ⅲ区:放氧生酸型 如CuSO4、AgNO3
Ⅱ与Ⅳ区:电解水型 如Na2SO4、 H2SO4 、NaOH阴极:Ag+>Fe3+>Cu2+>H+>Fe2+>Zn2+>H+>Al3+>Mg2+>Na+归纳与总结(四)、电解原理的应用
1、氯碱工业请同学们阅读P20页:交流与讨论以石墨为电极电解饱和食盐水分析电解反应的一般思路:明确溶液中存在哪些离子根据阳极氧化,阴极还原分析得出产物阴阳两极附近有哪些离子现象:阳极——产生Cl2 阴极——产生H2 和酚酞变红【问题】①写出电极反应式,电解总反应方程式;
②为什么NaOH 在阴极区产生?
③若产生1molH2,则产生Cl2、 NaOH质量各
多少? 转移几摩电子? 阴极:
阳极:2H+ + 2e- = H2↑ 还原反应2Cl- -2e- = Cl2↑ 氧化反应阴极区阳极区该装置的缺点:1.H2和Cl2 混合不安全。
2.Cl2会和NaOH反应,会使得到的NaOH不纯。1.离子交换膜电解槽的简单构造如何? 2.离子交换膜的作用是什么? 3.工业制碱的简单生产流程怎样?思考:2、离子交换膜法制烧碱(1)、生产设备名称:
阳极:
阴极:
阳离子交换膜:a将电解槽隔成阴极室和阳极室,它只允许阳离子(Na+)
通过,而阻止阴离子(Cl-、OH-)和气体通过。
b防止氯气和氢气混合而引起爆炸。
c避免氯气与氢氧化钠反应生成次氯酸钠影响氢氧化钠
的产量。(2)、离子交换膜的作用:金属钛网(涂钛钌氧化物)碳钢网(有镍涂层) 只允许阳离子(Na+)通过,把
电解槽隔成阴极室和阳极室。离子交换膜电解槽(3)、生产流程1.用什么方法除去泥沙?
2.用什么试剂除去Ca2+、Mg2+、SO42-?
3.所用试剂只有过量才能除净这些杂质,你能
设计一个合理的顺序逐一除杂吗?
思考:①加入稍过量的NaOH溶液
②加入稍过量BaCl2溶液(其中①、②顺序可以交换。) ③加入稍过量的Na2CO3溶液 ④过滤(除去Mg(OH)2、BaSO4、CaCO3、BaCO3
及泥沙等);
⑤在滤液中加适量盐酸(除去过量的CO32—,调节溶液
的pH); 工业上⑥通过阳离子交换树脂(除去残留的微量Ca2+、Mg2+等离子)。 精制食盐水的操作步骤2、电解精炼铜
(1)、电解精炼的目的
粗铜中含有锌、铁、镍、银、金等
多种杂质,通过电解精炼可获得纯
度达99。95%-99。98%的铜。
(2)、电解精炼铜的装置装置特点:
以粗铜作阳极、精铜作阴极,电解质含Cu2+ e-? 纯铜作阴极,粗铜作阳极; e- e-(3)、粗铜的原理①阳极: Zn -2e-=Zn2+ Fe-2e-=Fe2+
Ni -2e-=Ni2+ Cu-2e-=Cu2+ ②阴极: Cu2+ +2e-=Cu③比铜不活泼的金属:Au、Pt不溶解,而以单质沉积形成阳极泥;④电解质溶液中CuSO4的浓度基本不变。
3、电镀:(1)、电镀铜的装置:镀件作阴极,镀层金属作阳极,
含镀层金属离子的电解质配成电镀液;(2)、电镀铜的原理:阳极(镀层金属):Cu - 2e— = Cu2+
阴极(镀件): Cu2+ + 2e— = Cu
电镀液浓度不变;需注意的几个问题:(1)实质:阳极参加反应的电解(2)、4、电能转化为化学能阳极(接电源正极)阴极(接电源负极)阴离子向阳极迁移
阳离子向阴极迁移化学能转化为电能负极正极阴离子向负极迁移
阳离子向正极迁移都是氧化还原反应
