化学精品课件:化学反应速率、影响化学反应速率的因素
文档属性
| 名称 | 化学精品课件:化学反应速率、影响化学反应速率的因素 |

|
|
| 格式 | rar | ||
| 文件大小 | 558.2KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 其它版本 | ||
| 科目 | 化学 | ||
| 更新时间 | 2010-07-22 08:30:00 | ||
图片预览











文档简介
课件55张PPT。复习1:化学反应速率【思考与交流】
什么是化学反应速率?
化学反应速率是表示化学反应快慢的物理量。
对于锌和不同浓度的稀硫酸的实验,你准备如何比较反应速率的快慢?
①观察产生气泡的快、慢;
②观察试管中剩余锌粒的质量的多、少;
③用手触摸试管,感受试管外壁温度的高、低。
为什么可以根据上述实验现象来判断反应的快慢化学反应速率化学反应速率如何用数学表达式表示化学反应速率,并说明它的单位。
ν = ?c/ ?t
单位:化学反应速率 mol / (L ? S)
或mol/(L ? min )、mol/(L ?h)
通常用单位时间内反应物浓度的减少量或生成物浓度的增加量(均取正值)来表示。用单位时间内反应物或生成物的某一物理量的变化值来表示。
m、n、V、c、p、△H、导电性、N(一)判断化学反应快慢的方法有哪些?(二)如何从定量的角度来表示化学反应快慢?——测定物质或离子的浓度变化
——测定溶液的导电能力的不同——测定气体的体积或体系的压强——测定体系的温度或测定反应的热量变化——测定物质的质量变化
——测定物质的物质的量的变化反应速率的测定
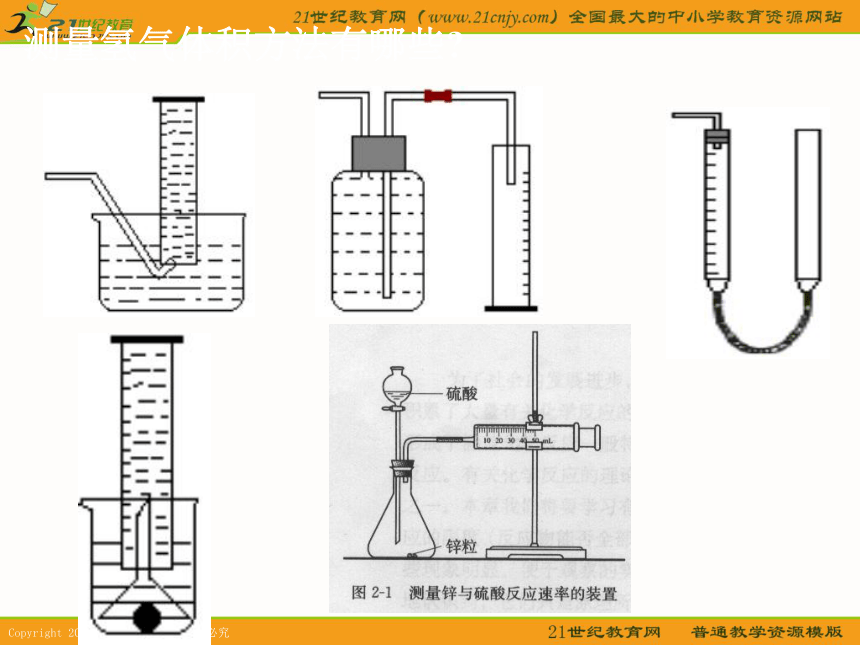
按图安装两套装置,在锥形瓶内
各盛有2g锌粒(颗粒大小基本相
同),然后通过分液漏斗分别加
入40mL 1mol/L和40mL 4mL/L的
硫酸,比较二者收集10mLH2所
用的时间。把实验结果填入下表:请仔细阅读实验2-1,思考并写出实验目的、实验仪器和药品、实验步骤,然后与大家交流。
实验目的:测量相同质量、颗粒大小相同的锌粒分别与1 mol·L-1稀硫酸、4 mol·L-1稀硫酸反应的反应速率。
实验仪器:锥形瓶、分液漏斗、双孔塞、注射器、铁架台
实验药品:锌粒2粒(颗粒大小相同),1 mol·L-1稀硫酸、4 mol·L-1稀硫酸各40 mL实验步骤:
1、连接实验装置
2、检查装置的气密性
3、先向锥形瓶中加入锌粒,然后再向分液漏斗中加入稀硫酸
4、使稀硫酸滴入锥形瓶与锌粒反应
5、观察收集10mLH2所用的时间
或1分钟收集到的H2的体积实验步骤:
1、连接实验装置
2、检查装置的气密性
3、先向锥形瓶中加入锌粒,然后再向分液漏斗中加入稀硫酸
先用镊子将锌粒置于锥形瓶内壁,然后再把锥形瓶缓缓立起,使锌粒滑至底部由下到上,由左到右固定注射器的活塞,通过分液漏斗向锥形瓶加水……实验步骤:
4、使稀硫酸滴入锥形瓶与锌粒反应
先取下分液漏斗的玻璃塞,再打开分液漏斗的活塞,使稀硫酸顺利滴入锥形瓶
5、观察收集10mLH2所用的时间
或1分钟收集到的H2的体积
①当体系的温度恢复到室温后。
要调节量筒的高度,使量筒内的液面与广口瓶中的液面相平
②读数时,眼睛要平视量筒内(或良气管内)液面的最低点。测量氢气体积方法有哪些?如何通过用注射器测量氢气的体积的方法来判断锌和不同浓度的稀硫酸反应的速率快慢?
1)确定变量
2)找出某种易于测量的某种物理量或性质的变化
3)控制不变的因素
——稀硫酸的浓度不同——锌粒的表面积、温度
——时间或氢气的体积——测量氢气的体积或时间通过上述学习过程,你认为应该如何测定化学反应速率?
只要是与反应物或生成物的浓度(或质量、物质的量)有关的性质都可以加以利用。
因为化学反应中发生变化的是体系中的化学物质的质量(或物质的量、浓度)。本实验还可以如何测定锌和稀硫酸反应的速率
1、测量溶液中的H+的浓度的变化
2、测量溶液中的Zn2+的浓度变化
3、测量氢气的体积或氢气的质量的变化
4、测量体系的压强的变化
5、测量锌粒的质量的变化
6、测量溶液的导电能力的变化
7、测量反应体系的热量变化请设计实验测定该反应的速率
1、测量溶液中的H+的浓度1)用pH计测定溶液的pH,然后进行换算
2)加入过量的Na2SiO3,使H+完成转化为沉淀,然后过滤、洗涤、干燥,称量沉淀的质量,再把沉淀的质量换算成H+浓度。
3)加入一定量(过量)的石灰石,充分反应后,过滤、洗涤、干燥,称量剩余的石灰石。进行换算。
4)取出锌粒,向剩余溶液中加入几滴酚酞试液,然后滴加一定浓度的NaOH溶液,当溶液由红色变为无色时,记下NaOH溶液的体积。2测量氢气的体积或氢气的质量
1)测量氢气的体积
2)测量氢气的质量
①用气球收集氢气,称量前后的质量
②称量整套装置反应前后的质量你是如何理解化学反应速率的定义?
从物质的聚集状态、生产实际出发,应该如何表示化学反应速率?请用不同物质的浓度变化来表示下列化学反应的速率:
aA + bB ═ cC + dD
容积1L的某密闭容器中,投入8molN2 ,20molH2
一定条件下发生反应:N2 + 3H2 ═ 2NH3
反应进行到5min时,N2的物质的量为6 mol。请分别用N2、H2、NH3的浓度变化表示该化学反应的速率。①同一化学反应中,用不同物质的浓度变化所表示的化学反应速率的数值可能不同。
②任何化学反应中,反应速率之比等于方程式中化学式前的系数比(计量数之比)。
③速率之比等于浓度的变化值之比,等于物质的量的变化值之比。)练习1.某温度下,反应2N2O5 ═ 4NO2+O2开始进行时,c(N2O5)=0.0408mol/L。经1min后,c(N2O5)=0.030mol/L。则该反应的反应速率是
A v(N2O5)=1.8×10-4mol·L-1·s-1
B v(N2O5)=1.8×10-2mol·L-1·s-1
C v(NO2)=1.8×10-4mol·L-1·s-1
D v(O2)=1.8×10-4mol·L-1·s-1练习2.已知反应A+3B 2C+D在某段时间内以A的浓度变化表示的化学反应速度为1mol·L-1·min-1,则此段时间内以C的浓度变化表示的化学反应速率为
A 0.5mol·L-1·min-1
B 1mol·L-1·min-1
C 2 mol·L-1·min-1
D 3mol·L-1·min-1练习3.反应4NH3(气)+5O2(气) 4NO(气)+6H2O(气)在2升的密闭容器中进行,1min后,NH3减少了0.12mol,则平均每秒钟浓度变化正确的是
A NO:0.001mol/L
B H2O:0.002mol/L
C NH3:0.002mol/L
D O2:0.00125mol/L练习4.在密闭容器中进行可逆反应,A跟B反应生成C,反应速率v(A)、v(B)、v(C)之间存在以下关系:v(B)=3v(A),v(C)=2v(A),3v(C)=2v(B),则该反应可以表示为
A A+B C B 2A+2B 3C
C 3A+B 2C D A+3B 2C 小结:
1、化学反应速率的概念
2、化学反应速率表示方法
3、测定化学反应速率的方法
测定在化学反应过程发生变化的物理量 化学反应速率就是用单位时间内反应物浓度的减少量或生成物浓度的增加量(均取正值)来表示化学反应的快慢。
反应NH3+HCl ═ NH4Cl在2升的密闭容器中进行,1min后,NH3减少了0.12mol,则以氨气的浓度变化来表示的上述反应在这段时间内的平均反应速率正确的是
A . 0.001 mol /(L·s)
B . 0.002 mol /(L·min)
C . 0.002 mol /(L·min)
D . 0.06 mol /(L·min) 复习2:影响化学反应速率的因素
(分子间的有效碰撞频率)化学反应速率单位时间内有效碰撞次数单位体积内反应物中的活化分子数活化能的大小反应物的性质物质的结构对于某个特定的化学反应来说,如何才能改变、控制反应速率?
——改变反应物的内能、活化能、粒子的运动速率、粒子间的碰撞几率思考与交流:影响化学反应速率的因素有哪些?
是如何影响的?怎样解释?1)不变的因素
2)控制条件(自变量)
3)结果(因变量)
一般是随着条件的变化而发生变化的、且易于测量的物理量——草酸溶液的浓度不同——KMnO4溶液的浓度相同
——温度相同——测量溶液褪色的时间一、【实验2-2】浓度对反应速率的影响 思考与交流:这些条件是如何影响化学反应速率的?怎样解释?浓度越大,反应速率越快; 浓度越小,反应速率越慢。
改变了单位体积中的活化分子总数。浓度对反应速率的影响结论:增加反应物的浓度,单位体积内活化分子数目增多,反应速率加快。对于可逆反应:2SO2 + O2 2SO3来说:
增大SO2、O2的浓度,正、逆反应速率如何变化?
——正反应速率突然加快,逆反应速率不变
增大SO3的浓度,正、逆反应速率如何变化?
——逆反应速率突然加快,正反应速率不变
减小SO2、O2的浓度,正、逆反应速率如何变化?
——正反应速率突然减小,逆反应速率不变
减小SO3的浓度,正、逆反应速率如何变化?
——逆反应速率突然减小,逆反应速率不变二、压强对反应速率的影响
1、增大压强,化学反应速率如何变化?
2、减小压强,化学反应速率如何变化?
为什么?
增大压强, 气体物质的浓度增大,该气体所发生的反应的速率加快 。
减小压强,气体物质的浓度减小,该气体所发生的反应的速率减慢。 增大压强,正、逆反应速率如何变化?
——正反应速率和逆反应速率都突然加快
减小压强,正、逆反应速率如何变化?
——正反应速率和逆反应速率都突然减慢增大压强,化学反应速率加快;
减小压强,化学反应速率减慢。
改变了反应物的浓度,改变了单位体积内活化分子数。思考与交流:这些条件是如何影响化学反应速率的?怎样解释?压强对反应速率的影响实际是因为压强的改变使浓度发生的结果。压强对反应速率的影响结论:增大压强,反应物浓度增大,单位体积内活化分子数目增多,反应速率加快。三、【实验2-3】温度对反应速率的影响 1)不变的因素
2)控制条件(自变量)
3)结果(因变量)
一般是随着条件的变化而发生变化的、且易于测量的物理量——反应物及浓度相同——温度不同——测量出现浑浊的时间升高温度,化学反应速率加快;
降低温度,化学反应速率减慢。
升高温度,既使分子获得了更高的能量,提高了活化分子的百分数;又提高分子间的碰撞频率。
提高了分子间有效碰撞的几率,速率增大思考与交流:这些条件是如何影响化学反应速率的?怎样解释?温度对反应速率的影响结论:升高温度,分子运动速率加快,单位体积内活化分子数目增多,反应速率加快。对于可逆反应:2SO2 + O2 2SO3 △H<0来说:升高温度,正、逆反应速率如何变化?
——正反应速率和逆反应速率都增大,但吸热反应方向的速率增大得更多
降低温度,正、逆反应速率如何变化?
——正反应速率和逆反应速率都减小,但吸热反应方向的速率减小得更多三、【科学探究】阅读科学探究,把你不懂的地方提出来大家讨论。
请设计实验探究溶液出现蓝色与温度的关系
1、取两支试管,先分别向两支试管中加入2 mL KI溶液,再加入淀粉溶液,最后加入稀硫酸
2、将两支试管分别置于室温和0 ℃时进行实验,并记录实验现象1)不变的因素
2)控制条件(自变量)
3)结果(因变量)
一般是随着条件的变化而发生变化的、且易于测量的物理量——H2O2溶液的浓度相同
——温度相同——是否用催化剂——测量余烬复燃所须的时间四、【实验2-4】催化剂对反应速率的影响 加入催化剂可以改变化学反应速率 。
改变了活化能,从而改变了活化分子的百分数思考与交流:这些条件是如何影响化学反应速率的?怎样解释?加催化剂,正、逆反应速率如何变化?
——正反应速率和逆反应速率都突然加快且增大相同的倍数1)找出某种易于测量的某种物理量或性质的变化
2)确定变量
3)控制不变的因素
——用不同催化剂——H2O2溶液的浓度相同
——温度相同——测量产生气泡的快慢
①比较相同时间内所收集气体的体积
②比较收集相同体积的气体所耗的时间四、【科学探究1】不同催化剂对反应速率的影响 1)找出某种易于测量的某种物理量或性质的变化
2)确定变量
3)控制不变的因素——是否催化剂——草酸溶液的浓度相同
——温度相同——测量溶液褪色所用的时间四、【科学探究2】催化剂对反应速率的影响 1)找出某种易于测量的某种物理量或性质的变化
2)确定变量
3)控制不变的因素
——用不同催化剂——淀粉溶液、碘水的浓度相同
——温度相同——测量溶液蓝色褪去所用的时间四、【科学探究3】不同催化剂对反应速率的影响 粉末状的固体比块状固体的反应速率快。
改变了粒子间的碰撞几率思考与交流:这些条件是如何影响化学反应速率的?怎样解释?1、内因:
反应物本身的性质。
2、外因:
①温度:
②催化剂:
③浓度:
④固体物质的表面积:
⑤反应物的状态:影响化学反应速率的因素温度越高,反应速率越快。
催化剂可以改变化学反应速率。
反应物的浓度越大,反应速率越快。
粉末状的固体比块状固体 的反应速率快。
溶液中进行的反应,速率更快。【归纳、小结】1)机动车加大油门
——增大反应物(油)的浓度,增大单位体积中的活化分子总数
2)向炉膛鼓风
——增大反应物的浓度,增大单位体积中的活化分子总数
3)在糕点包装内加脱氧剂
——减小氧气的浓度,减小单位体积中的活化分子总数
4)用煤粉代替煤块
——增大反应物的接触面,增大有效碰撞几率请列举生活中有关影响化学反应速率的事实
下列措施为什么能改变化学反应速率?5)用温水发酵面粉
——升高温度,增大活化分子百分数
6)把食物放在冰箱里以延长保鲜期
——降低温度,减小活化分子百分数
7)H2O2分解加MnO2
——加正催化剂,减小活化能,增大活化分子的百分数
8)化学实验时常常要振荡和搅拌
——增加有效碰撞几率【练习1】在锌和某浓度的盐酸起反应的实验中,一个学生得到下面的结果:则下列说法正确的是( )
①t1 = 75s ②t2>200>t3 ③单位时间内消耗的锌的质量mG>mF>mB
A. ① B. ①② C. 只有② D. 全部正确【练习2】用铁片与稀硫酸反应制取氢气时,下列措施不能使氢气的生成速率加快的是
A 加热
B 不用稀硫酸,改用98.3%的浓硫酸
C 滴加少量CuSO4溶液
D 不用铁片,改用铁粉 谢谢
什么是化学反应速率?
化学反应速率是表示化学反应快慢的物理量。
对于锌和不同浓度的稀硫酸的实验,你准备如何比较反应速率的快慢?
①观察产生气泡的快、慢;
②观察试管中剩余锌粒的质量的多、少;
③用手触摸试管,感受试管外壁温度的高、低。
为什么可以根据上述实验现象来判断反应的快慢化学反应速率化学反应速率如何用数学表达式表示化学反应速率,并说明它的单位。
ν = ?c/ ?t
单位:化学反应速率 mol / (L ? S)
或mol/(L ? min )、mol/(L ?h)
通常用单位时间内反应物浓度的减少量或生成物浓度的增加量(均取正值)来表示。用单位时间内反应物或生成物的某一物理量的变化值来表示。
m、n、V、c、p、△H、导电性、N(一)判断化学反应快慢的方法有哪些?(二)如何从定量的角度来表示化学反应快慢?——测定物质或离子的浓度变化
——测定溶液的导电能力的不同——测定气体的体积或体系的压强——测定体系的温度或测定反应的热量变化——测定物质的质量变化
——测定物质的物质的量的变化反应速率的测定
按图安装两套装置,在锥形瓶内
各盛有2g锌粒(颗粒大小基本相
同),然后通过分液漏斗分别加
入40mL 1mol/L和40mL 4mL/L的
硫酸,比较二者收集10mLH2所
用的时间。把实验结果填入下表:请仔细阅读实验2-1,思考并写出实验目的、实验仪器和药品、实验步骤,然后与大家交流。
实验目的:测量相同质量、颗粒大小相同的锌粒分别与1 mol·L-1稀硫酸、4 mol·L-1稀硫酸反应的反应速率。
实验仪器:锥形瓶、分液漏斗、双孔塞、注射器、铁架台
实验药品:锌粒2粒(颗粒大小相同),1 mol·L-1稀硫酸、4 mol·L-1稀硫酸各40 mL实验步骤:
1、连接实验装置
2、检查装置的气密性
3、先向锥形瓶中加入锌粒,然后再向分液漏斗中加入稀硫酸
4、使稀硫酸滴入锥形瓶与锌粒反应
5、观察收集10mLH2所用的时间
或1分钟收集到的H2的体积实验步骤:
1、连接实验装置
2、检查装置的气密性
3、先向锥形瓶中加入锌粒,然后再向分液漏斗中加入稀硫酸
先用镊子将锌粒置于锥形瓶内壁,然后再把锥形瓶缓缓立起,使锌粒滑至底部由下到上,由左到右固定注射器的活塞,通过分液漏斗向锥形瓶加水……实验步骤:
4、使稀硫酸滴入锥形瓶与锌粒反应
先取下分液漏斗的玻璃塞,再打开分液漏斗的活塞,使稀硫酸顺利滴入锥形瓶
5、观察收集10mLH2所用的时间
或1分钟收集到的H2的体积
①当体系的温度恢复到室温后。
要调节量筒的高度,使量筒内的液面与广口瓶中的液面相平
②读数时,眼睛要平视量筒内(或良气管内)液面的最低点。测量氢气体积方法有哪些?如何通过用注射器测量氢气的体积的方法来判断锌和不同浓度的稀硫酸反应的速率快慢?
1)确定变量
2)找出某种易于测量的某种物理量或性质的变化
3)控制不变的因素
——稀硫酸的浓度不同——锌粒的表面积、温度
——时间或氢气的体积——测量氢气的体积或时间通过上述学习过程,你认为应该如何测定化学反应速率?
只要是与反应物或生成物的浓度(或质量、物质的量)有关的性质都可以加以利用。
因为化学反应中发生变化的是体系中的化学物质的质量(或物质的量、浓度)。本实验还可以如何测定锌和稀硫酸反应的速率
1、测量溶液中的H+的浓度的变化
2、测量溶液中的Zn2+的浓度变化
3、测量氢气的体积或氢气的质量的变化
4、测量体系的压强的变化
5、测量锌粒的质量的变化
6、测量溶液的导电能力的变化
7、测量反应体系的热量变化请设计实验测定该反应的速率
1、测量溶液中的H+的浓度1)用pH计测定溶液的pH,然后进行换算
2)加入过量的Na2SiO3,使H+完成转化为沉淀,然后过滤、洗涤、干燥,称量沉淀的质量,再把沉淀的质量换算成H+浓度。
3)加入一定量(过量)的石灰石,充分反应后,过滤、洗涤、干燥,称量剩余的石灰石。进行换算。
4)取出锌粒,向剩余溶液中加入几滴酚酞试液,然后滴加一定浓度的NaOH溶液,当溶液由红色变为无色时,记下NaOH溶液的体积。2测量氢气的体积或氢气的质量
1)测量氢气的体积
2)测量氢气的质量
①用气球收集氢气,称量前后的质量
②称量整套装置反应前后的质量你是如何理解化学反应速率的定义?
从物质的聚集状态、生产实际出发,应该如何表示化学反应速率?请用不同物质的浓度变化来表示下列化学反应的速率:
aA + bB ═ cC + dD
容积1L的某密闭容器中,投入8molN2 ,20molH2
一定条件下发生反应:N2 + 3H2 ═ 2NH3
反应进行到5min时,N2的物质的量为6 mol。请分别用N2、H2、NH3的浓度变化表示该化学反应的速率。①同一化学反应中,用不同物质的浓度变化所表示的化学反应速率的数值可能不同。
②任何化学反应中,反应速率之比等于方程式中化学式前的系数比(计量数之比)。
③速率之比等于浓度的变化值之比,等于物质的量的变化值之比。)练习1.某温度下,反应2N2O5 ═ 4NO2+O2开始进行时,c(N2O5)=0.0408mol/L。经1min后,c(N2O5)=0.030mol/L。则该反应的反应速率是
A v(N2O5)=1.8×10-4mol·L-1·s-1
B v(N2O5)=1.8×10-2mol·L-1·s-1
C v(NO2)=1.8×10-4mol·L-1·s-1
D v(O2)=1.8×10-4mol·L-1·s-1练习2.已知反应A+3B 2C+D在某段时间内以A的浓度变化表示的化学反应速度为1mol·L-1·min-1,则此段时间内以C的浓度变化表示的化学反应速率为
A 0.5mol·L-1·min-1
B 1mol·L-1·min-1
C 2 mol·L-1·min-1
D 3mol·L-1·min-1练习3.反应4NH3(气)+5O2(气) 4NO(气)+6H2O(气)在2升的密闭容器中进行,1min后,NH3减少了0.12mol,则平均每秒钟浓度变化正确的是
A NO:0.001mol/L
B H2O:0.002mol/L
C NH3:0.002mol/L
D O2:0.00125mol/L练习4.在密闭容器中进行可逆反应,A跟B反应生成C,反应速率v(A)、v(B)、v(C)之间存在以下关系:v(B)=3v(A),v(C)=2v(A),3v(C)=2v(B),则该反应可以表示为
A A+B C B 2A+2B 3C
C 3A+B 2C D A+3B 2C 小结:
1、化学反应速率的概念
2、化学反应速率表示方法
3、测定化学反应速率的方法
测定在化学反应过程发生变化的物理量 化学反应速率就是用单位时间内反应物浓度的减少量或生成物浓度的增加量(均取正值)来表示化学反应的快慢。
反应NH3+HCl ═ NH4Cl在2升的密闭容器中进行,1min后,NH3减少了0.12mol,则以氨气的浓度变化来表示的上述反应在这段时间内的平均反应速率正确的是
A . 0.001 mol /(L·s)
B . 0.002 mol /(L·min)
C . 0.002 mol /(L·min)
D . 0.06 mol /(L·min) 复习2:影响化学反应速率的因素
(分子间的有效碰撞频率)化学反应速率单位时间内有效碰撞次数单位体积内反应物中的活化分子数活化能的大小反应物的性质物质的结构对于某个特定的化学反应来说,如何才能改变、控制反应速率?
——改变反应物的内能、活化能、粒子的运动速率、粒子间的碰撞几率思考与交流:影响化学反应速率的因素有哪些?
是如何影响的?怎样解释?1)不变的因素
2)控制条件(自变量)
3)结果(因变量)
一般是随着条件的变化而发生变化的、且易于测量的物理量——草酸溶液的浓度不同——KMnO4溶液的浓度相同
——温度相同——测量溶液褪色的时间一、【实验2-2】浓度对反应速率的影响 思考与交流:这些条件是如何影响化学反应速率的?怎样解释?浓度越大,反应速率越快; 浓度越小,反应速率越慢。
改变了单位体积中的活化分子总数。浓度对反应速率的影响结论:增加反应物的浓度,单位体积内活化分子数目增多,反应速率加快。对于可逆反应:2SO2 + O2 2SO3来说:
增大SO2、O2的浓度,正、逆反应速率如何变化?
——正反应速率突然加快,逆反应速率不变
增大SO3的浓度,正、逆反应速率如何变化?
——逆反应速率突然加快,正反应速率不变
减小SO2、O2的浓度,正、逆反应速率如何变化?
——正反应速率突然减小,逆反应速率不变
减小SO3的浓度,正、逆反应速率如何变化?
——逆反应速率突然减小,逆反应速率不变二、压强对反应速率的影响
1、增大压强,化学反应速率如何变化?
2、减小压强,化学反应速率如何变化?
为什么?
增大压强, 气体物质的浓度增大,该气体所发生的反应的速率加快 。
减小压强,气体物质的浓度减小,该气体所发生的反应的速率减慢。 增大压强,正、逆反应速率如何变化?
——正反应速率和逆反应速率都突然加快
减小压强,正、逆反应速率如何变化?
——正反应速率和逆反应速率都突然减慢增大压强,化学反应速率加快;
减小压强,化学反应速率减慢。
改变了反应物的浓度,改变了单位体积内活化分子数。思考与交流:这些条件是如何影响化学反应速率的?怎样解释?压强对反应速率的影响实际是因为压强的改变使浓度发生的结果。压强对反应速率的影响结论:增大压强,反应物浓度增大,单位体积内活化分子数目增多,反应速率加快。三、【实验2-3】温度对反应速率的影响 1)不变的因素
2)控制条件(自变量)
3)结果(因变量)
一般是随着条件的变化而发生变化的、且易于测量的物理量——反应物及浓度相同——温度不同——测量出现浑浊的时间升高温度,化学反应速率加快;
降低温度,化学反应速率减慢。
升高温度,既使分子获得了更高的能量,提高了活化分子的百分数;又提高分子间的碰撞频率。
提高了分子间有效碰撞的几率,速率增大思考与交流:这些条件是如何影响化学反应速率的?怎样解释?温度对反应速率的影响结论:升高温度,分子运动速率加快,单位体积内活化分子数目增多,反应速率加快。对于可逆反应:2SO2 + O2 2SO3 △H<0来说:升高温度,正、逆反应速率如何变化?
——正反应速率和逆反应速率都增大,但吸热反应方向的速率增大得更多
降低温度,正、逆反应速率如何变化?
——正反应速率和逆反应速率都减小,但吸热反应方向的速率减小得更多三、【科学探究】阅读科学探究,把你不懂的地方提出来大家讨论。
请设计实验探究溶液出现蓝色与温度的关系
1、取两支试管,先分别向两支试管中加入2 mL KI溶液,再加入淀粉溶液,最后加入稀硫酸
2、将两支试管分别置于室温和0 ℃时进行实验,并记录实验现象1)不变的因素
2)控制条件(自变量)
3)结果(因变量)
一般是随着条件的变化而发生变化的、且易于测量的物理量——H2O2溶液的浓度相同
——温度相同——是否用催化剂——测量余烬复燃所须的时间四、【实验2-4】催化剂对反应速率的影响 加入催化剂可以改变化学反应速率 。
改变了活化能,从而改变了活化分子的百分数思考与交流:这些条件是如何影响化学反应速率的?怎样解释?加催化剂,正、逆反应速率如何变化?
——正反应速率和逆反应速率都突然加快且增大相同的倍数1)找出某种易于测量的某种物理量或性质的变化
2)确定变量
3)控制不变的因素
——用不同催化剂——H2O2溶液的浓度相同
——温度相同——测量产生气泡的快慢
①比较相同时间内所收集气体的体积
②比较收集相同体积的气体所耗的时间四、【科学探究1】不同催化剂对反应速率的影响 1)找出某种易于测量的某种物理量或性质的变化
2)确定变量
3)控制不变的因素——是否催化剂——草酸溶液的浓度相同
——温度相同——测量溶液褪色所用的时间四、【科学探究2】催化剂对反应速率的影响 1)找出某种易于测量的某种物理量或性质的变化
2)确定变量
3)控制不变的因素
——用不同催化剂——淀粉溶液、碘水的浓度相同
——温度相同——测量溶液蓝色褪去所用的时间四、【科学探究3】不同催化剂对反应速率的影响 粉末状的固体比块状固体的反应速率快。
改变了粒子间的碰撞几率思考与交流:这些条件是如何影响化学反应速率的?怎样解释?1、内因:
反应物本身的性质。
2、外因:
①温度:
②催化剂:
③浓度:
④固体物质的表面积:
⑤反应物的状态:影响化学反应速率的因素温度越高,反应速率越快。
催化剂可以改变化学反应速率。
反应物的浓度越大,反应速率越快。
粉末状的固体比块状固体 的反应速率快。
溶液中进行的反应,速率更快。【归纳、小结】1)机动车加大油门
——增大反应物(油)的浓度,增大单位体积中的活化分子总数
2)向炉膛鼓风
——增大反应物的浓度,增大单位体积中的活化分子总数
3)在糕点包装内加脱氧剂
——减小氧气的浓度,减小单位体积中的活化分子总数
4)用煤粉代替煤块
——增大反应物的接触面,增大有效碰撞几率请列举生活中有关影响化学反应速率的事实
下列措施为什么能改变化学反应速率?5)用温水发酵面粉
——升高温度,增大活化分子百分数
6)把食物放在冰箱里以延长保鲜期
——降低温度,减小活化分子百分数
7)H2O2分解加MnO2
——加正催化剂,减小活化能,增大活化分子的百分数
8)化学实验时常常要振荡和搅拌
——增加有效碰撞几率【练习1】在锌和某浓度的盐酸起反应的实验中,一个学生得到下面的结果:则下列说法正确的是( )
①t1 = 75s ②t2>200>t3 ③单位时间内消耗的锌的质量mG>mF>mB
A. ① B. ①② C. 只有② D. 全部正确【练习2】用铁片与稀硫酸反应制取氢气时,下列措施不能使氢气的生成速率加快的是
A 加热
B 不用稀硫酸,改用98.3%的浓硫酸
C 滴加少量CuSO4溶液
D 不用铁片,改用铁粉 谢谢
同课章节目录
