化学精品课件:影响化学反应速率的因素(3)
文档属性
| 名称 | 化学精品课件:影响化学反应速率的因素(3) |

|
|
| 格式 | rar | ||
| 文件大小 | 577.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 其它版本 | ||
| 科目 | 化学 | ||
| 更新时间 | 2010-07-22 00:00:00 | ||
图片预览






文档简介
课件26张PPT。第二章 化学反应速率和化学平衡第二节 影响化学反应速率的因素 影响反应速率的因素内因(主要因素):参加反应物质的性质化学反应的本质:反应物分子中的化学键断裂、生成物分子中的化学键形成过程外因:①浓度:②压强:③温度:④催化剂:
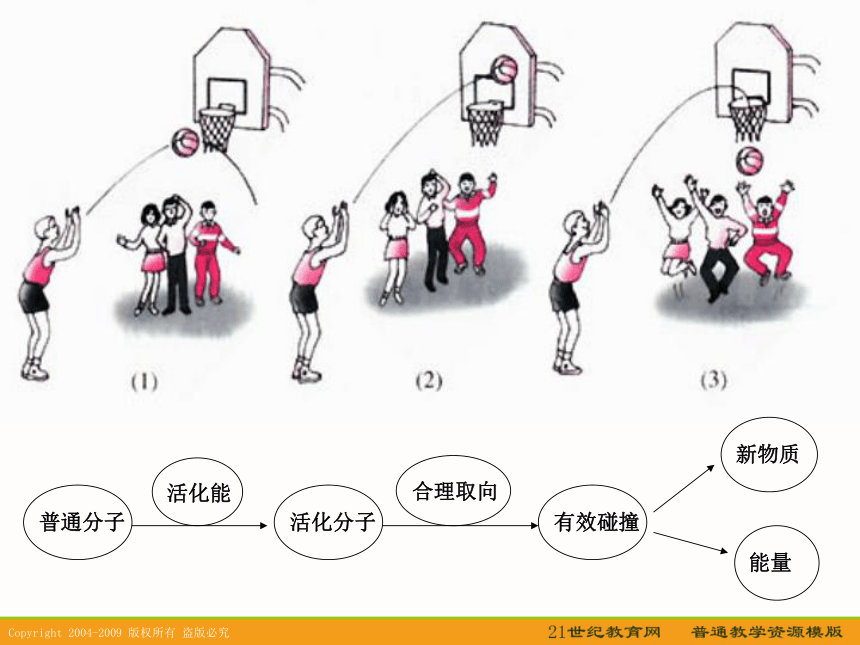
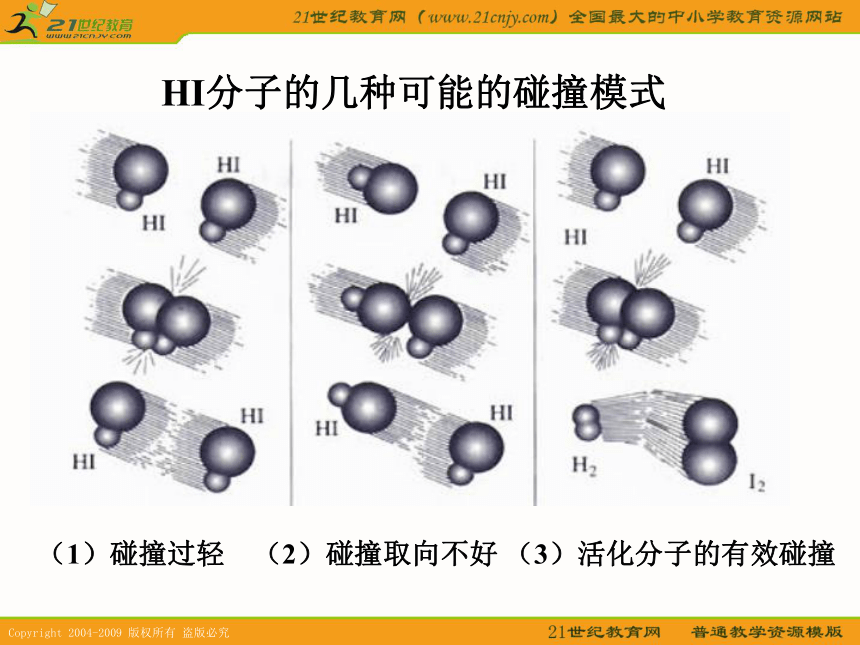
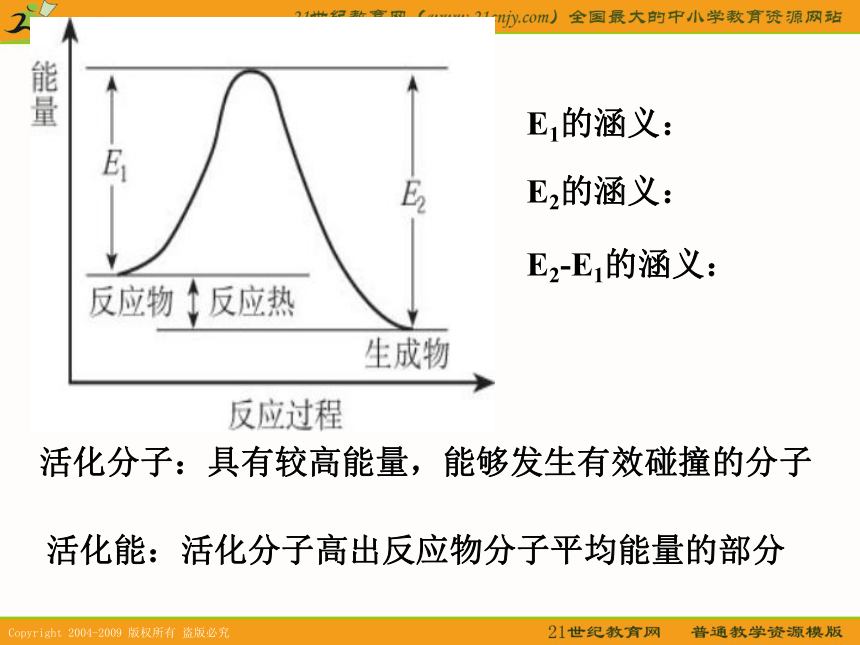
⑤其他因素:光、颗粒大小、溶剂等。一、有效碰撞模型1、假设:在一洁净的容器中,使氢气与氧气按体积比2:1的比例混合,气体分子因自由运动而不断发生碰撞,研究表明:如果在常温常压下每个氢分子、氧分子自身或它们之间的碰撞几率为2.355X1010次/秒。若每次碰撞都能发生反应的话,则化学反应瞬间即可完成。2、结论:并不是每次碰撞都能发生化学反应,只有其中的部分气体的碰撞能发生化学反应---有效碰撞(1)碰撞过轻??? (2)碰撞取向不好?(3)活化分子的有效碰撞? HI分子的几种可能的碰撞模式 活化分子:具有较高能量,能够发生有效碰撞的分子活化能:活化分子高出反应物分子平均能量的部分E1的涵义:E2的涵义:E2-E1的涵义:分子
运动分子具有
足够能量有合适的取向n活=n总×活%有效碰撞理论反应速率与活化分子的百分率(活%)成正比一、浓度对反应速率的影响浓度增大→单位体积内n总↑T不变,活%不变→有效碰撞↑→V↑1、在其他条件不变时,增大反应物浓度,可以增大反应速率实验2-2结论:浓度大的H2C2O4溶液先褪色2KMnO4 + 5H2C2O4 +3H2SO4=K2SO4 +2MnSO4 +10CO2↑+8H2O?应用2:
若将物质的量相等的HI气体分别放在等容积的两个针桶中,一个保持体积不变,另一个压缩为原来的1/2。其它条件不变,则HI的分解反应速率谁快??应用3:如反应:3KSCN+FeCl3 =Fe(SCN)3+3KCl
若在上述反应体系中加入KCl晶体,不会影响化学反应速率??应用1:
一定条件下,在CaCO3(块状)+2HCl=CaCl2+H2O+CO2?反应中,为了加快反应的速率,下列那些方法可行:
A、增加HCl的浓度 B、加水
C、增加同浓度盐酸的量 D、改加CaCO3粉末 2、应用举例压强增大 → 体积减小
其他条件不变→V↑1、其他条件不变,增大压强,气体体积缩小,浓度增大,反应速率加快二、压强对反应速率的影响2、注意点:P增大→C成比例增大,P减小→C成比例减小压强只对于有气体参加的反应的速率有影响压强对于反应速率的影响是通过对浓度的影响实现的 在N2+3H2 ? 2NH3中,当其他外界条件不变时
?减小体系压强,该反应的速率怎么变?
?在反应中保持体系容积不变,充入N2 ,反应的速率怎么变?
在反应中保持体系容积不变,充入He,反应的速率怎么变?
在反应中保持体系压强不变,充入He,反应的速率怎么变?3、应用举例三、温度对反应速率的影响实验2-3结论:温度高的溶液先出现浑浊Na2S2O3+H2SO4=Na2SO4+SO2+S↓+H2O1、其他条件不变,温度升高,反应速率加快T↑→普通分子变为活化分子→活%↑→ n活↑→V↑2、一般说来,温度每升高10℃,速率增加2-4倍。V×倍数值(t2-t1)/10 = 变化后的反应速率P24实验探究:例1、对于反应M+N→P,如果温度每升高10℃,反应速率增加为原来的3倍。在10℃时完成反应的10%需要54min,将温度提高到40℃完成反应的10%需要的时间为 ( ) A.2min B.3min C.6min D.9min3、应用举例2、把除去氧化膜的 Mg 条,投入到盛有稀盐酸的试管中,发现 H2 的产生速率(v)与时间(t)的变化情况如右图所示,
t1 ~ t2 速率变化的主要原因是: _______ ;
t2 ~ t3 速率变化的主要原因是:_________。四、催化剂对反应速率的影响实验2-4结论:加入催化剂可以加快反应的速率正催化剂→降低反应的活化能→V↑→活%↑
n总不变1、加入催化剂可以加快反应的速率?使用催化剂同等程度的增大(减慢)、正逆反应速率,从而改变反应到达平衡所需时间。
?没特别指明一般指正催化剂
?催化剂只能催化可能发生的反应,对不发生的反应无作用
?催化剂具有一定的选择性2、注意点科学探究:P25内因:物质本身的性质
外因:见表。 增大反应物的浓度使反应速率加快的主要原因( )
对于气体参与体系增大压强使反应速率加快的主要原因是( )
升高温度使反应速率加快的主要原因是( )
使用催化剂使反应速率加快的主要原因是( )
A、活化分子百分数不变,但提高单位体积内活化分子的总数
B、 增大分子的运动速率而使有效碰撞增加
C、 升高反应物分子的能量,使活化分子的百分数增加
D、降低反应所需的能量,使活化分子百分数增加AAC D练习1:下列说法正确的是( )
A、一定条件下,增大反应物的量会加快化学反应速率。
B、增大压强,肯定会加快化学反应速率。
C、活化分子间所发生的碰撞为有效碰撞。
D、能够发生有效碰撞的分子叫活化分子。D 在C(固)+CO2(气)=2CO(气) 的反应中。现采取下列措施:
(1)增大压强 ;(2)增加碳的量
(3)通入CO2; (4)恒容下充入N2;
(5)恒压下充入N2
哪些措施能够使反应速率增大?为什么? 答案:(1)(3)练习2:下列条件的变化,是因为降低反应所需的能量而增加单位体积内的反应物活化分子百分数致使反应速率加快的是( )
A、增大浓度 B、增大压强 C、升高温度 D、使用催化剂练习3:D练习4、一定量的盐酸跟过量的铁粉反应时,为了减慢反应速率,而不影响生成H2的总量,可向其中加入适量的( )
A、Na2CO3晶体 B、NaOH晶体
C、水 D、CH3COONa晶体C D5、将一定浓度的盐酸倒入碳酸钙中,若作如下改变的情况,其中能使最初的化学反应速率增大的是 ( )
A、盐酸的浓度不变,而使盐酸的用量一倍
B、盐酸的浓度增大一倍,而使盐酸的用量减少到原来的一半
C、盐酸的浓度和用量都不变,增加碳酸钙的量
D、盐酸和碳酸钙不变,增大压强一倍
E、加入CaCl2溶液
F、加入CaCl2固体
G、将CaCO3用CaCO3粉末代替BG2、硫代硫酸钠( Na2S2O3)与稀硫酸发生如下反应:Na2S2O3+H2SO4=Na2SO4+SO2+S↓+H2O 下列四种情况中最早出现浑浊的是: ( )
(1)10℃时0.1 mol /L Na2S2O3和0.1 mol /L H2SO4各 5 mL
(2)10℃时0.1 mol /L Na2S2O3和0.1 mol /L H2SO4 各5 mL,加水10mL
(3) 20℃ 时0.1 mol /L Na2S2O3和0.1 mol /L H2SO4各 5 mL
(4) 20℃ 时0.2mol /L Na2S2O3和0.1 mol /L H2SO4各5 mL,加水10 mLC谢谢
⑤其他因素:光、颗粒大小、溶剂等。一、有效碰撞模型1、假设:在一洁净的容器中,使氢气与氧气按体积比2:1的比例混合,气体分子因自由运动而不断发生碰撞,研究表明:如果在常温常压下每个氢分子、氧分子自身或它们之间的碰撞几率为2.355X1010次/秒。若每次碰撞都能发生反应的话,则化学反应瞬间即可完成。2、结论:并不是每次碰撞都能发生化学反应,只有其中的部分气体的碰撞能发生化学反应---有效碰撞(1)碰撞过轻??? (2)碰撞取向不好?(3)活化分子的有效碰撞? HI分子的几种可能的碰撞模式 活化分子:具有较高能量,能够发生有效碰撞的分子活化能:活化分子高出反应物分子平均能量的部分E1的涵义:E2的涵义:E2-E1的涵义:分子
运动分子具有
足够能量有合适的取向n活=n总×活%有效碰撞理论反应速率与活化分子的百分率(活%)成正比一、浓度对反应速率的影响浓度增大→单位体积内n总↑T不变,活%不变→有效碰撞↑→V↑1、在其他条件不变时,增大反应物浓度,可以增大反应速率实验2-2结论:浓度大的H2C2O4溶液先褪色2KMnO4 + 5H2C2O4 +3H2SO4=K2SO4 +2MnSO4 +10CO2↑+8H2O?应用2:
若将物质的量相等的HI气体分别放在等容积的两个针桶中,一个保持体积不变,另一个压缩为原来的1/2。其它条件不变,则HI的分解反应速率谁快??应用3:如反应:3KSCN+FeCl3 =Fe(SCN)3+3KCl
若在上述反应体系中加入KCl晶体,不会影响化学反应速率??应用1:
一定条件下,在CaCO3(块状)+2HCl=CaCl2+H2O+CO2?反应中,为了加快反应的速率,下列那些方法可行:
A、增加HCl的浓度 B、加水
C、增加同浓度盐酸的量 D、改加CaCO3粉末 2、应用举例压强增大 → 体积减小
其他条件不变→V↑1、其他条件不变,增大压强,气体体积缩小,浓度增大,反应速率加快二、压强对反应速率的影响2、注意点:P增大→C成比例增大,P减小→C成比例减小压强只对于有气体参加的反应的速率有影响压强对于反应速率的影响是通过对浓度的影响实现的 在N2+3H2 ? 2NH3中,当其他外界条件不变时
?减小体系压强,该反应的速率怎么变?
?在反应中保持体系容积不变,充入N2 ,反应的速率怎么变?
在反应中保持体系容积不变,充入He,反应的速率怎么变?
在反应中保持体系压强不变,充入He,反应的速率怎么变?3、应用举例三、温度对反应速率的影响实验2-3结论:温度高的溶液先出现浑浊Na2S2O3+H2SO4=Na2SO4+SO2+S↓+H2O1、其他条件不变,温度升高,反应速率加快T↑→普通分子变为活化分子→活%↑→ n活↑→V↑2、一般说来,温度每升高10℃,速率增加2-4倍。V×倍数值(t2-t1)/10 = 变化后的反应速率P24实验探究:例1、对于反应M+N→P,如果温度每升高10℃,反应速率增加为原来的3倍。在10℃时完成反应的10%需要54min,将温度提高到40℃完成反应的10%需要的时间为 ( ) A.2min B.3min C.6min D.9min3、应用举例2、把除去氧化膜的 Mg 条,投入到盛有稀盐酸的试管中,发现 H2 的产生速率(v)与时间(t)的变化情况如右图所示,
t1 ~ t2 速率变化的主要原因是: _______ ;
t2 ~ t3 速率变化的主要原因是:_________。四、催化剂对反应速率的影响实验2-4结论:加入催化剂可以加快反应的速率正催化剂→降低反应的活化能→V↑→活%↑
n总不变1、加入催化剂可以加快反应的速率?使用催化剂同等程度的增大(减慢)、正逆反应速率,从而改变反应到达平衡所需时间。
?没特别指明一般指正催化剂
?催化剂只能催化可能发生的反应,对不发生的反应无作用
?催化剂具有一定的选择性2、注意点科学探究:P25内因:物质本身的性质
外因:见表。 增大反应物的浓度使反应速率加快的主要原因( )
对于气体参与体系增大压强使反应速率加快的主要原因是( )
升高温度使反应速率加快的主要原因是( )
使用催化剂使反应速率加快的主要原因是( )
A、活化分子百分数不变,但提高单位体积内活化分子的总数
B、 增大分子的运动速率而使有效碰撞增加
C、 升高反应物分子的能量,使活化分子的百分数增加
D、降低反应所需的能量,使活化分子百分数增加AAC D练习1:下列说法正确的是( )
A、一定条件下,增大反应物的量会加快化学反应速率。
B、增大压强,肯定会加快化学反应速率。
C、活化分子间所发生的碰撞为有效碰撞。
D、能够发生有效碰撞的分子叫活化分子。D 在C(固)+CO2(气)=2CO(气) 的反应中。现采取下列措施:
(1)增大压强 ;(2)增加碳的量
(3)通入CO2; (4)恒容下充入N2;
(5)恒压下充入N2
哪些措施能够使反应速率增大?为什么? 答案:(1)(3)练习2:下列条件的变化,是因为降低反应所需的能量而增加单位体积内的反应物活化分子百分数致使反应速率加快的是( )
A、增大浓度 B、增大压强 C、升高温度 D、使用催化剂练习3:D练习4、一定量的盐酸跟过量的铁粉反应时,为了减慢反应速率,而不影响生成H2的总量,可向其中加入适量的( )
A、Na2CO3晶体 B、NaOH晶体
C、水 D、CH3COONa晶体C D5、将一定浓度的盐酸倒入碳酸钙中,若作如下改变的情况,其中能使最初的化学反应速率增大的是 ( )
A、盐酸的浓度不变,而使盐酸的用量一倍
B、盐酸的浓度增大一倍,而使盐酸的用量减少到原来的一半
C、盐酸的浓度和用量都不变,增加碳酸钙的量
D、盐酸和碳酸钙不变,增大压强一倍
E、加入CaCl2溶液
F、加入CaCl2固体
G、将CaCO3用CaCO3粉末代替BG2、硫代硫酸钠( Na2S2O3)与稀硫酸发生如下反应:Na2S2O3+H2SO4=Na2SO4+SO2+S↓+H2O 下列四种情况中最早出现浑浊的是: ( )
(1)10℃时0.1 mol /L Na2S2O3和0.1 mol /L H2SO4各 5 mL
(2)10℃时0.1 mol /L Na2S2O3和0.1 mol /L H2SO4 各5 mL,加水10mL
(3) 20℃ 时0.1 mol /L Na2S2O3和0.1 mol /L H2SO4各 5 mL
(4) 20℃ 时0.2mol /L Na2S2O3和0.1 mol /L H2SO4各5 mL,加水10 mLC谢谢
同课章节目录
