钠的重要化合物
图片预览

文档简介
本资料来自于资源最齐全的21世纪教育网www.21cnjy.com
《钠的重要化合物》教学设计
一、基本说明
1.教学内容所属模块:高中化学必修模块《化学1》
2.年级:高中一年级
3.所用教材出版单位:人民教育出版社
4.所属的章节:第三章第二节第一课时
二、教学设计
1.教学目标:
知识与技能:
1)掌握Na2O和Na2O2性质的异同。
2)掌握Na2CO3和NaHCO3性质的异同及二者之间的相互转化。
3)掌握焰色反应的实验操作方法及钠、钾的焰色。
过程与方法:
(1)学会运用实验、观察等获取科学事实的基本方法,研究物质的性质。
(2)初步学会运用:分类、比较、分析、归纳、演绎等整理科学事实的基本方法,学习物质的性质。
(3)学会学习和认识新化学物质的基本思路和方法。
情感、态度和价值观:
1)通过对钠的重要化合物的性质与用途的学习,使学生进一步认识化学在促进社会发展、改善人类的生活条件等方面所起到的重要作用,提高学习化学的兴趣,增强学好化学,服务社会的责任感和使命感。
2)通过实验和观察,激发学生学习化学的兴趣,培养学生乐于探究、合作学习的精神和实事求是的科学品质,体验探究的艰辛和喜悦,养成良好的科学方法和学习习惯。
2.内容分析:
本章《金属及其化合物》是在第一章《从实验学化学》(实验基础)和第二章《化学物质及其变化》(理论基础)的基础上开始具体的元素化合物的学习,元素化合物知识是中学化学的基础和核心知识,这些知识既可以为前面的实验和理论知识补充感性认识的材料,又可以为必修2的物质结构、元素周期律等理论知识打下重要的基础;也可以帮助学生逐步掌握学习化学的一些基本方法;还能使学生正真认识化学在促进社会发展、改善人类的生活条件等方面所起到的重要作用。
钠的重要化合物的学习,就是要让学生认识Na2O2、Na2CO3和NaHCO3,知道它们有什么用处,能为我所用。加深巩固钠的知识,为其他重要金属、非金属元素及其化合物的学习奠定基础,故本节教材具有承上启下的作用。
3.学情分析:
在初中学生已经接触了碳酸钠、氯化钠、氢氧化钠等物质,为钠的化合物的学习奠定了一定的基础。
4.设计思路:
本教学设计力求体现元素化合物课型教学的三大要素:
(1)生活与应用(从自然到化学,从化学到社会生活);
(2)学法指导(学习元素化合物的基本方法);
(3)实验探究(利用实验创设情境,激发兴趣,启动思维)。
5.教学方法:创设情境 实验探究 问题探究 反思归纳
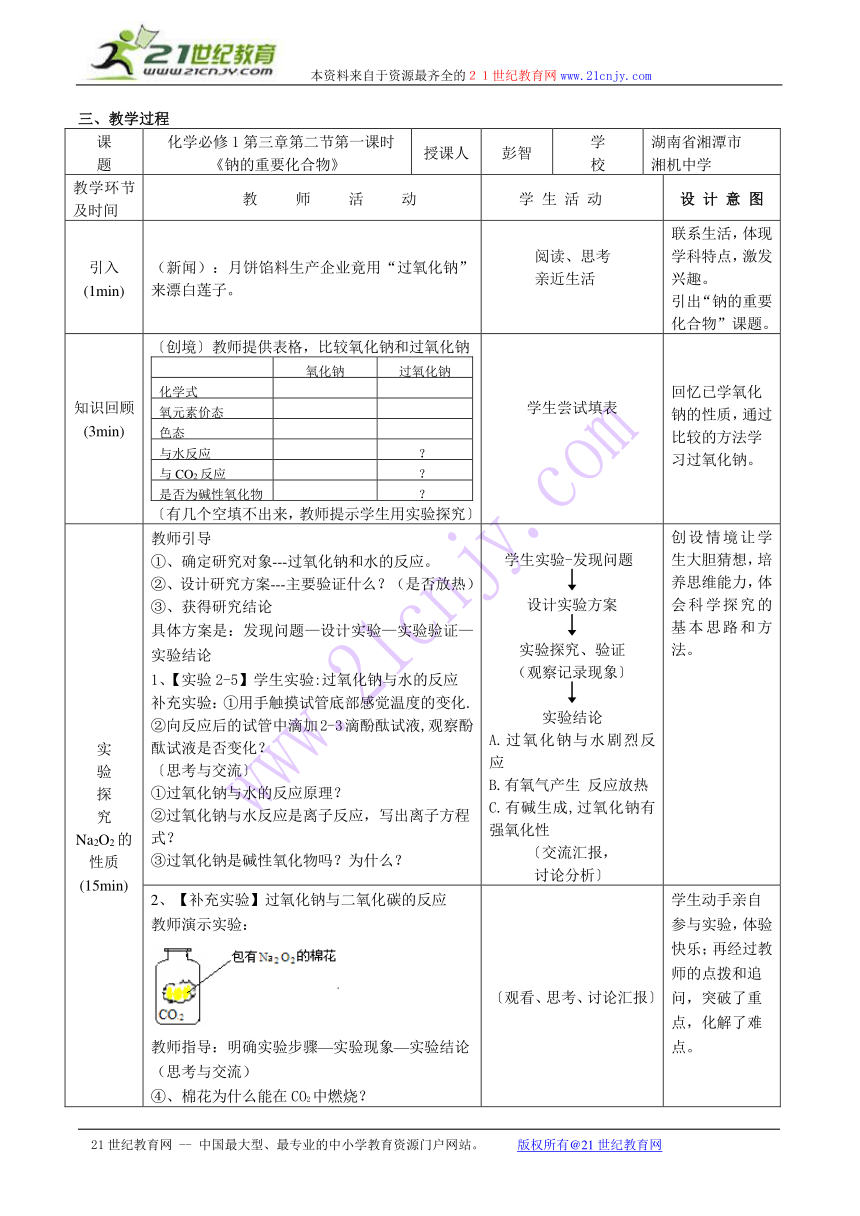
三、教学过程
课题 化学必修1第三章第二节第一课时《钠的重要化合物》 授课人 彭智 学校 湖南省湘潭市湘机中学
教学环节及时间 教 师 活 动 学 生 活 动 设 计 意 图
引入(1min) (新闻):月饼馅料生产企业竟用“过氧化钠”来漂白莲子。 阅读、思考亲近生活 联系生活,体现学科特点,激发兴趣。引出“钠的重要化合物”课题。
知识回顾(3min) 〔创境〕教师提供表格,比较氧化钠和过氧化钠氧化钠过氧化钠化学式氧元素价态色态与水反应?与CO2反应?是否为碱性氧化物?〔有几个空填不出来,教师提示学生用实验探究〕 学生尝试填表 回忆已学氧化钠的性质,通过比较的方法学习过氧化钠。
实验探究Na2O2的性质(15min) 教师引导①、确定研究对象---过氧化钠和水的反应。②、设计研究方案---主要验证什么?(是否放热)③、获得研究结论具体方案是:发现问题—设计实验—实验验证—实验结论1、【实验2-5】学生实验:过氧化钠与水的反应补充实验:①用手触摸试管底部感觉温度的变化.②向反应后的试管中滴加2-3滴酚酞试液,观察酚酞试液是否变化?〔思考与交流〕①过氧化钠与水的反应原理?②过氧化钠与水反应是离子反应,写出离子方程式?③过氧化钠是碱性氧化物吗?为什么? 学生实验-发现问题 设计实验方案实验探究、验证(观察记录现象〕实验结论A.过氧化钠与水剧烈反应B.有氧气产生 反应放热C.有碱生成,过氧化钠有强氧化性〔交流汇报,讨论分析〕 创设情境让学生大胆猜想,培养思维能力,体会科学探究的基本思路和方法。
2、【补充实验】过氧化钠与二氧化碳的反应教师演示实验:教师指导:明确实验步骤—实验现象—实验结论(思考与交流)④、棉花为什么能在CO2中燃烧?⑤、尝试书写该反应的化学方程式?⑥、过氧化钠极易与水、二氧化碳反应,在实验室如何保存过氧化钠呢?生活中过氧化钠有什么用途?⑦二氧化碳与过氧化钠的反应是氧化还原反应吗?化合价如何变化?标出电子转移的情况。 〔观看、思考、讨论汇报〕 学生动手亲自参与实验,体验快乐;再经过教师的点拨和追问,突破了重点,化解了难点。
讲述(1min) 〔过渡、设疑〕请同学展示你家厨房的用品“纯碱”“小苏打”(课前布置的作业),教师故意打乱包装后问,你现在知道哪一包是纯碱,哪一包是小苏打吗?为什么区分不出了? 学生展示 通过设问,激发学生学习新知识的欲望
实验探究Na2CO3与NaHCO3的性质(15min) 自主学习课本P56科学探究——碳酸钠和碳酸氢钠的性质(学生分组实验)教师指导:阅读课本—动手实验—现象记录—实验结论【科学探究1】碳酸钠和碳酸氢钠的水溶性步 骤1g碳酸钠1g碳酸氢钠样品外观①加1mL水②加10mL水③加2滴酚酞溶液初步结论比较【科学探究2】碳酸钠和碳酸氢钠的热稳定性Na2CO3NaHCO3现象化学方程式——初步结论比较【补充实验】在两根试管中分别加入2mL稀盐酸,将等量(1/3药匙)的碳酸钠和碳酸氢钠加入试管中。问题1:碳酸钠、碳酸氢钠与酸的反应是离子反应,写出它们的离子方程式?问题2:为什么碳酸钠与酸反应更慢?从微观上如何解释?〔多媒体动画〕碳酸根离子与氢离子反应的过程Na2CO3NaHCO3现象反应的化学方程式离子方程式(教师归纳):①均可溶于水;溶解性:Na2CO3 > NaHCO3 ②碱性:Na2CO3 > NaHCO3③热稳定性:Na2CO3 > NaHCO3(NaHCO3受热易分解)④Na2CO3和NaHCO3都能与稀盐酸剧烈反应,但碳酸氢钠与稀盐酸反应更剧烈。(解疑):你有办法能把这两包白色粉末(Na2CO3 >和NaHCO3)区分开吗? 〔阅读,思考,实验〕记录实验现象讨论实验结论〔自主归纳、教师点拨〕各小组长发言,相互补充作答学生思考回答(学生尽可能说出他们的方法,教师及时给予评价) 培养学生的实验观察能力、动手能力、进行科学探究的严谨态度。首尾呼应。学生通过自己实验探究,知识整合,教师点拨,能够轻松解疑,让学生有喜悦感和成就感。
学以致用反思提升(8min) 你是否能解释下列现象:水下幽灵——潜艇,在海底航行时,工作人员呼出的CO2到哪里去了吗?为什么NaHCO3可以用来发酵面包? 叫学生个别作答,并剖析原因。 及时练习,巩固知识,感受学习化学是很有用的。
〔拓展提升〕CO2能使浑浊的石灰水变澄清: CaCO3+CO2+H2O=Ca(HCO3)2,将CO2通入Na2CO3溶液也会发生类似反应,你能写出反应的化学方程式吗?如何除去NaHCO3溶液中混有的Na2CO3 ? 如何除去Na2CO3固体中混有的NaHCO3?3、下列有关Na2CO3 和 NaHCO3的说法正确的是 A. 在水中溶解性: Na2CO3 < NaHCO3 B. 二者都能与酸反应生成CO2 C. 热稳定性: Na2CO3 < NaHCO3 D. 二者在相同条件下可相互转化 学生独立思考作答 拓展练习,比较甄别,加深理解,完善知识结构的能力。
课堂小结(2min) 通过本节课的学习,你有什么收获和迷惑?(教师适时适度点拨) 学生自主归纳总结,然后交流汇报 反馈“三维目标”的落实情况,合作交流,分享成果,升华课堂。
作业布置 ①完成课本62—63页的1、4、13题②阅读课本,预习下节课内容 课后独立完成 巩固所学知识,反馈教学情况,培养预习习惯
四、板书设计
钠的重要化合物
一、过氧化钠Na2O2
淡黄色固体
与水的反应2Na2O2+2H2O=4NaOH+O2↑
与二氧化碳的反应2Na2O2+2CO2=2Na2CO3+O2
二、碳酸钠和碳酸氢钠
溶解性比较:Na2CO3较NaHCO3 易溶于水
稳定性比较: 2NaHCO3 Na2CO3+CO2↑+H2O
与酸反应: 碳酸钠 CO32-+2H+=CO2↑+H2O
碳酸氢钠 HCO3-+H+=CO2↑+H2O
五、教学反思
本节内容的教学对教材稍作处理,把焰色反应的知识作为一节实验课进行教学。所以本节课力求解决的就是对Na2O2、Na2CO3和NaHCO3性质的学习,初步掌握学习元素化合物的基本方法。通过学生分组实验探究、讨论,联系生活实际,感受学习的乐趣,大部分学生能够较轻松的学习本节内容,掌握知识。
21世纪教育网 -- 中国最大型、最专业的中小学教育资源门户网站。 版权所有@21世纪教育网
《钠的重要化合物》教学设计
一、基本说明
1.教学内容所属模块:高中化学必修模块《化学1》
2.年级:高中一年级
3.所用教材出版单位:人民教育出版社
4.所属的章节:第三章第二节第一课时
二、教学设计
1.教学目标:
知识与技能:
1)掌握Na2O和Na2O2性质的异同。
2)掌握Na2CO3和NaHCO3性质的异同及二者之间的相互转化。
3)掌握焰色反应的实验操作方法及钠、钾的焰色。
过程与方法:
(1)学会运用实验、观察等获取科学事实的基本方法,研究物质的性质。
(2)初步学会运用:分类、比较、分析、归纳、演绎等整理科学事实的基本方法,学习物质的性质。
(3)学会学习和认识新化学物质的基本思路和方法。
情感、态度和价值观:
1)通过对钠的重要化合物的性质与用途的学习,使学生进一步认识化学在促进社会发展、改善人类的生活条件等方面所起到的重要作用,提高学习化学的兴趣,增强学好化学,服务社会的责任感和使命感。
2)通过实验和观察,激发学生学习化学的兴趣,培养学生乐于探究、合作学习的精神和实事求是的科学品质,体验探究的艰辛和喜悦,养成良好的科学方法和学习习惯。
2.内容分析:
本章《金属及其化合物》是在第一章《从实验学化学》(实验基础)和第二章《化学物质及其变化》(理论基础)的基础上开始具体的元素化合物的学习,元素化合物知识是中学化学的基础和核心知识,这些知识既可以为前面的实验和理论知识补充感性认识的材料,又可以为必修2的物质结构、元素周期律等理论知识打下重要的基础;也可以帮助学生逐步掌握学习化学的一些基本方法;还能使学生正真认识化学在促进社会发展、改善人类的生活条件等方面所起到的重要作用。
钠的重要化合物的学习,就是要让学生认识Na2O2、Na2CO3和NaHCO3,知道它们有什么用处,能为我所用。加深巩固钠的知识,为其他重要金属、非金属元素及其化合物的学习奠定基础,故本节教材具有承上启下的作用。
3.学情分析:
在初中学生已经接触了碳酸钠、氯化钠、氢氧化钠等物质,为钠的化合物的学习奠定了一定的基础。
4.设计思路:
本教学设计力求体现元素化合物课型教学的三大要素:
(1)生活与应用(从自然到化学,从化学到社会生活);
(2)学法指导(学习元素化合物的基本方法);
(3)实验探究(利用实验创设情境,激发兴趣,启动思维)。
5.教学方法:创设情境 实验探究 问题探究 反思归纳
三、教学过程
课题 化学必修1第三章第二节第一课时《钠的重要化合物》 授课人 彭智 学校 湖南省湘潭市湘机中学
教学环节及时间 教 师 活 动 学 生 活 动 设 计 意 图
引入(1min) (新闻):月饼馅料生产企业竟用“过氧化钠”来漂白莲子。 阅读、思考亲近生活 联系生活,体现学科特点,激发兴趣。引出“钠的重要化合物”课题。
知识回顾(3min) 〔创境〕教师提供表格,比较氧化钠和过氧化钠氧化钠过氧化钠化学式氧元素价态色态与水反应?与CO2反应?是否为碱性氧化物?〔有几个空填不出来,教师提示学生用实验探究〕 学生尝试填表 回忆已学氧化钠的性质,通过比较的方法学习过氧化钠。
实验探究Na2O2的性质(15min) 教师引导①、确定研究对象---过氧化钠和水的反应。②、设计研究方案---主要验证什么?(是否放热)③、获得研究结论具体方案是:发现问题—设计实验—实验验证—实验结论1、【实验2-5】学生实验:过氧化钠与水的反应补充实验:①用手触摸试管底部感觉温度的变化.②向反应后的试管中滴加2-3滴酚酞试液,观察酚酞试液是否变化?〔思考与交流〕①过氧化钠与水的反应原理?②过氧化钠与水反应是离子反应,写出离子方程式?③过氧化钠是碱性氧化物吗?为什么? 学生实验-发现问题 设计实验方案实验探究、验证(观察记录现象〕实验结论A.过氧化钠与水剧烈反应B.有氧气产生 反应放热C.有碱生成,过氧化钠有强氧化性〔交流汇报,讨论分析〕 创设情境让学生大胆猜想,培养思维能力,体会科学探究的基本思路和方法。
2、【补充实验】过氧化钠与二氧化碳的反应教师演示实验:教师指导:明确实验步骤—实验现象—实验结论(思考与交流)④、棉花为什么能在CO2中燃烧?⑤、尝试书写该反应的化学方程式?⑥、过氧化钠极易与水、二氧化碳反应,在实验室如何保存过氧化钠呢?生活中过氧化钠有什么用途?⑦二氧化碳与过氧化钠的反应是氧化还原反应吗?化合价如何变化?标出电子转移的情况。 〔观看、思考、讨论汇报〕 学生动手亲自参与实验,体验快乐;再经过教师的点拨和追问,突破了重点,化解了难点。
讲述(1min) 〔过渡、设疑〕请同学展示你家厨房的用品“纯碱”“小苏打”(课前布置的作业),教师故意打乱包装后问,你现在知道哪一包是纯碱,哪一包是小苏打吗?为什么区分不出了? 学生展示 通过设问,激发学生学习新知识的欲望
实验探究Na2CO3与NaHCO3的性质(15min) 自主学习课本P56科学探究——碳酸钠和碳酸氢钠的性质(学生分组实验)教师指导:阅读课本—动手实验—现象记录—实验结论【科学探究1】碳酸钠和碳酸氢钠的水溶性步 骤1g碳酸钠1g碳酸氢钠样品外观①加1mL水②加10mL水③加2滴酚酞溶液初步结论比较【科学探究2】碳酸钠和碳酸氢钠的热稳定性Na2CO3NaHCO3现象化学方程式——初步结论比较【补充实验】在两根试管中分别加入2mL稀盐酸,将等量(1/3药匙)的碳酸钠和碳酸氢钠加入试管中。问题1:碳酸钠、碳酸氢钠与酸的反应是离子反应,写出它们的离子方程式?问题2:为什么碳酸钠与酸反应更慢?从微观上如何解释?〔多媒体动画〕碳酸根离子与氢离子反应的过程Na2CO3NaHCO3现象反应的化学方程式离子方程式(教师归纳):①均可溶于水;溶解性:Na2CO3 > NaHCO3 ②碱性:Na2CO3 > NaHCO3③热稳定性:Na2CO3 > NaHCO3(NaHCO3受热易分解)④Na2CO3和NaHCO3都能与稀盐酸剧烈反应,但碳酸氢钠与稀盐酸反应更剧烈。(解疑):你有办法能把这两包白色粉末(Na2CO3 >和NaHCO3)区分开吗? 〔阅读,思考,实验〕记录实验现象讨论实验结论〔自主归纳、教师点拨〕各小组长发言,相互补充作答学生思考回答(学生尽可能说出他们的方法,教师及时给予评价) 培养学生的实验观察能力、动手能力、进行科学探究的严谨态度。首尾呼应。学生通过自己实验探究,知识整合,教师点拨,能够轻松解疑,让学生有喜悦感和成就感。
学以致用反思提升(8min) 你是否能解释下列现象:水下幽灵——潜艇,在海底航行时,工作人员呼出的CO2到哪里去了吗?为什么NaHCO3可以用来发酵面包? 叫学生个别作答,并剖析原因。 及时练习,巩固知识,感受学习化学是很有用的。
〔拓展提升〕CO2能使浑浊的石灰水变澄清: CaCO3+CO2+H2O=Ca(HCO3)2,将CO2通入Na2CO3溶液也会发生类似反应,你能写出反应的化学方程式吗?如何除去NaHCO3溶液中混有的Na2CO3 ? 如何除去Na2CO3固体中混有的NaHCO3?3、下列有关Na2CO3 和 NaHCO3的说法正确的是 A. 在水中溶解性: Na2CO3 < NaHCO3 B. 二者都能与酸反应生成CO2 C. 热稳定性: Na2CO3 < NaHCO3 D. 二者在相同条件下可相互转化 学生独立思考作答 拓展练习,比较甄别,加深理解,完善知识结构的能力。
课堂小结(2min) 通过本节课的学习,你有什么收获和迷惑?(教师适时适度点拨) 学生自主归纳总结,然后交流汇报 反馈“三维目标”的落实情况,合作交流,分享成果,升华课堂。
作业布置 ①完成课本62—63页的1、4、13题②阅读课本,预习下节课内容 课后独立完成 巩固所学知识,反馈教学情况,培养预习习惯
四、板书设计
钠的重要化合物
一、过氧化钠Na2O2
淡黄色固体
与水的反应2Na2O2+2H2O=4NaOH+O2↑
与二氧化碳的反应2Na2O2+2CO2=2Na2CO3+O2
二、碳酸钠和碳酸氢钠
溶解性比较:Na2CO3较NaHCO3 易溶于水
稳定性比较: 2NaHCO3 Na2CO3+CO2↑+H2O
与酸反应: 碳酸钠 CO32-+2H+=CO2↑+H2O
碳酸氢钠 HCO3-+H+=CO2↑+H2O
五、教学反思
本节内容的教学对教材稍作处理,把焰色反应的知识作为一节实验课进行教学。所以本节课力求解决的就是对Na2O2、Na2CO3和NaHCO3性质的学习,初步掌握学习元素化合物的基本方法。通过学生分组实验探究、讨论,联系生活实际,感受学习的乐趣,大部分学生能够较轻松的学习本节内容,掌握知识。
21世纪教育网 -- 中国最大型、最专业的中小学教育资源门户网站。 版权所有@21世纪教育网
