金属的腐蚀
图片预览


文档简介
本资料来自于资源最齐全的21世纪教育网www.21cnjy.com
《金属的腐蚀》教学设计
一、基本说明
1.教学内容所属模块:《选修1化学与生活》
2.年级:高二年级
3.所用教材出版单位:普通高中标准实验教科书(人教版)
4.所属章节:第三章第二节 金属的腐蚀和防护
二、教学设计
1. 教学目标:
知识与技能:
(1)了解金属腐蚀的危害。
(2)通过实验探究了解金属发生电化学腐蚀的原理。
(3)让学生学会观察实验,分析现象和问题,思考原因。
过程与方法:
通过问题讨论和实验探究的过程,了解化学研究的一般方法,初步形成分析推理,综合归纳能力。
情感态度与价值观:
培养学生勇于实践,乐于探索的科学素养;提高学生珍惜资源,保护环境的科学意识。
2. 内容分析
教学重点:金属的电化学腐蚀。
教学难点:金属的吸氧腐蚀的电化学原理。
本节是在必修2原电池的基础上,引导学生了解金属的腐蚀原理和防护方法等。
本节包括两部分内容:金属的腐蚀和金属的防护,属于化学学科的基础知识。
课程标准对这部分内容的要求比较低,教学过程中要准确把握教学要求,不宜加深和拓宽。
根据具体情况设计教学活动,宗旨是扩大学生的视野,提高学生的观察、分析能力,培养学生学习化学的兴趣,懂得运用化学知识和方法合理开发和利用资源,为学生直接参加工农业生产,更好的使用金属制品做好知识和思想准备。
3. 学情分析
高二学生对金属的知识已经学过很多,而且思维活跃,观察和总结能力比高一有所提高,我充分利用他们对实物和生活实际感兴趣的心理特征激发他们的学习热情,设计有利于他们自主学习和创造的化学学习情境,让他们去观察、去透过表象看到事物的本质,并探索出规律来,在“做科学”的实践中逐步形成终身学习的习惯和能力。
4. 设计思路
为了更好的实现教学目标,本节课准备包括探究法、谈话法、讨论法等在内的过程式教学方法。结合本教材的特点及所设计的教学方法,指导学生用“发现”的方法开展学习活动,在实际开展教学活动时我力求把教师的讲授转变为启发诱导,把学生的被动接受转化为主动探索,以教师为主导,学生为主体,促使学生动眼看、动手做、动口说、动脑想,使学生的学习过程和认识过程统一为一个整体。
三、教学过程
教学环节 教学过程 教学意图
以图片展示形式引入新课 让学生了解生活中存在的现象
提出问题 这些金属的表面怎么了? 让学生从感性上知道金属腐蚀是怎么回事
学生阅读并回答问题 1.什么是金属的腐蚀?2.金属为什么会被腐蚀?3.金属的腐蚀方式有哪些?4.这两种腐蚀方式有什么不同? 让学生有针对性的阅读教材,学会自己解决问题
学生回答 1.金属的腐蚀:金属跟接触到的物质进行化学反应而腐蚀损耗的过程。2.金属较活泼,易被氧化剂氧化 。3.金属腐蚀的方式有:化学腐蚀和电化学腐蚀两种。 提高学生的总结能力
教师边总结边板书 一、金属的腐蚀1.定义:2.金属腐蚀的本质:金属的还原性M-ne-=Mn+3.金属腐蚀方式:化学腐蚀 直接发生氧化还原反应电化学腐蚀 通过形成原电池发生氧化还原反应 使知识条例化
提问 发生电化学腐蚀的原因? 让学生能够对原电池知识学以致用
学生回答 金属不纯,含有杂质,能够形成原电池的两个电极
提出问题 为什么我们生活中一些发生腐蚀现象有的很快,有些却很慢呢?它们的腐蚀速率和那些因素有关呢? 引出新的探讨
学生回答 对于化学腐蚀应该主要受到温度的影响。而对于电化学腐蚀而言还会受到所处环境的电解质溶液的影响。
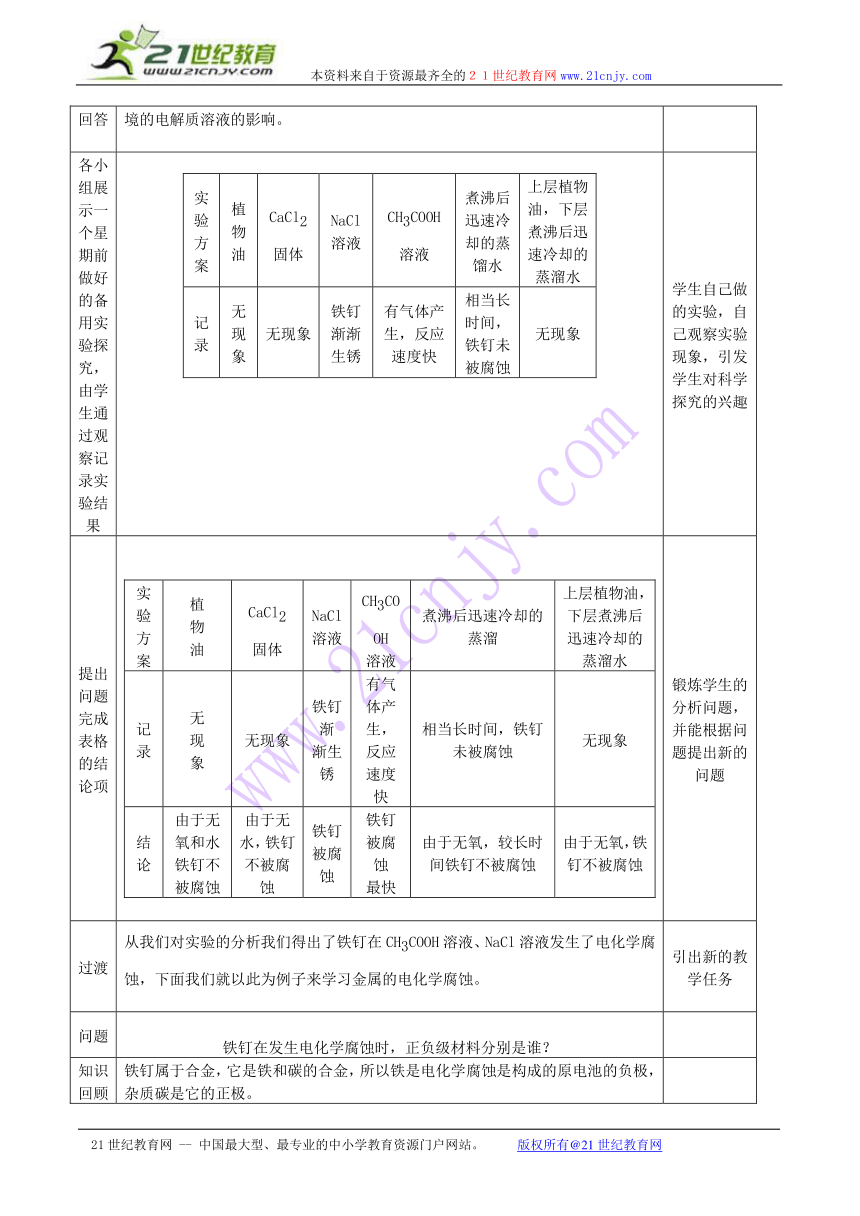
各小组展示一个星期前做好的备用实验探究,由学生通过观察记录实验结果 实验方案植物油CaCl2固体NaCl溶液CH3COOH溶液煮沸后迅速冷却的蒸馏水上层植物油,下层煮沸后迅速冷却的蒸溜水记录无现象无现象铁钉渐渐生锈有气体产生,反应速度快相当长时间,铁钉未被腐蚀无现象 学生自己做的实验,自己观察实验现象,引发学生对科学探究的兴趣
提出问题完成表格的结论项 实验方案植物油CaCl2固体NaCl溶液CH3COOH溶液煮沸后迅速冷却的蒸溜上层植物油,下层煮沸后迅速冷却的蒸溜水记录无现象无现象铁钉渐渐生锈有气体产生,反应速度快相当长时间,铁钉未被腐蚀无现象结论由于无氧和水铁钉不被腐蚀由于无水,铁钉不被腐蚀铁钉被腐蚀铁钉被腐蚀最快由于无氧,较长时间铁钉不被腐蚀由于无氧,铁钉不被腐蚀 锻炼学生的分析问题,并能根据问题提出新的问题
过渡 从我们对实验的分析我们得出了铁钉在CH3COOH溶液、NaCl溶液发生了电化学腐蚀,下面我们就以此为例子来学习金属的电化学腐蚀。 引出新的教学任务
问题 铁钉在发生电化学腐蚀时,正负级材料分别是谁?
知识回顾并回答 铁钉属于合金,它是铁和碳的合金,所以铁是电化学腐蚀是构成的原电池的负极,杂质碳是它的正极。
学生思考 请大家根据原电池知识写出在醋酸溶液中铁钉的正负极的电极反应方程式。 学生自主思考
板书 醋酸溶液溶液中铁钉的电化学腐蚀(析氢腐蚀):负极(铁): Fe–2e-=Fe2+ 正极(杂质碳):2H++2e-=H2↑
微观展示铁钉的析氢腐蚀 使学生从微观的角度了解析氢腐蚀的实质
过渡 那在 NaCl溶液中这两个电极上的反应又是怎样的呢?
学生思考后回答,教师板书 NaCl溶液中铁钉发生电化学腐蚀(吸氧腐蚀):负极(铁): 2Fe–4e-=2Fe2+ 正极(杂质碳):O2+2H2O+4e-=4OH-
微观展示铁钉的吸氧腐蚀 使学生从微观的角度了解吸氧腐蚀的实质
说明 除了钢铁这种合金可以发生析氢腐蚀和吸氧腐蚀外,其他的金属也可以发生类似的腐蚀,如铜在空气中就是发生的吸氧腐蚀,而且很多情况下吸氧腐蚀和析氢腐蚀是同时发生的。 让学生更全面的了解电化学腐蚀。
小结 析氢腐蚀吸氧腐蚀条件水膜呈酸性水膜呈中性或酸性很弱。电极反应负极Fe(- )正极C(+)总反应:Fe-2e-=Fe2+2H++2e-=H2↑Fe+2H+=Fe2++ H2 ↑2Fe-4e-=2Fe2+O2+2H2O+4e-=4OH-2Fe+2H2O+O2= 2 Fe(OH)24Fe(OH)2+2H2O+O2=4Fe(OH)3Fe2O3 · nH2O铁锈联系通常两种腐蚀同时存在,但后者更普遍。 加强对本节知识的巩固
作业 在潮湿的空气里镀层破坏后,马口铁(镀锡)比白铁(镀锌)更易腐蚀,解释原因并写出反应式。 巩固知识
板书设计
一、金属的腐蚀
1.定义:
2.金属腐蚀的本质:金属的还原性
M-ne-=Mn+
3.金属腐蚀方式:
化学腐蚀 直接发生氧化还原反应
电化学腐蚀 通过形成原电池发生氧化还原反应
析氢腐蚀(水膜呈酸性):负极(铁): Fe–2e-=Fe2+
正极(杂质碳):2H++2e-=H2↑
吸氧腐蚀(水膜呈中性或酸性很弱):
负极(铁): 2Fe–4e-=2Fe2+
正极(杂质碳):O2+2H2O+4e-=4OH—
教学反思:本堂课突破了教学难点,突出了教学重点,完成了教学目标;采用了探究学习的方法,充分发挥了学生的学习自主性,为下个课时金属的防护奠定了理论基础。
21世纪教育网 -- 中国最大型、最专业的中小学教育资源门户网站。 版权所有@21世纪教育网
《金属的腐蚀》教学设计
一、基本说明
1.教学内容所属模块:《选修1化学与生活》
2.年级:高二年级
3.所用教材出版单位:普通高中标准实验教科书(人教版)
4.所属章节:第三章第二节 金属的腐蚀和防护
二、教学设计
1. 教学目标:
知识与技能:
(1)了解金属腐蚀的危害。
(2)通过实验探究了解金属发生电化学腐蚀的原理。
(3)让学生学会观察实验,分析现象和问题,思考原因。
过程与方法:
通过问题讨论和实验探究的过程,了解化学研究的一般方法,初步形成分析推理,综合归纳能力。
情感态度与价值观:
培养学生勇于实践,乐于探索的科学素养;提高学生珍惜资源,保护环境的科学意识。
2. 内容分析
教学重点:金属的电化学腐蚀。
教学难点:金属的吸氧腐蚀的电化学原理。
本节是在必修2原电池的基础上,引导学生了解金属的腐蚀原理和防护方法等。
本节包括两部分内容:金属的腐蚀和金属的防护,属于化学学科的基础知识。
课程标准对这部分内容的要求比较低,教学过程中要准确把握教学要求,不宜加深和拓宽。
根据具体情况设计教学活动,宗旨是扩大学生的视野,提高学生的观察、分析能力,培养学生学习化学的兴趣,懂得运用化学知识和方法合理开发和利用资源,为学生直接参加工农业生产,更好的使用金属制品做好知识和思想准备。
3. 学情分析
高二学生对金属的知识已经学过很多,而且思维活跃,观察和总结能力比高一有所提高,我充分利用他们对实物和生活实际感兴趣的心理特征激发他们的学习热情,设计有利于他们自主学习和创造的化学学习情境,让他们去观察、去透过表象看到事物的本质,并探索出规律来,在“做科学”的实践中逐步形成终身学习的习惯和能力。
4. 设计思路
为了更好的实现教学目标,本节课准备包括探究法、谈话法、讨论法等在内的过程式教学方法。结合本教材的特点及所设计的教学方法,指导学生用“发现”的方法开展学习活动,在实际开展教学活动时我力求把教师的讲授转变为启发诱导,把学生的被动接受转化为主动探索,以教师为主导,学生为主体,促使学生动眼看、动手做、动口说、动脑想,使学生的学习过程和认识过程统一为一个整体。
三、教学过程
教学环节 教学过程 教学意图
以图片展示形式引入新课 让学生了解生活中存在的现象
提出问题 这些金属的表面怎么了? 让学生从感性上知道金属腐蚀是怎么回事
学生阅读并回答问题 1.什么是金属的腐蚀?2.金属为什么会被腐蚀?3.金属的腐蚀方式有哪些?4.这两种腐蚀方式有什么不同? 让学生有针对性的阅读教材,学会自己解决问题
学生回答 1.金属的腐蚀:金属跟接触到的物质进行化学反应而腐蚀损耗的过程。2.金属较活泼,易被氧化剂氧化 。3.金属腐蚀的方式有:化学腐蚀和电化学腐蚀两种。 提高学生的总结能力
教师边总结边板书 一、金属的腐蚀1.定义:2.金属腐蚀的本质:金属的还原性M-ne-=Mn+3.金属腐蚀方式:化学腐蚀 直接发生氧化还原反应电化学腐蚀 通过形成原电池发生氧化还原反应 使知识条例化
提问 发生电化学腐蚀的原因? 让学生能够对原电池知识学以致用
学生回答 金属不纯,含有杂质,能够形成原电池的两个电极
提出问题 为什么我们生活中一些发生腐蚀现象有的很快,有些却很慢呢?它们的腐蚀速率和那些因素有关呢? 引出新的探讨
学生回答 对于化学腐蚀应该主要受到温度的影响。而对于电化学腐蚀而言还会受到所处环境的电解质溶液的影响。
各小组展示一个星期前做好的备用实验探究,由学生通过观察记录实验结果 实验方案植物油CaCl2固体NaCl溶液CH3COOH溶液煮沸后迅速冷却的蒸馏水上层植物油,下层煮沸后迅速冷却的蒸溜水记录无现象无现象铁钉渐渐生锈有气体产生,反应速度快相当长时间,铁钉未被腐蚀无现象 学生自己做的实验,自己观察实验现象,引发学生对科学探究的兴趣
提出问题完成表格的结论项 实验方案植物油CaCl2固体NaCl溶液CH3COOH溶液煮沸后迅速冷却的蒸溜上层植物油,下层煮沸后迅速冷却的蒸溜水记录无现象无现象铁钉渐渐生锈有气体产生,反应速度快相当长时间,铁钉未被腐蚀无现象结论由于无氧和水铁钉不被腐蚀由于无水,铁钉不被腐蚀铁钉被腐蚀铁钉被腐蚀最快由于无氧,较长时间铁钉不被腐蚀由于无氧,铁钉不被腐蚀 锻炼学生的分析问题,并能根据问题提出新的问题
过渡 从我们对实验的分析我们得出了铁钉在CH3COOH溶液、NaCl溶液发生了电化学腐蚀,下面我们就以此为例子来学习金属的电化学腐蚀。 引出新的教学任务
问题 铁钉在发生电化学腐蚀时,正负级材料分别是谁?
知识回顾并回答 铁钉属于合金,它是铁和碳的合金,所以铁是电化学腐蚀是构成的原电池的负极,杂质碳是它的正极。
学生思考 请大家根据原电池知识写出在醋酸溶液中铁钉的正负极的电极反应方程式。 学生自主思考
板书 醋酸溶液溶液中铁钉的电化学腐蚀(析氢腐蚀):负极(铁): Fe–2e-=Fe2+ 正极(杂质碳):2H++2e-=H2↑
微观展示铁钉的析氢腐蚀 使学生从微观的角度了解析氢腐蚀的实质
过渡 那在 NaCl溶液中这两个电极上的反应又是怎样的呢?
学生思考后回答,教师板书 NaCl溶液中铁钉发生电化学腐蚀(吸氧腐蚀):负极(铁): 2Fe–4e-=2Fe2+ 正极(杂质碳):O2+2H2O+4e-=4OH-
微观展示铁钉的吸氧腐蚀 使学生从微观的角度了解吸氧腐蚀的实质
说明 除了钢铁这种合金可以发生析氢腐蚀和吸氧腐蚀外,其他的金属也可以发生类似的腐蚀,如铜在空气中就是发生的吸氧腐蚀,而且很多情况下吸氧腐蚀和析氢腐蚀是同时发生的。 让学生更全面的了解电化学腐蚀。
小结 析氢腐蚀吸氧腐蚀条件水膜呈酸性水膜呈中性或酸性很弱。电极反应负极Fe(- )正极C(+)总反应:Fe-2e-=Fe2+2H++2e-=H2↑Fe+2H+=Fe2++ H2 ↑2Fe-4e-=2Fe2+O2+2H2O+4e-=4OH-2Fe+2H2O+O2= 2 Fe(OH)24Fe(OH)2+2H2O+O2=4Fe(OH)3Fe2O3 · nH2O铁锈联系通常两种腐蚀同时存在,但后者更普遍。 加强对本节知识的巩固
作业 在潮湿的空气里镀层破坏后,马口铁(镀锡)比白铁(镀锌)更易腐蚀,解释原因并写出反应式。 巩固知识
板书设计
一、金属的腐蚀
1.定义:
2.金属腐蚀的本质:金属的还原性
M-ne-=Mn+
3.金属腐蚀方式:
化学腐蚀 直接发生氧化还原反应
电化学腐蚀 通过形成原电池发生氧化还原反应
析氢腐蚀(水膜呈酸性):负极(铁): Fe–2e-=Fe2+
正极(杂质碳):2H++2e-=H2↑
吸氧腐蚀(水膜呈中性或酸性很弱):
负极(铁): 2Fe–4e-=2Fe2+
正极(杂质碳):O2+2H2O+4e-=4OH—
教学反思:本堂课突破了教学难点,突出了教学重点,完成了教学目标;采用了探究学习的方法,充分发挥了学生的学习自主性,为下个课时金属的防护奠定了理论基础。
21世纪教育网 -- 中国最大型、最专业的中小学教育资源门户网站。 版权所有@21世纪教育网
