二氧化硫
图片预览


文档简介
本资料来自于资源最齐全的21世纪教育网www.21cnjy.com
《二氧化硫》教学设计
一、基本说明:
1、教学内容所属模块:高中化学必修模块《化学1》
2、年级:高一年级
3、所用教材出版社:人民教育出版社
4、所属的章节:第四章第三节
二、教材分析
1、教学目标
⑴知识与技能:
①了解二氧化硫的物理性质和用途
②掌握二氧化硫的化学性质
③了解二氧化硫对空气的污染和防止污染
⑵过程与方法:
①采用“科学探究学习”模式,用科学探究的方法进行学习和教育。
②使学生亲历科学的历程,初步学会从实验推导化学性质的学习方法。
③培养学生的自主学习、合作学习、探究学习及根据实验现象分析问题、获得结论的推理能力
⑶情感态度和价值观:
①通过实验,领略化学实验的乐趣,激发学生学习化学的欲望和情感。培养学生实事求是的科学态度,体验个人价值及成功的艰辛与喜悦。
②培养学生辨证认识事物两面性的哲学观点。增强学生的环境保护意识和健康意识。
2、内容分析:
本节内容是本章的一个重点,也是高中化学的重点之一。它是典型的元素化合物知识,从知识的内在联系来看,本节内容为以后运用化合价来判断物质的氧化还原的性质奠定基础,是高中教材中仅有的详细讲述集氧化性、还原性于一身的酸性氧化物。并且此部分很多内容与日常生活、环境问题有密切的关系,能培养学生关注人类面临的与化学相关的社会问题,培养社会责任感、参与意识和决策能力。因此,本节重点是二氧化硫的氧化性、还原性和漂白性,难点及关键是二氧化硫在不同环境下表现出性质的多重性,设计实验探究二氧化硫的化学性质。因此,本节课的学习内容含量比较大,难度适中必须使学生深刻理解。
3、学情分析:
①此教学是针对一般高中的学生而设计,他们对化学现象、化学实验兴趣浓厚,有探究欲、表现欲和成就欲。学生具备了一定的实验操作能力和观察分析能力。
②此内容之前学生已学习了氧化还原反应等知识,这些内容对二氧化硫知识的学习起到了铺垫和支持的作用。
4、教学方法选择及思路
本节课设计了“以教师为主导、学生为主体”的科学探究过程,并与实验、多媒体有机的结合,营造出师生互动的和谐课堂。
在课堂教学中培养学生通过:质疑激趣→实验引探→媒体释疑→启思诱导→合作研讨→反馈小结等多个环节进行启发探究式教学
三、教学过程
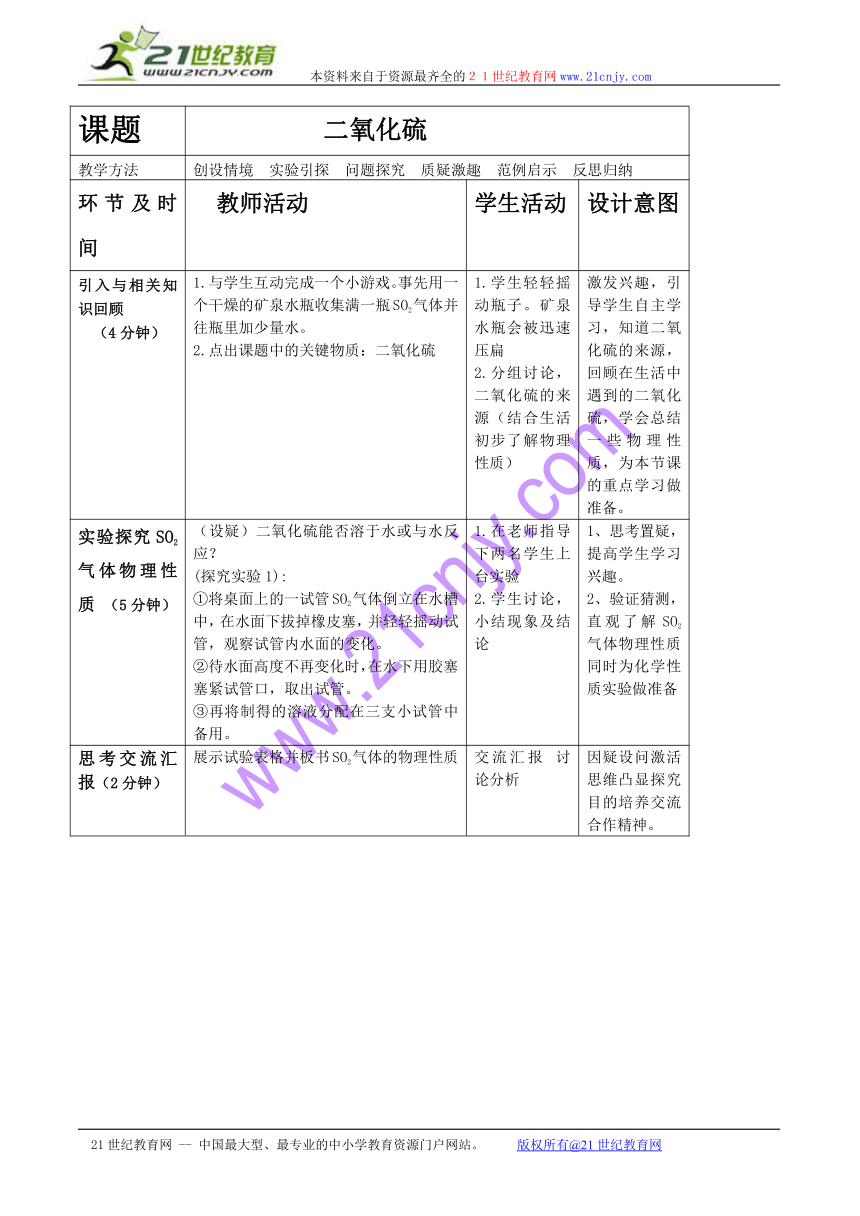
课题 二氧化硫
教学方法 创设情境 实验引探 问题探究 质疑激趣 范例启示 反思归纳
环节及时间 教师活动 学生活动 设计意图
引入与相关知识回顾(4分钟) 1.与学生互动完成一个小游戏。事先用一个干燥的矿泉水瓶收集满一瓶SO2气体并往瓶里加少量水。2.点出课题中的关键物质:二氧化硫 1.学生轻轻摇动瓶子。矿泉水瓶会被迅速压扁2.分组讨论,二氧化硫的来源(结合生活初步了解物理性质) 激发兴趣,引导学生自主学习,知道二氧化硫的来源,回顾在生活中遇到的二氧化硫,学会总结一些物理性质,为本节课的重点学习做准备。
实验探究SO2气体物理性质 (5分钟) (设疑)二氧化硫能否溶于水或与水反应?(探究实验1):①将桌面上的一试管SO2气体倒立在水槽中,在水面下拔掉橡皮塞,并轻轻摇动试管,观察试管内水面的变化。②待水面高度不再变化时,在水下用胶塞塞紧试管口,取出试管。③再将制得的溶液分配在三支小试管中备用。 1.在老师指导下两名学生上台实验2.学生讨论,小结现象及结论 1、思考置疑,提高学生学习兴趣。2、验证猜测,直观了解SO2气体物理性质同时为化学性质实验做准备
思考交流汇报(2分钟) 展示试验表格并板书SO2气体的物理性质 交流汇报 讨论分析 因疑设问激活思维凸显探究目的培养交流合作精神。
实验探究SO2气体化学性质 设疑过 渡(2分钟) (设问)很多同学刚才提到了,二氧化硫可能和水发生了化学反应,那么我们怎么证明它发生了反应呢? 在老师引导下学生思考方向: 1.从物质分类的角度2.从氧化还原的角度3. 从物质特性的角度4.从与环境的关系的角度 培养学生透过现象看本质的思维方式、敏锐的观察力和发现问题解决问题的能力。掌握二氧化硫的化学性质
1.SO2作为酸性氧化物(从物质分类的角度)(6分钟) 1.问题引导:酸性氧化物一般可以发生哪些化学反应? 2.(探究实验2): 实验设计:设计一个实验,验证二氧化硫和水发生了反应3.教师讲述可逆反应的概念 4.类比分析:根据以CO2为参照,写出SO2和CaO,SO2和Ca(OH)2反应的生成物 1.学生分组进行实验:可以选用的药品有PH试纸,石蕊试液等2.学生练习:一名学生上台写化学方程式3.学生观察方程式的特点, 复习酸性氧化物的性质.导出可逆反应的概念 培养学生的分析能力
2.SO2的氧化性和还原性(从氧化还原的角度)(6分钟 (板书):0 +4 +6S S O2 S O3氧化性 还原性(1)还原性 2SO2 + O2 2SO3(工业生产硫酸)2SO2 + Cl2 +2H2O ===H2SO4 + 2HCl(2)氧化性2H2S + SO2 == 3S + 2H2O 1.分组探讨:从硫元素的化合价出发,探讨SO2存在的性质2.学生总结:由SO2中S的化合价分析: 回忆、对比、分析,新旧知识融会贯通运用旧知识解决新问题,培养学生对知识的灵活应用能力充分复习、运用氧化还原反应的理论
3. SO2的漂白性(特性)(6分钟) 1.(探究实验3):①往实验1中装有二氧化硫水溶液的试管中滴加1到2滴品红并震荡,观察现象。(两名学生各做一组)②将上述试管在酒精灯上加热,观察现象。实验现象:品红由红色变为无色,加热后又恢复红色2.结论分析:SO2具有漂白性, SO2与品红发生化合反应生成不稳定的无色物质,该物质经加热后又分解生成品红,恢复红色。(化合漂白,暂时漂白)3.动画演示氯水和SO2漂白原理 投影总结: 氯水二氧化硫原理氯水中HClO将有色物质氧化成无色物质SO2与有色物质直接化合生成不稳定的无色物质实质氧化还原反应化合反应效果永久漂白暂时漂白范围漂白大多数有色物质,能使酸碱指示剂褪色(如紫色石蕊试液)漂白某些有色物质,不能使紫色石蕊试液褪色 1.应用举例SO2的漂白性2.学生总结设计实验的方法和结果3.对比区分氯水和SO2漂白原理 列表对比,并用动画演示,加深学生的感性认识使知识系统化
SO2与环境的关系(6分钟) 课件投影:酸雨的形成与危害 1.观看视频:酸雨的形成与危害2.分角色讨论:我们可以做些什么?如果你是一个化学教师如果你是环保部长如果你是农业部长作为学生的我们 使学生再次意识到SO2的危害,与实际生活相联系
课堂练习与总结(5分钟) 投影:(1)课堂练习1)描叙下列实验现象并解释原因:实验1 ①用试管取二氧化硫溶于水后的溶液约1mL,并滴入2-3滴紫色石蕊。 ②把二氧化硫通入滴有酚酞的NaOH溶液中。实验2 将二氧化硫气体通入还原性物质的溶液中(学生选择药品)应选氢硫酸。实验3 二氧化硫气体通入酸性高锰酸钾溶液中(或通入溴水中)。2)设计实验验证CO2中含有SO2. (2)课堂总结 (3)课后作业与探究 (4)课后趣味探究:我们在日常生活中所烧的煤里还有硫,在燃烧的时候会产生刺激性气味的气体。请同学查阅资料和调查经常烧煤的人,如何减少或者防止刺激性气味气体的出现?写成一篇调查报告 课后独立完成 增强学生灵活应用能力强化本节基本知识点留给学生自己回想的空间
四、板书设计
二氧化硫
一、二氧化硫的来源:
二、二氧化硫的物理性质:
无色,密度比空气大,易溶于水,易液化,有强刺激性气味的有毒气体
三、二氧化硫的化学性质:
1.酸性氧化物的通性:
SO2+H2O H2SO3
可逆反应:在相同条件下,既能向正反应方向,又能向逆反应方向进行的反应。
2.还原性:
2SO2 + O2 2SO3
2SO2 + Cl2 +2H2O === H2SO4 + 2HCl
3.氧化性:
2H2S + SO2 == 3S + 2H2O
4.漂白性(暂时性 可逆):
现象:品红由红色变为无色,加热后又恢复红色
原理:化合反应
5.与环境的关系:
五、教学反思:
1.我校教学条件比较落后,尤其是实验室建设比较困难,基本上一学期才一到两次。新课程突出“化学是一门以实验为主的基础的学科”为此,我加强课堂演示实验学生的参与性(不以动画代替实际操作)。
2.高中学生的自主参与意识强,教师要结合每个学生的个性特点进行正确的引导,现实“以学生为主体,老师为主导”的教学地位。
3.本节课的一个疑问:教材设计验证二氧化硫漂白性实验(往装有二氧化硫水溶液的试管中滴加1到2滴品红并震荡)我在实验室反复实验了很多次,感觉褪色的现象是否明显与二氧化硫气体溶度有关,若改用老教材的做法往品红溶液中充入二氧化硫气体,现象很明显,但是对环境的污染较大。
4.教师应充分把握教材内容的层次性,了解各种版本的教材,对教材内容进行灵活处理,不要加大难度,比如本堂课里第一次出现了“可逆反应”由于在必修2以及选修4里会对“可逆反应”重点学习,所以在这里不必讲的太多,把概念说明白既可。
21世纪教育网 -- 中国最大型、最专业的中小学教育资源门户网站。 版权所有@21世纪教育网
《二氧化硫》教学设计
一、基本说明:
1、教学内容所属模块:高中化学必修模块《化学1》
2、年级:高一年级
3、所用教材出版社:人民教育出版社
4、所属的章节:第四章第三节
二、教材分析
1、教学目标
⑴知识与技能:
①了解二氧化硫的物理性质和用途
②掌握二氧化硫的化学性质
③了解二氧化硫对空气的污染和防止污染
⑵过程与方法:
①采用“科学探究学习”模式,用科学探究的方法进行学习和教育。
②使学生亲历科学的历程,初步学会从实验推导化学性质的学习方法。
③培养学生的自主学习、合作学习、探究学习及根据实验现象分析问题、获得结论的推理能力
⑶情感态度和价值观:
①通过实验,领略化学实验的乐趣,激发学生学习化学的欲望和情感。培养学生实事求是的科学态度,体验个人价值及成功的艰辛与喜悦。
②培养学生辨证认识事物两面性的哲学观点。增强学生的环境保护意识和健康意识。
2、内容分析:
本节内容是本章的一个重点,也是高中化学的重点之一。它是典型的元素化合物知识,从知识的内在联系来看,本节内容为以后运用化合价来判断物质的氧化还原的性质奠定基础,是高中教材中仅有的详细讲述集氧化性、还原性于一身的酸性氧化物。并且此部分很多内容与日常生活、环境问题有密切的关系,能培养学生关注人类面临的与化学相关的社会问题,培养社会责任感、参与意识和决策能力。因此,本节重点是二氧化硫的氧化性、还原性和漂白性,难点及关键是二氧化硫在不同环境下表现出性质的多重性,设计实验探究二氧化硫的化学性质。因此,本节课的学习内容含量比较大,难度适中必须使学生深刻理解。
3、学情分析:
①此教学是针对一般高中的学生而设计,他们对化学现象、化学实验兴趣浓厚,有探究欲、表现欲和成就欲。学生具备了一定的实验操作能力和观察分析能力。
②此内容之前学生已学习了氧化还原反应等知识,这些内容对二氧化硫知识的学习起到了铺垫和支持的作用。
4、教学方法选择及思路
本节课设计了“以教师为主导、学生为主体”的科学探究过程,并与实验、多媒体有机的结合,营造出师生互动的和谐课堂。
在课堂教学中培养学生通过:质疑激趣→实验引探→媒体释疑→启思诱导→合作研讨→反馈小结等多个环节进行启发探究式教学
三、教学过程
课题 二氧化硫
教学方法 创设情境 实验引探 问题探究 质疑激趣 范例启示 反思归纳
环节及时间 教师活动 学生活动 设计意图
引入与相关知识回顾(4分钟) 1.与学生互动完成一个小游戏。事先用一个干燥的矿泉水瓶收集满一瓶SO2气体并往瓶里加少量水。2.点出课题中的关键物质:二氧化硫 1.学生轻轻摇动瓶子。矿泉水瓶会被迅速压扁2.分组讨论,二氧化硫的来源(结合生活初步了解物理性质) 激发兴趣,引导学生自主学习,知道二氧化硫的来源,回顾在生活中遇到的二氧化硫,学会总结一些物理性质,为本节课的重点学习做准备。
实验探究SO2气体物理性质 (5分钟) (设疑)二氧化硫能否溶于水或与水反应?(探究实验1):①将桌面上的一试管SO2气体倒立在水槽中,在水面下拔掉橡皮塞,并轻轻摇动试管,观察试管内水面的变化。②待水面高度不再变化时,在水下用胶塞塞紧试管口,取出试管。③再将制得的溶液分配在三支小试管中备用。 1.在老师指导下两名学生上台实验2.学生讨论,小结现象及结论 1、思考置疑,提高学生学习兴趣。2、验证猜测,直观了解SO2气体物理性质同时为化学性质实验做准备
思考交流汇报(2分钟) 展示试验表格并板书SO2气体的物理性质 交流汇报 讨论分析 因疑设问激活思维凸显探究目的培养交流合作精神。
实验探究SO2气体化学性质 设疑过 渡(2分钟) (设问)很多同学刚才提到了,二氧化硫可能和水发生了化学反应,那么我们怎么证明它发生了反应呢? 在老师引导下学生思考方向: 1.从物质分类的角度2.从氧化还原的角度3. 从物质特性的角度4.从与环境的关系的角度 培养学生透过现象看本质的思维方式、敏锐的观察力和发现问题解决问题的能力。掌握二氧化硫的化学性质
1.SO2作为酸性氧化物(从物质分类的角度)(6分钟) 1.问题引导:酸性氧化物一般可以发生哪些化学反应? 2.(探究实验2): 实验设计:设计一个实验,验证二氧化硫和水发生了反应3.教师讲述可逆反应的概念 4.类比分析:根据以CO2为参照,写出SO2和CaO,SO2和Ca(OH)2反应的生成物 1.学生分组进行实验:可以选用的药品有PH试纸,石蕊试液等2.学生练习:一名学生上台写化学方程式3.学生观察方程式的特点, 复习酸性氧化物的性质.导出可逆反应的概念 培养学生的分析能力
2.SO2的氧化性和还原性(从氧化还原的角度)(6分钟 (板书):0 +4 +6S S O2 S O3氧化性 还原性(1)还原性 2SO2 + O2 2SO3(工业生产硫酸)2SO2 + Cl2 +2H2O ===H2SO4 + 2HCl(2)氧化性2H2S + SO2 == 3S + 2H2O 1.分组探讨:从硫元素的化合价出发,探讨SO2存在的性质2.学生总结:由SO2中S的化合价分析: 回忆、对比、分析,新旧知识融会贯通运用旧知识解决新问题,培养学生对知识的灵活应用能力充分复习、运用氧化还原反应的理论
3. SO2的漂白性(特性)(6分钟) 1.(探究实验3):①往实验1中装有二氧化硫水溶液的试管中滴加1到2滴品红并震荡,观察现象。(两名学生各做一组)②将上述试管在酒精灯上加热,观察现象。实验现象:品红由红色变为无色,加热后又恢复红色2.结论分析:SO2具有漂白性, SO2与品红发生化合反应生成不稳定的无色物质,该物质经加热后又分解生成品红,恢复红色。(化合漂白,暂时漂白)3.动画演示氯水和SO2漂白原理 投影总结: 氯水二氧化硫原理氯水中HClO将有色物质氧化成无色物质SO2与有色物质直接化合生成不稳定的无色物质实质氧化还原反应化合反应效果永久漂白暂时漂白范围漂白大多数有色物质,能使酸碱指示剂褪色(如紫色石蕊试液)漂白某些有色物质,不能使紫色石蕊试液褪色 1.应用举例SO2的漂白性2.学生总结设计实验的方法和结果3.对比区分氯水和SO2漂白原理 列表对比,并用动画演示,加深学生的感性认识使知识系统化
SO2与环境的关系(6分钟) 课件投影:酸雨的形成与危害 1.观看视频:酸雨的形成与危害2.分角色讨论:我们可以做些什么?如果你是一个化学教师如果你是环保部长如果你是农业部长作为学生的我们 使学生再次意识到SO2的危害,与实际生活相联系
课堂练习与总结(5分钟) 投影:(1)课堂练习1)描叙下列实验现象并解释原因:实验1 ①用试管取二氧化硫溶于水后的溶液约1mL,并滴入2-3滴紫色石蕊。 ②把二氧化硫通入滴有酚酞的NaOH溶液中。实验2 将二氧化硫气体通入还原性物质的溶液中(学生选择药品)应选氢硫酸。实验3 二氧化硫气体通入酸性高锰酸钾溶液中(或通入溴水中)。2)设计实验验证CO2中含有SO2. (2)课堂总结 (3)课后作业与探究 (4)课后趣味探究:我们在日常生活中所烧的煤里还有硫,在燃烧的时候会产生刺激性气味的气体。请同学查阅资料和调查经常烧煤的人,如何减少或者防止刺激性气味气体的出现?写成一篇调查报告 课后独立完成 增强学生灵活应用能力强化本节基本知识点留给学生自己回想的空间
四、板书设计
二氧化硫
一、二氧化硫的来源:
二、二氧化硫的物理性质:
无色,密度比空气大,易溶于水,易液化,有强刺激性气味的有毒气体
三、二氧化硫的化学性质:
1.酸性氧化物的通性:
SO2+H2O H2SO3
可逆反应:在相同条件下,既能向正反应方向,又能向逆反应方向进行的反应。
2.还原性:
2SO2 + O2 2SO3
2SO2 + Cl2 +2H2O === H2SO4 + 2HCl
3.氧化性:
2H2S + SO2 == 3S + 2H2O
4.漂白性(暂时性 可逆):
现象:品红由红色变为无色,加热后又恢复红色
原理:化合反应
5.与环境的关系:
五、教学反思:
1.我校教学条件比较落后,尤其是实验室建设比较困难,基本上一学期才一到两次。新课程突出“化学是一门以实验为主的基础的学科”为此,我加强课堂演示实验学生的参与性(不以动画代替实际操作)。
2.高中学生的自主参与意识强,教师要结合每个学生的个性特点进行正确的引导,现实“以学生为主体,老师为主导”的教学地位。
3.本节课的一个疑问:教材设计验证二氧化硫漂白性实验(往装有二氧化硫水溶液的试管中滴加1到2滴品红并震荡)我在实验室反复实验了很多次,感觉褪色的现象是否明显与二氧化硫气体溶度有关,若改用老教材的做法往品红溶液中充入二氧化硫气体,现象很明显,但是对环境的污染较大。
4.教师应充分把握教材内容的层次性,了解各种版本的教材,对教材内容进行灵活处理,不要加大难度,比如本堂课里第一次出现了“可逆反应”由于在必修2以及选修4里会对“可逆反应”重点学习,所以在这里不必讲的太多,把概念说明白既可。
21世纪教育网 -- 中国最大型、最专业的中小学教育资源门户网站。 版权所有@21世纪教育网
