物质的量在化学实验中的应用
文档属性
| 名称 | 物质的量在化学实验中的应用 |

|
|
| 格式 | rar | ||
| 文件大小 | 17.2KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2010-08-03 00:00:00 | ||
图片预览

文档简介
本资料来自于资源最齐全的21世纪教育网www.21cnjy.com
第二节 化学计量在化学实验中的应用
第三课时 物质的量在化学实验中的应用
一、教学目标
知识与技能:
1、使学生正确理解和掌握物质的量浓度的概念,
2、初步学会有关物质的量浓度的计算及配制一定物质的量浓度的溶液的操作技能。
3、培养学生对知识的应用能力。
4、调动学生参与知识形成的积极性和主动性,培养学生合作学习的意识和能力。
过程与方法:
1、通过物质的量浓度及其溶液配制的教学,培养学生的观察能力、自学能力及探究能力。
2、通过探究物质的量浓度配制方法,培养学生的实验能力。
情感与价值观:
通过学习培养学生独立思考、积极进取的精神和严谨、细致的科学态度,用数学的思想解决化学问题的能力。
二、重点、难点
物质的量浓度的概念的理解;物质的量浓度溶液的配制技能及有关计算。
三、教学方法
探究式教学法、并进式实验教学法。
四、教学过程设计
教师活动 学生活动 设计意图
【创设情境】展示三瓶物质的量浓度不同的CuSO4溶液。【提问】桌上的三瓶蓝色溶液可能是什么溶液?【组织探究】溶液的颜色深浅的原因 【提问】什么是溶质的质量分数?【小结投影】溶质的质量(g)质量分数=———————溶液的质量(g) 【观察后回答】可能是CuSO4溶液。【探究结论】因为它们的质量分数不同,质量分数大的,颜色深;质量分数小的,颜色浅。【回答】溶质的质量分数是以溶质的质量与溶液的质量之比来表示的。【回忆、思考】 创设情境,增加学生的学习兴趣,引出质量分数概念。复习旧知识为掌握新知识作铺垫。
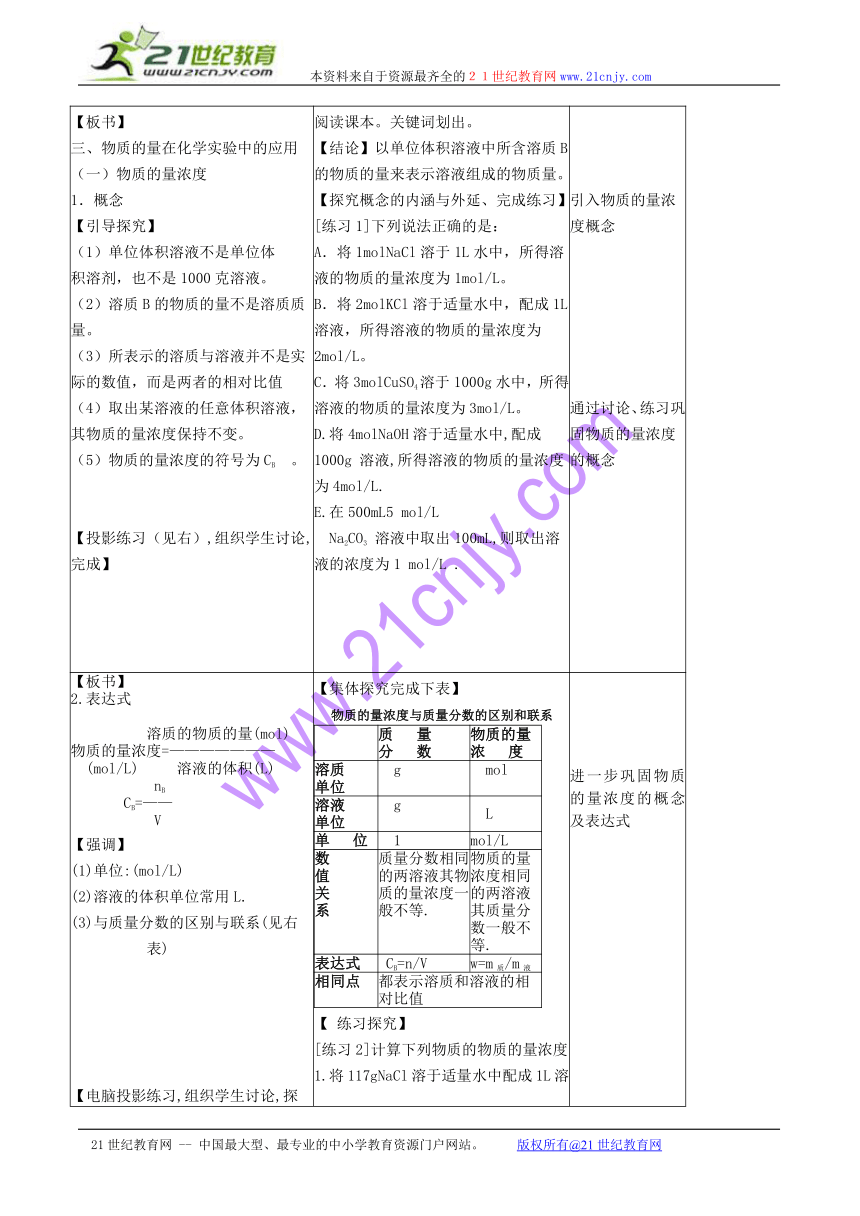
【引入探究】我们在许多场合,取用液体时,一般并不称取它的质量,而是量取它的体积;物质间反应时又是按照一定物质的量进行的。因此,用质量分数并不方便,需要引入新的物理量-------物质的量浓度。【板书】三、物质的量在化学实验中的应用(一)物质的量浓度1.概念【引导探究】(1)单位体积溶液不是单位体积溶剂,也不是1000克溶液。(2)溶质B的物质的量不是溶质质量。(3)所表示的溶质与溶液并不是实际的数值,而是两者的相对比值(4)取出某溶液的任意体积溶液,其物质的量浓度保持不变。(5)物质的量浓度的符号为CB 。【投影练习(见右),组织学生讨论,完成】 阅读课本。关键词划出。【结论】以单位体积溶液中所含溶质B的物质的量来表示溶液组成的物质量。【探究概念的内涵与外延、完成练习】[练习1]下列说法正确的是:A.将1molNaCl溶于1L水中,所得溶液的物质的量浓度为1mol/L。B.将2molKCl溶于适量水中,配成1L溶液,所得溶液的物质的量浓度为2mol/L。C.将3molCuSO4溶于1000g水中,所得溶液的物质的量浓度为3mol/L。D.将4molNaOH溶于适量水中,配成1000g 溶液,所得溶液的物质的量浓度为4mol/L.E.在500mL5 mol/LNa2CO3 溶液中取出100mL,则取出溶液的浓度为1 mol/L . 引入物质的量浓度概念通过讨论、练习巩固物质的量浓度的概念
【板书】2.表达式溶质的物质的量(mol)物质的量浓度=———————(mol/L) 溶液的体积(L) nB CB=—— V【强调】(1)单位:(mol/L) (2)溶液的体积单位常用L.(3)与质量分数的区别与联系(见右表) 【电脑投影练习,组织学生讨论,探究出计算方法】 【集体探究完成下表】物质的量浓度与质量分数的区别和联系质 量分 数物质的量浓 度溶质单位 gmol溶液单位gL单 位1mol/L数值关系质量分数相同的两溶液其物质的量浓度一般不等.物质的量浓度相同的两溶液其质量分数一般不等.表达式 CB=n/Vw=m质/m液相同点都表示溶质和溶液的相对比值【 练习探究】[练习2]计算下列物质的物质的量浓度1.将117gNaCl溶于适量水中配成1L溶液,所得溶液的物质的量浓度为多少 2. 2LNaOH溶液中溶有4molNaOH,则该溶液的物质的量浓度为多少 3.0.1mol/L的H2SO4溶液中,若要取出含溶质0.98g的溶液,则应取多少L. 进一步巩固物质的量浓度的概念及表达式掌握表达式中三个物理量的关系及计算.
【板书】(二)一定物质的量浓度溶液的配制【组织学生阅读课本,观察仪器、并探究出以下知识】【小结】1、仪器容量瓶、烧杯、玻棒、胶头滴管、天平或滴定管等。【电脑投影】【容量瓶简介】(1)容量瓶是平底梨形长颈的玻璃瓶,是一种专门用于配制溶液的仪器。(2)容量瓶颈上刻有标线,瓶上还标有温度和容积。(3)容量瓶常见的型号有:1000 ml、500ml、 250ml、100ml 、50ml 、25ml等;有无色和棕色两种颜色。 阅读课本,观察仪器,并小结出配制溶液的步骤及所用的仪器观察探究容量瓶,小结出容量瓶的有关知识(见投影)探究棕色容量瓶的特殊用途探究容量瓶的检漏方法 培养学生的自学能力、观察探究能力。
【板书】【小结】2、配制步骤:计算—称量—溶解—转移—洗涤—定容—摇匀---装瓶-贴标签【实验探究】【演示实验】配制0.1 mol/LNaCl溶液500mL。【指导学生练习配制0.1 mol/LNaCl溶液250mL的实验操作】 探究配制步骤:(1)准备工作:检漏(2) 操作步骤:计算—称量—溶解—转移—洗涤—定容—摇匀(3)结束工作:装瓶、贴标签、整理清洗。【根据教师演示实验,练习配制0.1 mol/LNaCl溶液250mL的实验操作】先用自来水练习溶液的转移,在容量瓶下垫一白纸,待白纸上无水印后,再进行配制溶液操作。 掌握物质的量浓度溶液配制方法。培养学生的实验操作技能
【组织探究实验操作问题】 探究下列问题:1、为什么在烧杯中溶解?能放直接在容量瓶中溶解?2、物质溶解后能否立即转移到容量瓶中?3、适量的水为多少?4、为什么要用玻棒引流?5、转移过程中玻棒应在何处?能否放在桌上?6、为什么要洗涤2—3次,否则,配制出的溶液浓度有什么变化?7、定容前为什么要振荡容量瓶?8、定容时为什么要改用胶头滴管?9、如果定容时,不小心使溶液的液面超过了标线,该怎么办?10、摇匀后,溶液的液面低于标线,能否再加水至液面与标线相切?如这样操作,对配得的溶液浓度有什么影响?【探究用浓硫酸配制0.1 mol/LH2SO4溶液250mL的操作过程】 培养学生严谨的科学态度,掌握实验操作技能。变式训练,培养学生的思维能力。
【组织学生完成巩固练习】 【完成巩固练习】[练习3]指出下列操作中的错误,并改正。某学生要配制0.1 mol/LNaOH溶液100mL。他把质量、大小均相同的两张滤纸分别放在托盘天平的两个托盘上,称取4g NaOH晶体,然后放入烧杯中,加水100mL搅拌溶解后,立即倒入250mL容量瓶中,不小心又溅出几滴液体,最后用烧杯加水至溶液的液面正好与标线相切,把容量瓶摇晃二次即成。 巩固溶液的配制方法。
【组织学生探究 】 误差分析【小结】依据公式 C=n/V 造成浓度误差的原因可由n或V引起 理解和体会。【完成巩固练习】 [练习4]下列配制的溶液浓度偏高的是 A. 配制盐酸溶液用量筒量取盐酸时俯视刻度线 B. 配制盐酸溶液定容时,仰视容量瓶刻度线C. 称取4 g NaOH配制0.1mol/L 溶液1000mL 时,砝码错放左盘D. NaOH固体溶解后未经冷却即注入容量瓶至刻度线 培养学生严谨的科学态度
【小结】物质的量浓度是以单位体积溶液里所含溶质的物质的量来表示溶液组成的物理量: nB CB=—— V在实验室中,配制一定物质的量浓度的溶液,可以用固体直接配制,也可以将浓溶液稀释成稀溶液。将浓溶液配制成稀溶液时,常采用下面的关系式计算有关的量: C(浓溶液)×(浓溶液)= C(稀溶液)×V(稀溶液)布置作业 巩固物质的量的知识及其联系.
板书设计:
三、物质的量在化学实验中的应用
(一)物质的量浓度
1.概念
2.表达式
溶质的物质的量(mol)
物质的量浓度=———————
(mol/L) 溶液的体积(L)
nB
CB=——
V
(二)一定物质的量浓度溶液的配制
1、仪器
容量瓶、烧杯、玻棒、胶头滴管、天平或滴定管等。
2、配制步骤:
计算—称量—溶解—转移—洗涤—定容—摇匀---装瓶-贴标签
3、误差分析
21世纪教育网 -- 中国最大型、最专业的中小学教育资源门户网站。 版权所有@21世纪教育网
第二节 化学计量在化学实验中的应用
第三课时 物质的量在化学实验中的应用
一、教学目标
知识与技能:
1、使学生正确理解和掌握物质的量浓度的概念,
2、初步学会有关物质的量浓度的计算及配制一定物质的量浓度的溶液的操作技能。
3、培养学生对知识的应用能力。
4、调动学生参与知识形成的积极性和主动性,培养学生合作学习的意识和能力。
过程与方法:
1、通过物质的量浓度及其溶液配制的教学,培养学生的观察能力、自学能力及探究能力。
2、通过探究物质的量浓度配制方法,培养学生的实验能力。
情感与价值观:
通过学习培养学生独立思考、积极进取的精神和严谨、细致的科学态度,用数学的思想解决化学问题的能力。
二、重点、难点
物质的量浓度的概念的理解;物质的量浓度溶液的配制技能及有关计算。
三、教学方法
探究式教学法、并进式实验教学法。
四、教学过程设计
教师活动 学生活动 设计意图
【创设情境】展示三瓶物质的量浓度不同的CuSO4溶液。【提问】桌上的三瓶蓝色溶液可能是什么溶液?【组织探究】溶液的颜色深浅的原因 【提问】什么是溶质的质量分数?【小结投影】溶质的质量(g)质量分数=———————溶液的质量(g) 【观察后回答】可能是CuSO4溶液。【探究结论】因为它们的质量分数不同,质量分数大的,颜色深;质量分数小的,颜色浅。【回答】溶质的质量分数是以溶质的质量与溶液的质量之比来表示的。【回忆、思考】 创设情境,增加学生的学习兴趣,引出质量分数概念。复习旧知识为掌握新知识作铺垫。
【引入探究】我们在许多场合,取用液体时,一般并不称取它的质量,而是量取它的体积;物质间反应时又是按照一定物质的量进行的。因此,用质量分数并不方便,需要引入新的物理量-------物质的量浓度。【板书】三、物质的量在化学实验中的应用(一)物质的量浓度1.概念【引导探究】(1)单位体积溶液不是单位体积溶剂,也不是1000克溶液。(2)溶质B的物质的量不是溶质质量。(3)所表示的溶质与溶液并不是实际的数值,而是两者的相对比值(4)取出某溶液的任意体积溶液,其物质的量浓度保持不变。(5)物质的量浓度的符号为CB 。【投影练习(见右),组织学生讨论,完成】 阅读课本。关键词划出。【结论】以单位体积溶液中所含溶质B的物质的量来表示溶液组成的物质量。【探究概念的内涵与外延、完成练习】[练习1]下列说法正确的是:A.将1molNaCl溶于1L水中,所得溶液的物质的量浓度为1mol/L。B.将2molKCl溶于适量水中,配成1L溶液,所得溶液的物质的量浓度为2mol/L。C.将3molCuSO4溶于1000g水中,所得溶液的物质的量浓度为3mol/L。D.将4molNaOH溶于适量水中,配成1000g 溶液,所得溶液的物质的量浓度为4mol/L.E.在500mL5 mol/LNa2CO3 溶液中取出100mL,则取出溶液的浓度为1 mol/L . 引入物质的量浓度概念通过讨论、练习巩固物质的量浓度的概念
【板书】2.表达式溶质的物质的量(mol)物质的量浓度=———————(mol/L) 溶液的体积(L) nB CB=—— V【强调】(1)单位:(mol/L) (2)溶液的体积单位常用L.(3)与质量分数的区别与联系(见右表) 【电脑投影练习,组织学生讨论,探究出计算方法】 【集体探究完成下表】物质的量浓度与质量分数的区别和联系质 量分 数物质的量浓 度溶质单位 gmol溶液单位gL单 位1mol/L数值关系质量分数相同的两溶液其物质的量浓度一般不等.物质的量浓度相同的两溶液其质量分数一般不等.表达式 CB=n/Vw=m质/m液相同点都表示溶质和溶液的相对比值【 练习探究】[练习2]计算下列物质的物质的量浓度1.将117gNaCl溶于适量水中配成1L溶液,所得溶液的物质的量浓度为多少 2. 2LNaOH溶液中溶有4molNaOH,则该溶液的物质的量浓度为多少 3.0.1mol/L的H2SO4溶液中,若要取出含溶质0.98g的溶液,则应取多少L. 进一步巩固物质的量浓度的概念及表达式掌握表达式中三个物理量的关系及计算.
【板书】(二)一定物质的量浓度溶液的配制【组织学生阅读课本,观察仪器、并探究出以下知识】【小结】1、仪器容量瓶、烧杯、玻棒、胶头滴管、天平或滴定管等。【电脑投影】【容量瓶简介】(1)容量瓶是平底梨形长颈的玻璃瓶,是一种专门用于配制溶液的仪器。(2)容量瓶颈上刻有标线,瓶上还标有温度和容积。(3)容量瓶常见的型号有:1000 ml、500ml、 250ml、100ml 、50ml 、25ml等;有无色和棕色两种颜色。 阅读课本,观察仪器,并小结出配制溶液的步骤及所用的仪器观察探究容量瓶,小结出容量瓶的有关知识(见投影)探究棕色容量瓶的特殊用途探究容量瓶的检漏方法 培养学生的自学能力、观察探究能力。
【板书】【小结】2、配制步骤:计算—称量—溶解—转移—洗涤—定容—摇匀---装瓶-贴标签【实验探究】【演示实验】配制0.1 mol/LNaCl溶液500mL。【指导学生练习配制0.1 mol/LNaCl溶液250mL的实验操作】 探究配制步骤:(1)准备工作:检漏(2) 操作步骤:计算—称量—溶解—转移—洗涤—定容—摇匀(3)结束工作:装瓶、贴标签、整理清洗。【根据教师演示实验,练习配制0.1 mol/LNaCl溶液250mL的实验操作】先用自来水练习溶液的转移,在容量瓶下垫一白纸,待白纸上无水印后,再进行配制溶液操作。 掌握物质的量浓度溶液配制方法。培养学生的实验操作技能
【组织探究实验操作问题】 探究下列问题:1、为什么在烧杯中溶解?能放直接在容量瓶中溶解?2、物质溶解后能否立即转移到容量瓶中?3、适量的水为多少?4、为什么要用玻棒引流?5、转移过程中玻棒应在何处?能否放在桌上?6、为什么要洗涤2—3次,否则,配制出的溶液浓度有什么变化?7、定容前为什么要振荡容量瓶?8、定容时为什么要改用胶头滴管?9、如果定容时,不小心使溶液的液面超过了标线,该怎么办?10、摇匀后,溶液的液面低于标线,能否再加水至液面与标线相切?如这样操作,对配得的溶液浓度有什么影响?【探究用浓硫酸配制0.1 mol/LH2SO4溶液250mL的操作过程】 培养学生严谨的科学态度,掌握实验操作技能。变式训练,培养学生的思维能力。
【组织学生完成巩固练习】 【完成巩固练习】[练习3]指出下列操作中的错误,并改正。某学生要配制0.1 mol/LNaOH溶液100mL。他把质量、大小均相同的两张滤纸分别放在托盘天平的两个托盘上,称取4g NaOH晶体,然后放入烧杯中,加水100mL搅拌溶解后,立即倒入250mL容量瓶中,不小心又溅出几滴液体,最后用烧杯加水至溶液的液面正好与标线相切,把容量瓶摇晃二次即成。 巩固溶液的配制方法。
【组织学生探究 】 误差分析【小结】依据公式 C=n/V 造成浓度误差的原因可由n或V引起 理解和体会。【完成巩固练习】 [练习4]下列配制的溶液浓度偏高的是 A. 配制盐酸溶液用量筒量取盐酸时俯视刻度线 B. 配制盐酸溶液定容时,仰视容量瓶刻度线C. 称取4 g NaOH配制0.1mol/L 溶液1000mL 时,砝码错放左盘D. NaOH固体溶解后未经冷却即注入容量瓶至刻度线 培养学生严谨的科学态度
【小结】物质的量浓度是以单位体积溶液里所含溶质的物质的量来表示溶液组成的物理量: nB CB=—— V在实验室中,配制一定物质的量浓度的溶液,可以用固体直接配制,也可以将浓溶液稀释成稀溶液。将浓溶液配制成稀溶液时,常采用下面的关系式计算有关的量: C(浓溶液)×(浓溶液)= C(稀溶液)×V(稀溶液)布置作业 巩固物质的量的知识及其联系.
板书设计:
三、物质的量在化学实验中的应用
(一)物质的量浓度
1.概念
2.表达式
溶质的物质的量(mol)
物质的量浓度=———————
(mol/L) 溶液的体积(L)
nB
CB=——
V
(二)一定物质的量浓度溶液的配制
1、仪器
容量瓶、烧杯、玻棒、胶头滴管、天平或滴定管等。
2、配制步骤:
计算—称量—溶解—转移—洗涤—定容—摇匀---装瓶-贴标签
3、误差分析
21世纪教育网 -- 中国最大型、最专业的中小学教育资源门户网站。 版权所有@21世纪教育网
