物质的量浓度
图片预览






文档简介
课件14张PPT。一、物质的量浓度的概念1、定义以__________________________ ___________来表示的溶液组成的物理量,叫做溶质B的物质的量浓度,常用单位为_______。mol/L2、数学表达式cB =________nB/V3、注意 (1)V是指溶液体积
(2)稀释溶液溶质物质的量不变
(3)取溶液,浓度不变二、有关物质的量浓度的计算(1)若固体溶于水,应注意溶质的变化。如Na、Na2O、Na2O2、NaOH溶于水后溶质均是NaOH;SO3→H2SO4;有些物质溶于水后溶液成分复杂,如NH3溶于水,仍然以NH3作为溶质(2)带结晶水的物质作为溶质时,其“物质的量”的计算,用带结晶水的物质的质量除以带有结晶水的物质的摩尔质量即可。如用ag CuSO4·5H2O配制硫酸铜溶液,溶质仍为CuSO4,其物质的量为
n(CuSO4) = 。1、注意事项(3)标准状况下气体(如HCl、NH3)溶解于水后所得溶液的物质的量浓度,参考金榜1号P18习题册P237 第七题:在标准状况下,1体积水溶解700体积氨气,所得溶液的密度是0.9 g·cm-3。则该氨水中溶质的物质的量浓度为( ),质量分数为( ) 氨气的质量为:
m (NH3)= 31.25 mol×17 g·mol-1=531.25 g 氨水的质量为:
m(氨水)=531.25 g+1000 mL×1 g·mol-1=1531.25 g质量分数为:
ω(氨水)=m(NH3)/m(氨水)×100%=34.7% 物质的量浓度为:
c(氨水)= 1000ρ ·ω/M
=1000× 0.9 g·cm-3 × 34.7%/17 g·mol-1 =18.4 mol·L-1 2、溶液中溶质质量分数(ω)与物质的量浓度
的换算:可应用公式cB= _________________
或ωB=_________________相互换算。3、若已知饱和溶液溶解度(S),
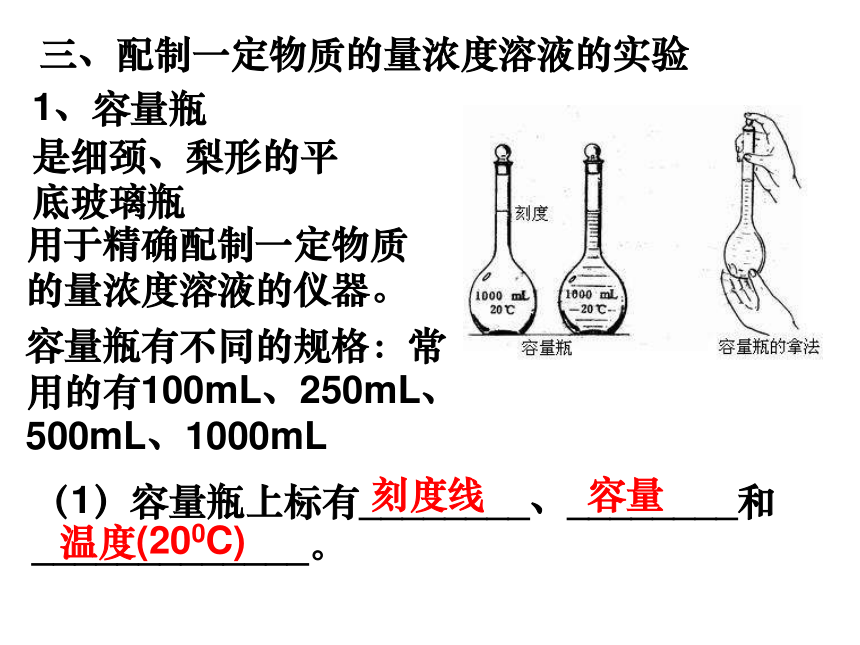
可应用公式cB=三、配制一定物质的量浓度溶液的实验1、容量瓶是细颈、梨形的平底玻璃瓶用于精确配制一定物质的量浓度溶液的仪器。容量瓶有不同的规格:常用的有100mL、250mL、500mL、1000mL(1)容量瓶上标有________、________和_____________。刻度线容量温度(200C)强调: 刻度线表示在所指温度下,液体的凹液面与容量瓶颈部刻度线相切时,表示瓶内溶液体积恰好等于瓶上标注的体积。(2)容量瓶的使用应注意:①使用前要检查__________;②不得在容量瓶中溶解固体或稀释浓溶液、存放溶液、不得加热;③不能先用试剂润洗。是否漏水完成金榜P19 容量瓶的使用 往瓶内加水,塞紧瓶塞,用食指顶住瓶塞,另一只手托住瓶底,把瓶倒立过来,观察瓶塞周围是否有水漏出 。如果不漏水,把瓶塞旋转1800后塞紧,仍把瓶倒立过来,再检查是否漏水,经检查不漏水的容量瓶才能使用。使用容量瓶前检查它是否漏水的方法2、配制物质的量浓度溶液的步骤及所用仪器(1)计算;(2)____(______________)或 _______( _______________);
(3)_________(__________________);
(4)静置冷却;(5)______(_______________________)
(6)_______;(7)定容(_________);(8)摇匀;(9)装瓶(贴好标签)称量托盘天平、药匙溶解或稀释量筒、烧杯、玻璃棒量取量筒、胶头滴管转移相应容积的容量瓶、玻璃棒洗涤胶头滴管以配制1000 mL、1.0 mol/L的NaCl溶液为例实验步骤?
(1)计算:计算所需 NaCl固体的质量为________。
(2)称量:根据计算结果,称量 NaCl固体。
(3)溶解:将称量好的 NaCl固体放入烧杯中,加适量水溶解,并用_________搅拌
(4)转移:待恢复到_______后,将溶液转移到______________中。玻璃棒 58.5 g 室温 1000 mL容量瓶 (5)洗涤:用适量蒸馏水将烧杯及玻璃棒洗涤________次,将每次洗涤液也注入容量瓶中,并振荡容量瓶。?
(6)定容:往容量瓶中缓慢加蒸馏水,等液面离容量瓶颈刻度线________cm时,改用_________滴加蒸馏水至液面与刻度线________。塞好瓶塞,反复上下颠倒,摇匀。2~3 1~2 相切 胶头滴管 完成金榜P18 整合拓展:应注意问题3、配制误差分析(1)若未用蒸馏水洗涤烧杯、玻璃棒,则溶质的质量________,结果偏________。
(2)将烧杯中的溶液转移到容量瓶时不慎洒到容量瓶外,则溶质的质量________,结果偏__________。?
(3)若俯视读数时,实际的液面高度比刻度线__________,结果偏__________。?低 减小 减小 低 高 低 四、溶液的稀释与混合?
稀释前后,溶液中溶质的物质的量不变,公式?
?c1·V1=___________;?
或溶质的质量不变,公式?V1·ρ1 ·ω1=___________。
混合前后溶液中溶质的质量或物质的量守恒求解,
(1)若混合后忽略溶液体积变化时:?
?c1V1+c2V2=c混( )?
c2 V2 V2·ρ2·ω2 V1 + V2 (2)若混合后考虑溶液体积变化时:?
?c1V1+c2V2=c混·V混 其中:V混=溶液混合规律:1、两种溶液(或与水)等质量混合,混合液质量分数一定是和的一半;2、两种溶液等体积混合:
若ρ>1,混合液质量分数大于和的一半;
若ρ<1,混合液质量分数小于和的一半;3、溶液与水等质量混合:
若ρ>1,混合液物质的量浓度小于和的一半;
若ρ<1,混合液物质的量浓度大于和的一半。4、溶液与水等体积混合:
若ρ>1,混合液质量分数(物质的量浓度)大于和的一半;
若ρ<1,混合液质量分数(物质的量浓度)小于和的一半。金榜P19左下角 P20右上角
(2)稀释溶液溶质物质的量不变
(3)取溶液,浓度不变二、有关物质的量浓度的计算(1)若固体溶于水,应注意溶质的变化。如Na、Na2O、Na2O2、NaOH溶于水后溶质均是NaOH;SO3→H2SO4;有些物质溶于水后溶液成分复杂,如NH3溶于水,仍然以NH3作为溶质(2)带结晶水的物质作为溶质时,其“物质的量”的计算,用带结晶水的物质的质量除以带有结晶水的物质的摩尔质量即可。如用ag CuSO4·5H2O配制硫酸铜溶液,溶质仍为CuSO4,其物质的量为
n(CuSO4) = 。1、注意事项(3)标准状况下气体(如HCl、NH3)溶解于水后所得溶液的物质的量浓度,参考金榜1号P18习题册P237 第七题:在标准状况下,1体积水溶解700体积氨气,所得溶液的密度是0.9 g·cm-3。则该氨水中溶质的物质的量浓度为( ),质量分数为( ) 氨气的质量为:
m (NH3)= 31.25 mol×17 g·mol-1=531.25 g 氨水的质量为:
m(氨水)=531.25 g+1000 mL×1 g·mol-1=1531.25 g质量分数为:
ω(氨水)=m(NH3)/m(氨水)×100%=34.7% 物质的量浓度为:
c(氨水)= 1000ρ ·ω/M
=1000× 0.9 g·cm-3 × 34.7%/17 g·mol-1 =18.4 mol·L-1 2、溶液中溶质质量分数(ω)与物质的量浓度
的换算:可应用公式cB= _________________
或ωB=_________________相互换算。3、若已知饱和溶液溶解度(S),
可应用公式cB=三、配制一定物质的量浓度溶液的实验1、容量瓶是细颈、梨形的平底玻璃瓶用于精确配制一定物质的量浓度溶液的仪器。容量瓶有不同的规格:常用的有100mL、250mL、500mL、1000mL(1)容量瓶上标有________、________和_____________。刻度线容量温度(200C)强调: 刻度线表示在所指温度下,液体的凹液面与容量瓶颈部刻度线相切时,表示瓶内溶液体积恰好等于瓶上标注的体积。(2)容量瓶的使用应注意:①使用前要检查__________;②不得在容量瓶中溶解固体或稀释浓溶液、存放溶液、不得加热;③不能先用试剂润洗。是否漏水完成金榜P19 容量瓶的使用 往瓶内加水,塞紧瓶塞,用食指顶住瓶塞,另一只手托住瓶底,把瓶倒立过来,观察瓶塞周围是否有水漏出 。如果不漏水,把瓶塞旋转1800后塞紧,仍把瓶倒立过来,再检查是否漏水,经检查不漏水的容量瓶才能使用。使用容量瓶前检查它是否漏水的方法2、配制物质的量浓度溶液的步骤及所用仪器(1)计算;(2)____(______________)或 _______( _______________);
(3)_________(__________________);
(4)静置冷却;(5)______(_______________________)
(6)_______;(7)定容(_________);(8)摇匀;(9)装瓶(贴好标签)称量托盘天平、药匙溶解或稀释量筒、烧杯、玻璃棒量取量筒、胶头滴管转移相应容积的容量瓶、玻璃棒洗涤胶头滴管以配制1000 mL、1.0 mol/L的NaCl溶液为例实验步骤?
(1)计算:计算所需 NaCl固体的质量为________。
(2)称量:根据计算结果,称量 NaCl固体。
(3)溶解:将称量好的 NaCl固体放入烧杯中,加适量水溶解,并用_________搅拌
(4)转移:待恢复到_______后,将溶液转移到______________中。玻璃棒 58.5 g 室温 1000 mL容量瓶 (5)洗涤:用适量蒸馏水将烧杯及玻璃棒洗涤________次,将每次洗涤液也注入容量瓶中,并振荡容量瓶。?
(6)定容:往容量瓶中缓慢加蒸馏水,等液面离容量瓶颈刻度线________cm时,改用_________滴加蒸馏水至液面与刻度线________。塞好瓶塞,反复上下颠倒,摇匀。2~3 1~2 相切 胶头滴管 完成金榜P18 整合拓展:应注意问题3、配制误差分析(1)若未用蒸馏水洗涤烧杯、玻璃棒,则溶质的质量________,结果偏________。
(2)将烧杯中的溶液转移到容量瓶时不慎洒到容量瓶外,则溶质的质量________,结果偏__________。?
(3)若俯视读数时,实际的液面高度比刻度线__________,结果偏__________。?低 减小 减小 低 高 低 四、溶液的稀释与混合?
稀释前后,溶液中溶质的物质的量不变,公式?
?c1·V1=___________;?
或溶质的质量不变,公式?V1·ρ1 ·ω1=___________。
混合前后溶液中溶质的质量或物质的量守恒求解,
(1)若混合后忽略溶液体积变化时:?
?c1V1+c2V2=c混( )?
c2 V2 V2·ρ2·ω2 V1 + V2 (2)若混合后考虑溶液体积变化时:?
?c1V1+c2V2=c混·V混 其中:V混=溶液混合规律:1、两种溶液(或与水)等质量混合,混合液质量分数一定是和的一半;2、两种溶液等体积混合:
若ρ>1,混合液质量分数大于和的一半;
若ρ<1,混合液质量分数小于和的一半;3、溶液与水等质量混合:
若ρ>1,混合液物质的量浓度小于和的一半;
若ρ<1,混合液物质的量浓度大于和的一半。4、溶液与水等体积混合:
若ρ>1,混合液质量分数(物质的量浓度)大于和的一半;
若ρ<1,混合液质量分数(物质的量浓度)小于和的一半。金榜P19左下角 P20右上角
