物质的量浓度
图片预览





文档简介
课件13张PPT。溶液的配制与分析[练习] 在标准情况下,33.6L的CO2的物质的量是多少?质量是多少?含有多少个氧原子?小结:练习:某饱和溶液的溶解度为25g,其溶液的质量分数为____________。
某饱和溶液的质量分数为25 % ,其溶解度为___________。
20%33.3g
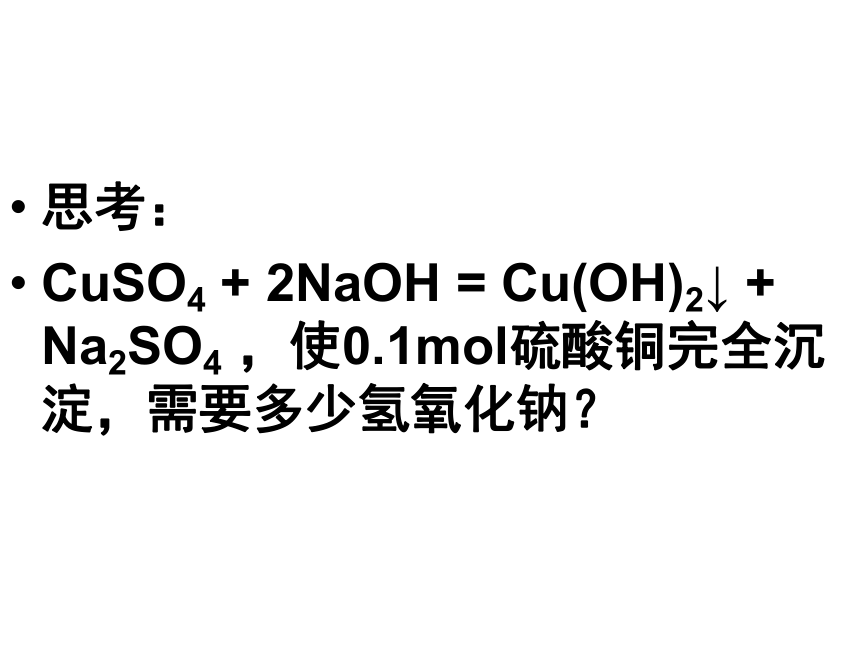
思考:
CuSO4 + 2NaOH = Cu(OH)2↓ + Na2SO4 ,使0.1mol硫酸铜完全沉淀,需要多少氢氧化钠? 许多化学反应是在溶液中进行的,生产和科学研究中经常要对溶液进行定量分析、定量计算,我们需要一个可以通过溶液体积直接计算溶质的物质的量的物理量。物质的量浓度常用单位:c(B)c(B)=mol/L(或 mol·L-1)单位体积溶液中所含溶质B的物质的量.定义:符号:数学表达式: 练习
1.2molNaOH配成200mL溶液,其物质的量浓度为____mol/L。
2.物质的量浓度为2mol/L的硫酸溶液500mL,含硫酸的物质的量为___mol.
3.标准状况下,22.4LHCl溶于水配成0.5L盐酸,其物质的量浓度为__mol/L。
4.10mol HCl能配成____L物质的量浓度为2mol/L的盐酸 ?cB(溶液)×V(aq)÷V(aq)课堂小结例题:将53.0gNa2CO3 溶解在水中,配成500mL溶液,求所得溶液中溶质的物质的量浓度。解:n(Na2CO3) = m(Na2CO3) /M(Na2CO3)
= 53.0g/106g?mol-1 = 0. 500molc(Na2CO3) = n(Na2CO3) /V = 0. 500mol/0.500L= 1.00mol/L答:溶液中Na2CO3的物质的量浓度为1.00mol/L。解: n(NaCl) =c(NaCl) × V= 0.200 mol/L × 0.500 L=0.100molm(NaCl)= n(NaCl) × M(NaCl)=0.100 mol × 58.5g/mol=5.85g答:所需NaCl的物质的量是0.1mol,质量是5.85g。 配制500ml 0.200mol/L的NaCl溶液, 需NaCl 的物质的量是多少? 质量是多少?练习[思考]在一瓶溶液的体积为2L,物质的量浓度为2mol/L的NaCl溶液中再加入0.1L的水,请问该溶液中什么改变了?什么没有改变?
某饱和溶液的质量分数为25 % ,其溶解度为___________。
20%33.3g
思考:
CuSO4 + 2NaOH = Cu(OH)2↓ + Na2SO4 ,使0.1mol硫酸铜完全沉淀,需要多少氢氧化钠? 许多化学反应是在溶液中进行的,生产和科学研究中经常要对溶液进行定量分析、定量计算,我们需要一个可以通过溶液体积直接计算溶质的物质的量的物理量。物质的量浓度常用单位:c(B)c(B)=mol/L(或 mol·L-1)单位体积溶液中所含溶质B的物质的量.定义:符号:数学表达式: 练习
1.2molNaOH配成200mL溶液,其物质的量浓度为____mol/L。
2.物质的量浓度为2mol/L的硫酸溶液500mL,含硫酸的物质的量为___mol.
3.标准状况下,22.4LHCl溶于水配成0.5L盐酸,其物质的量浓度为__mol/L。
4.10mol HCl能配成____L物质的量浓度为2mol/L的盐酸 ?cB(溶液)×V(aq)÷V(aq)课堂小结例题:将53.0gNa2CO3 溶解在水中,配成500mL溶液,求所得溶液中溶质的物质的量浓度。解:n(Na2CO3) = m(Na2CO3) /M(Na2CO3)
= 53.0g/106g?mol-1 = 0. 500molc(Na2CO3) = n(Na2CO3) /V = 0. 500mol/0.500L= 1.00mol/L答:溶液中Na2CO3的物质的量浓度为1.00mol/L。解: n(NaCl) =c(NaCl) × V= 0.200 mol/L × 0.500 L=0.100molm(NaCl)= n(NaCl) × M(NaCl)=0.100 mol × 58.5g/mol=5.85g答:所需NaCl的物质的量是0.1mol,质量是5.85g。 配制500ml 0.200mol/L的NaCl溶液, 需NaCl 的物质的量是多少? 质量是多少?练习[思考]在一瓶溶液的体积为2L,物质的量浓度为2mol/L的NaCl溶液中再加入0.1L的水,请问该溶液中什么改变了?什么没有改变?
