溶液的配制及分析
图片预览




文档简介
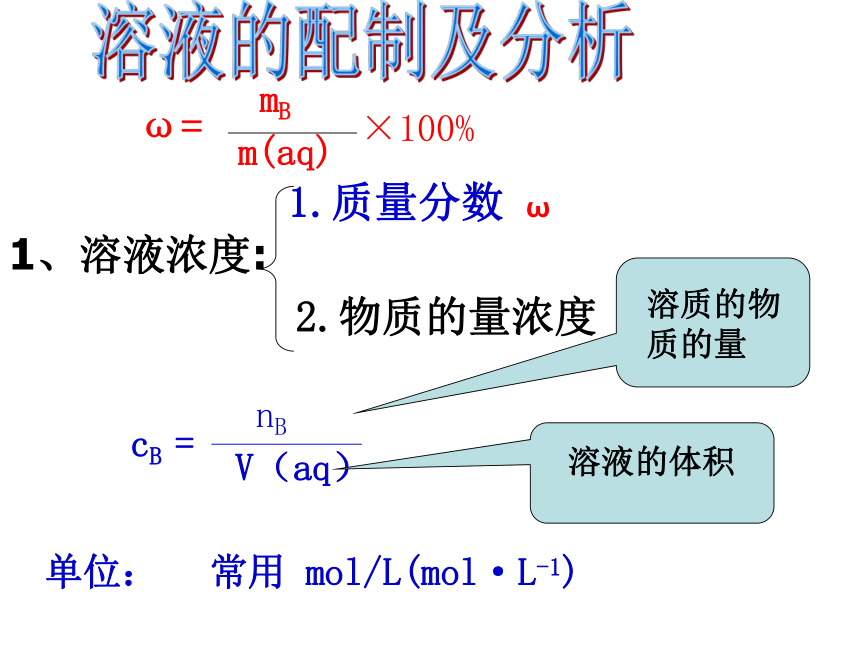
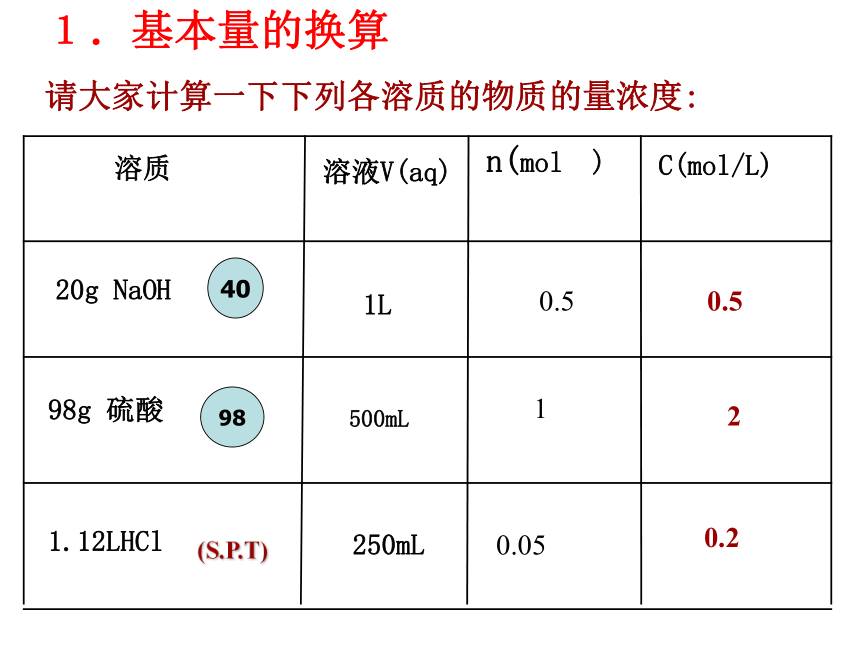
课件17张PPT。溶液的配制及分析1、溶液浓度:1.质量分数 ω 2.物质的量浓度 CB单位:常用 mol/L(mol·L-1)2:计 算1.基本量的换算2.溶液中溶质微粒数目的计算3.质量分数与物质的量浓度的换算4.溶液稀释与浓缩5.两种不同浓度溶液混合6.化学反应中计算请大家计算一下下列各溶质的物质的量浓度:0.520.20.510.051.基本量的换算例1:将2.86gNa2CO3 .10H2O配成100mL溶液,求溶液的物质的量浓度。
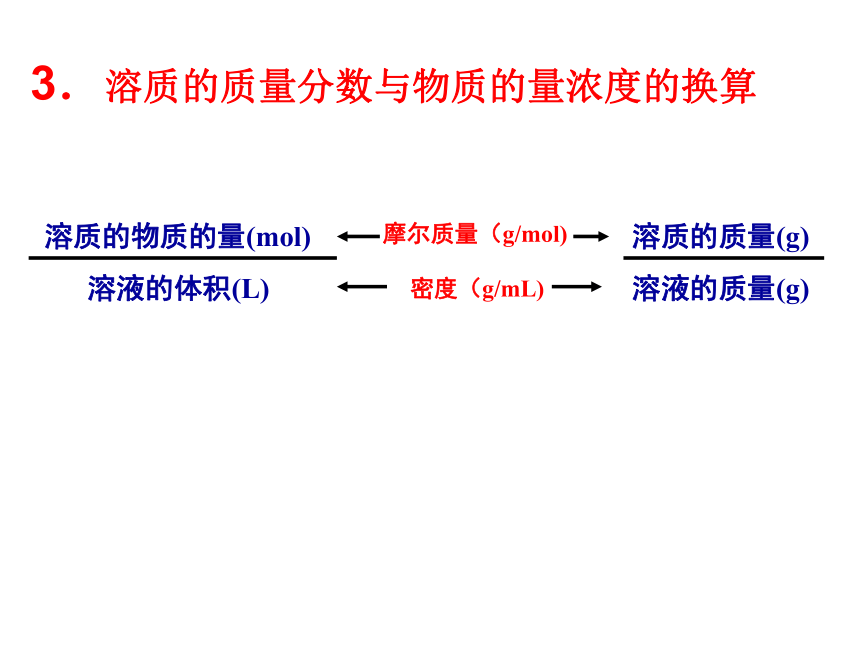
(286)例2、已知Vml Al2(SO4)3溶液中含Al3+ ag,则C(SO42+)?2.溶液中溶质微粒数目的计算 1、2L 1mol/L的H2SO4溶液,含溶质的物质的量为 mol,含H+ 个,SO42- 个。 22.408×10241.204×10242. 在1mol/L的Na2SO4溶液中含Na+ 个。3.溶质的质量分数与物质的量浓度的换算
摩尔质量(g/mol) 密度(g/mL)例:某浓硝酸中溶质的质量分数为94%,密度为1.5g/cm3。计算该浓硝酸中HNO3的物质的量浓度。
解:设有1000ml硝酸溶液,则m(HNO3) =ρ[HNO3(aq)]·V[HNO3(aq)]·ω(HNO3)
= 1.5g/cm3×1000cm3×94% =1410g
n(HNO3) = m(HNO3)/M(HNO3) =1410g/63g·mol-1
= 22.4mol
答:该硝酸中HNO3的物质的量浓度为22.4mol/L思路:C = n / V 例:2mol/LNaOH溶液(ρ=1.08g/cm3) 的溶质的质量分数为:解:设有1L NaOH溶液,则m(NaOH) = 2mol/L×1L×40g/mol = 80g
m[NaOH(aq)]=1.08g/cm3×1000cm3= 1080g
ω[NaOH(aq)] = 80g/1080g×100% = 7.4%
答:该溶液溶质的质量分数为7.4%思路: ω = m B /m(aq ) 4.有关溶液稀释和浓缩的计算
思路:稀释溶液前后溶质的物质的量相等
结论:浓溶液配制稀溶液前后溶质的量不变
C1V1= C2V2 1。将10毫升2 mol/L的硫酸溶液加水稀释到0.5mol/L,其体积为多少毫升?
解:10mL×2mol/L=V[H2SO4(aq)]×0.5mol/L
2。配制500mL1 mol/L的H2SO4溶液,需要密度为1.8g/mL的浓硫酸(98%硫酸)多少毫升?
解: 0.5×1=V×1.8×98%÷983、从1L 1mol/L蔗糖溶液中分别取出100mL、10mL、1mL,取出的溶液中蔗糖的物质的量浓度及物质的量各是多少?1110.10.010.001溶质的物质的量不同。一种溶液,取用体积不同,物质的量浓度是不变结论:4、已知Vml Al2(SO4)3溶液中含Al3+ ag,则C(SO42+)?若从其中取出0.1Vml
并稀释至Vml,则此时溶液中则C(SO42+)? 一起来试试! 中和1升0.5 mol/LNaOH溶液,需要多少升 1mol/LH2SO4溶液?
5.有关溶液反应的计算 解: 2NaOH~~~~H2SO4
2mol 1mol
1L×0.5mol/L V[H2SO4(aq)]×1mol/L6.有关两种不同浓度溶液混合的计算
C3V3 = C1V1+C2V2
(混合前后溶质的物质的量总和不变)1、2 mol/L的盐酸溶液200mL和4 mol/L的盐酸溶液100mL混合(假定混合后液体体积不变)。
求(1)混合后溶液中盐酸的物质的量浓度。 (2)混合后溶液中H+的浓度。
2、与100 mL0.1 mol/L (NH4)2SO4溶液中NH4+离子浓度相同的是
A.10 mL 1 mol/L (NH4)2SO4溶液
B.50 mL 0.1 mol/L NH4Cl溶液
C.200 mL0.05 mol/L (NH4)2SO4溶液
D.200 mL 0.2 mol/L NH4NO3溶液思考: ( D ) 1、100ml 0.1mol/LNa2SO4溶液中Na+浓度为 .小结:一、物质的量浓度
二、有关物质的量浓度的计算1.基本量的换算
2.在物质的量浓度溶液中溶质微粒数目的计算
3.溶液中溶质的质量分数与物质的量浓度的换算
4.有关溶液稀释和浓缩的计算
5. 有关溶液反应的计算
6、有关两种不同浓度溶液混合的计算
(286)例2、已知Vml Al2(SO4)3溶液中含Al3+ ag,则C(SO42+)?2.溶液中溶质微粒数目的计算 1、2L 1mol/L的H2SO4溶液,含溶质的物质的量为 mol,含H+ 个,SO42- 个。 22.408×10241.204×10242. 在1mol/L的Na2SO4溶液中含Na+ 个。3.溶质的质量分数与物质的量浓度的换算
摩尔质量(g/mol) 密度(g/mL)例:某浓硝酸中溶质的质量分数为94%,密度为1.5g/cm3。计算该浓硝酸中HNO3的物质的量浓度。
解:设有1000ml硝酸溶液,则m(HNO3) =ρ[HNO3(aq)]·V[HNO3(aq)]·ω(HNO3)
= 1.5g/cm3×1000cm3×94% =1410g
n(HNO3) = m(HNO3)/M(HNO3) =1410g/63g·mol-1
= 22.4mol
答:该硝酸中HNO3的物质的量浓度为22.4mol/L思路:C = n / V 例:2mol/LNaOH溶液(ρ=1.08g/cm3) 的溶质的质量分数为:解:设有1L NaOH溶液,则m(NaOH) = 2mol/L×1L×40g/mol = 80g
m[NaOH(aq)]=1.08g/cm3×1000cm3= 1080g
ω[NaOH(aq)] = 80g/1080g×100% = 7.4%
答:该溶液溶质的质量分数为7.4%思路: ω = m B /m(aq ) 4.有关溶液稀释和浓缩的计算
思路:稀释溶液前后溶质的物质的量相等
结论:浓溶液配制稀溶液前后溶质的量不变
C1V1= C2V2 1。将10毫升2 mol/L的硫酸溶液加水稀释到0.5mol/L,其体积为多少毫升?
解:10mL×2mol/L=V[H2SO4(aq)]×0.5mol/L
2。配制500mL1 mol/L的H2SO4溶液,需要密度为1.8g/mL的浓硫酸(98%硫酸)多少毫升?
解: 0.5×1=V×1.8×98%÷983、从1L 1mol/L蔗糖溶液中分别取出100mL、10mL、1mL,取出的溶液中蔗糖的物质的量浓度及物质的量各是多少?1110.10.010.001溶质的物质的量不同。一种溶液,取用体积不同,物质的量浓度是不变结论:4、已知Vml Al2(SO4)3溶液中含Al3+ ag,则C(SO42+)?若从其中取出0.1Vml
并稀释至Vml,则此时溶液中则C(SO42+)? 一起来试试! 中和1升0.5 mol/LNaOH溶液,需要多少升 1mol/LH2SO4溶液?
5.有关溶液反应的计算 解: 2NaOH~~~~H2SO4
2mol 1mol
1L×0.5mol/L V[H2SO4(aq)]×1mol/L6.有关两种不同浓度溶液混合的计算
C3V3 = C1V1+C2V2
(混合前后溶质的物质的量总和不变)1、2 mol/L的盐酸溶液200mL和4 mol/L的盐酸溶液100mL混合(假定混合后液体体积不变)。
求(1)混合后溶液中盐酸的物质的量浓度。 (2)混合后溶液中H+的浓度。
2、与100 mL0.1 mol/L (NH4)2SO4溶液中NH4+离子浓度相同的是
A.10 mL 1 mol/L (NH4)2SO4溶液
B.50 mL 0.1 mol/L NH4Cl溶液
C.200 mL0.05 mol/L (NH4)2SO4溶液
D.200 mL 0.2 mol/L NH4NO3溶液思考: ( D ) 1、100ml 0.1mol/LNa2SO4溶液中Na+浓度为 .小结:一、物质的量浓度
二、有关物质的量浓度的计算1.基本量的换算
2.在物质的量浓度溶液中溶质微粒数目的计算
3.溶液中溶质的质量分数与物质的量浓度的换算
4.有关溶液稀释和浓缩的计算
5. 有关溶液反应的计算
6、有关两种不同浓度溶液混合的计算
