(新人教版必修2)化学:1.1.1《元素周期表》课件
文档属性
| 名称 | (新人教版必修2)化学:1.1.1《元素周期表》课件 |
|
|
| 格式 | rar | ||
| 文件大小 | 1.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2010-08-19 00:00:00 | ||
图片预览



文档简介
课件9张PPT。第一章
物质结构 元素周期律第一节 (第1课时)学习目标:
1、了解元素周期表的结构和元素在元素周期表中的位置。
2、通过探究元素的性质与原子结构,进一步理解元素周期表。
3、充分发挥学生的主动性,培养实践能力和归纳能力。
重点:元素周期表的结构。
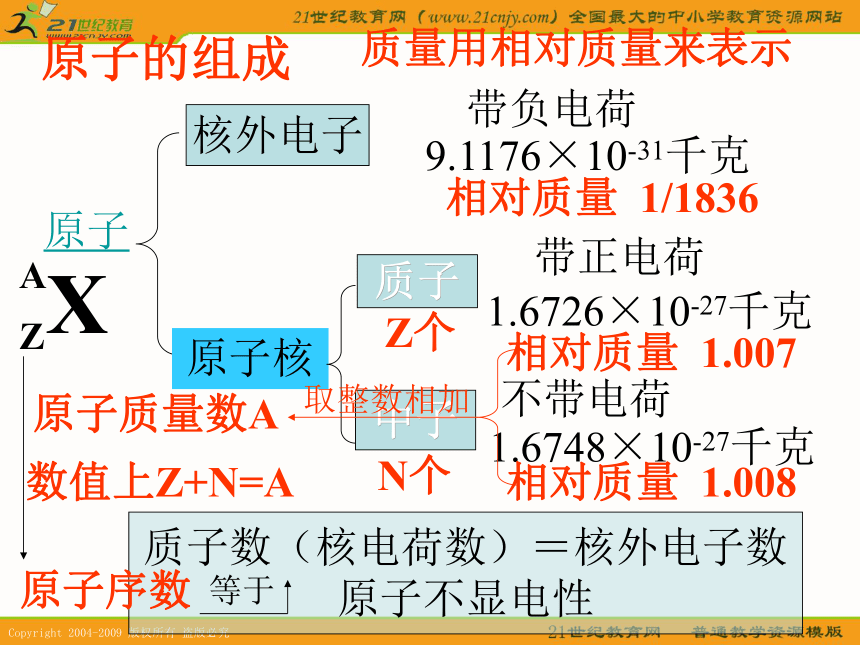
难点:元素在周期表中的位置。原子的组成原子原子核质子中子带负电荷带正电荷不带电荷1.6748×10-27千克 1.6726×10-27千克 9.1176×10-31千克 质子数(核电荷数)=核外电子数
原子不显电性核外电子质量用相对质量来表示相对质量 1/1836相对质量 1.007相对质量 1.008Z个N个原子质量数A数值上Z+N=A取整数相加原子序数等于 元素的性质取决于原子核外电子的排布——用原子结构示意图表示练习:画1~18号元素的原子结构示意图 1869年,俄国化学家门捷列夫通过分类、归纳、制出了第一张元素周期表,揭示了化学元素的内在联系,使其构成了一个完整的体系(不但将当时已发现的63种列在表中,还留下了一些空格,预示这些元素的存在),成为化学发展史上的一个重要里程碑。同电子层——同横行同最外层电子——同纵行 1869年门捷列夫在继承和分析了前人工作的基础上,对大量实验事实进行了订正、分析和概括,成功地对元素进行了科学分类。他总结出一条规律:元素(以及由它所形成的单质和化合物)的性质随着相对原子质量的递增而呈现周期性的变化。这就是元素周期律。
他还预言了一些未知元素的性质都得到了证实。但是由于时代的局限,门捷列夫揭示的元素内在联系的规律还是初步的,他未能认识到形成元素性质周期性变化的根本原因。周期表的编排原则1、按照原子序数递增的顺序从左到右排列将电子层数相同的元素排成一个横行2、把最外层电子数相同的元素(个别例外)
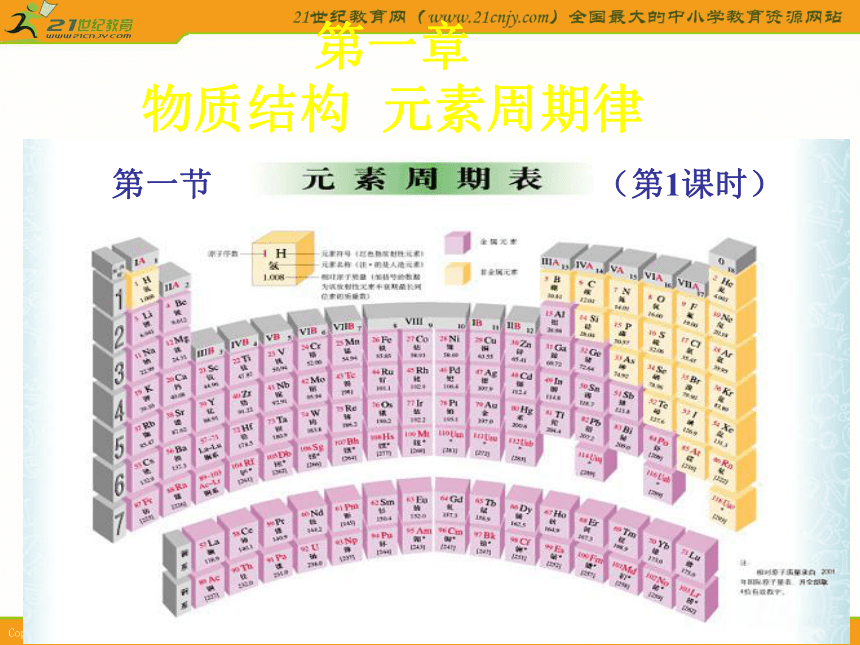
按电子层数递增的顺序从上到下排成纵行一、元素周期表周期表的结构周
期
表7个周期7个主族:由短周期和长周期
元素共同构成的族(IA~VIIA)7个副族:仅由长周期构成的族
(ⅠB~ⅦB)VIII族(3个纵行):Fe、Co、Ni等9种元素横的方面
(7个横行)纵的方面(18个纵行)零族:稀有气体元素12345672种元素8种元素8种元素18种元素18种元素32种元素26种元素短周期长周期不完全周期元素周期表助记词横行叫周期,共有七周期;
三四分长短,第七不完全。
纵行称作族,共有十六族;
二、三分主副,先主后副族;
VIII族最特殊,三行是一族;
二次分主副,副后是主族。
一、八依次现,一、零再一遍。
锕、镧各十五,均属IIIB族。布置作业1、熟记1~36号元素顺序和符号
2、熟记主族和零族元素名称和符号
1、了解元素周期表的结构和元素在元素周期表中的位置。
2、通过探究元素的性质与原子结构,进一步理解元素周期表。
3、充分发挥学生的主动性,培养实践能力和归纳能力。
重点:元素周期表的结构。
难点:元素在周期表中的位置。原子的组成原子原子核质子中子带负电荷带正电荷不带电荷1.6748×10-27千克 1.6726×10-27千克 9.1176×10-31千克 质子数(核电荷数)=核外电子数
原子不显电性核外电子质量用相对质量来表示相对质量 1/1836相对质量 1.007相对质量 1.008Z个N个原子质量数A数值上Z+N=A取整数相加原子序数等于 元素的性质取决于原子核外电子的排布——用原子结构示意图表示练习:画1~18号元素的原子结构示意图 1869年,俄国化学家门捷列夫通过分类、归纳、制出了第一张元素周期表,揭示了化学元素的内在联系,使其构成了一个完整的体系(不但将当时已发现的63种列在表中,还留下了一些空格,预示这些元素的存在),成为化学发展史上的一个重要里程碑。同电子层——同横行同最外层电子——同纵行 1869年门捷列夫在继承和分析了前人工作的基础上,对大量实验事实进行了订正、分析和概括,成功地对元素进行了科学分类。他总结出一条规律:元素(以及由它所形成的单质和化合物)的性质随着相对原子质量的递增而呈现周期性的变化。这就是元素周期律。
他还预言了一些未知元素的性质都得到了证实。但是由于时代的局限,门捷列夫揭示的元素内在联系的规律还是初步的,他未能认识到形成元素性质周期性变化的根本原因。周期表的编排原则1、按照原子序数递增的顺序从左到右排列将电子层数相同的元素排成一个横行2、把最外层电子数相同的元素(个别例外)
按电子层数递增的顺序从上到下排成纵行一、元素周期表周期表的结构周
期
表7个周期7个主族:由短周期和长周期
元素共同构成的族(IA~VIIA)7个副族:仅由长周期构成的族
(ⅠB~ⅦB)VIII族(3个纵行):Fe、Co、Ni等9种元素横的方面
(7个横行)纵的方面(18个纵行)零族:稀有气体元素12345672种元素8种元素8种元素18种元素18种元素32种元素26种元素短周期长周期不完全周期元素周期表助记词横行叫周期,共有七周期;
三四分长短,第七不完全。
纵行称作族,共有十六族;
二、三分主副,先主后副族;
VIII族最特殊,三行是一族;
二次分主副,副后是主族。
一、八依次现,一、零再一遍。
锕、镧各十五,均属IIIB族。布置作业1、熟记1~36号元素顺序和符号
2、熟记主族和零族元素名称和符号
