化学计量在实验中的应用
图片预览





文档简介
课件19张PPT。化学计量在实验中的应用配合新人教版高一化学(必修1)第一章第二节第一课时如何知道一滴水中含有多少个分子呢?想一想:讨论:计算一滴水中所含的水分子个数
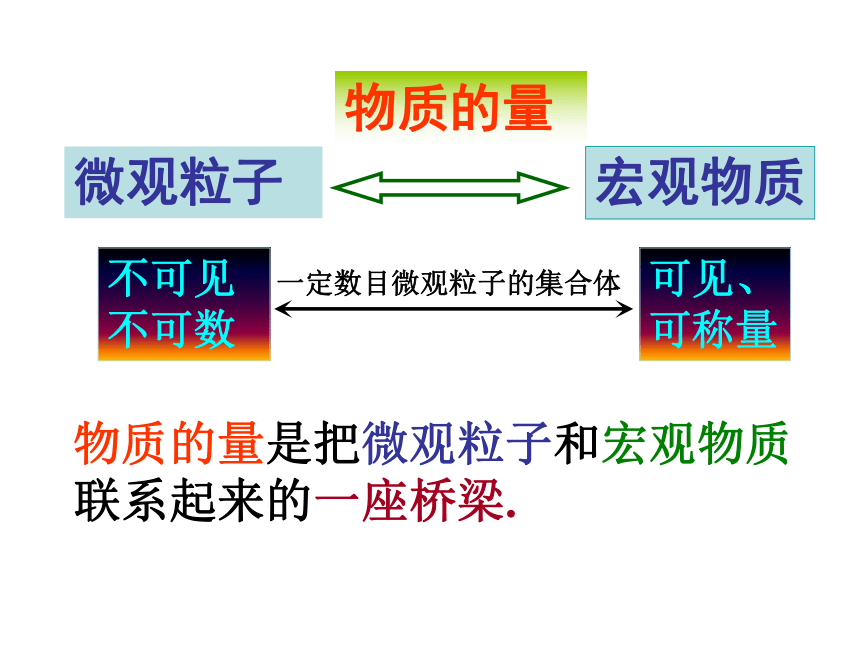
(一滴水的质量、一个水分子的质量、一定数目水分子集合体的质量、一定数目水分子集合体所含水分子个数) 不可见不可数微观粒子宏观物质可见、可称量物质的量物质的量是把微观粒子和宏观物质联系起来的一座桥梁.一定数目微观粒子的集合体一、物质的量的单位——摩尔1、物质的量定义:符号:单位: 表示一定数目微观粒子的
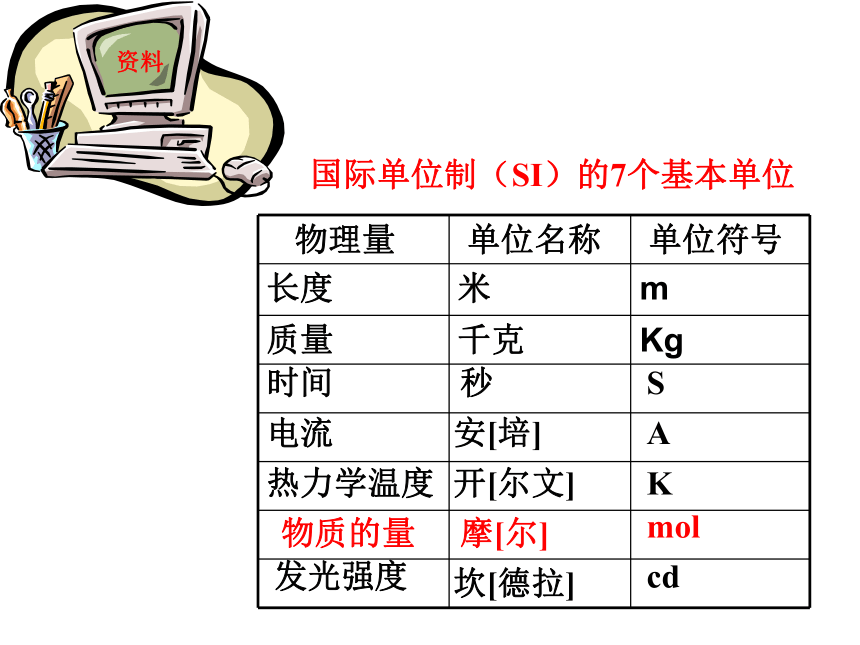
集合体。n摩尔(mol)资料国际单位制(SI)的7个基本单位物质的量摩[尔]mol注意:(1)“物质的量”是一个物理量,是一个整体,不得简化或增加任何字,是个专有名词,
摩尔是它的单位。(2)只适用于微观粒子——分子、原子、 离子、原子团、电子、质子等
(3)使用时应指明粒子的种类。(一般后面跟化学式)
A、物质的量就是物质的质量
B、物质的量指物质的数量
C、物质的量是国际单位制中的一个基
本物理量
D、物质的量是描述物质多少的C[思考与交流]1、下列叙述正确的是( )2、判断并分析下列说法正确的是( )A、0.5mol O B、2 mol Na+
C、2 mol 氧 D、1mol 汽车
E、5mol H2OA、B、E 国际上规定, 1mol粒子集体所含的粒子数与0.012kg 12C中所含的碳原子数相同。约为6.02×1023 定义:2、阿伏加德罗常数符号:NA单位:mol-16.02×1023 mol-1NA≈1mol粒子集体所含粒子数。感受阿伏加德罗常数 如果把6.02×1023个直径为2.5cm的硬币排
成一行,可以来回于地球与太阳之间240.8亿次 如果把 6.02×1023 粒米给全球60亿人吃,
每人每天吃一斤,要吃14万年,只用来表示原子、分子、离子等微观粒子。所以物质的量n 、 NA 、N三者之间的关系N =n × NA问题探究:看下表,找出1mol物质的质量有什么规律结论:1mol任何粒子或物质的质量以g为单位时,数值上都与其相对分子质量(或相对原子质量)相等.16g
27g
2g
18 g
16 27 2 183、摩尔质量定义:单位物质的量的物质所具有的质量。符号:M常用单位:克/摩(g/mol或g·mol-1)
n、m、M三者之间的关系m =n × M24.5g H2SO4的物质的量是多少 ?
(H2SO4的相对分子质量为98)解:H2SO4的摩尔质量为98g/mol n( H2SO4 )==0.25mol答: 24.5gH2SO4 物质的量是0.25mol。例题一滴水的质量约为0.05g,求一滴水中所含水分子的个数? 解:n( H2O )==0.0028mol 答: 一滴水中所含水分子的个数约为1.67X1021练习N=nxNA=0.0028molX6.02X1023mol-1=1.67X1021本节课小结
三个物理量:
三个注意点:
1、物质的量是个专有名词、只适用于:
2、阿伏加德罗常数近似为:
3、摩尔质量(单位为克/摩尔时)数值等于:
物质的量、阿伏加德罗常数、摩尔质量
微观粒子、
使用时指明微粒种类(一般后面跟化学式)
6.02×1023mol-1相对分子质量或相对原子质量三个关系量:N,n,m之间的相互转化巩固练习1、下列说法不正确的是 ( )
A.物质的量是把宏观物质和微观粒子数联系起来的
一个基本物理量
B.摩尔是国际单位制中七个基本物理量之一
C.1摩尔氢气分子可以表示为1mol H2
D. 物质的量为1mol H2所含分子个数约6.02×1023个2、下列关于摩尔质量的说法正确的是 ( )
A.水的摩尔质量是18g
B.2mol水的摩尔质量是1mol水摩尔质量的2倍
C.氧气的摩尔质量与氧原子的摩尔质量相等
D.水的摩尔质量是氢气摩尔质量的9倍
BD 3、2molH2O中含有_______个H2O分子,
______ molH ,约含___________个H原子.
4、已知铁的相对原子质量为56,则1.5mol Fe的
质量是__g,所含铁原子的个数约是__________。
849.03×1023 2NA2.408×10244
(一滴水的质量、一个水分子的质量、一定数目水分子集合体的质量、一定数目水分子集合体所含水分子个数) 不可见不可数微观粒子宏观物质可见、可称量物质的量物质的量是把微观粒子和宏观物质联系起来的一座桥梁.一定数目微观粒子的集合体一、物质的量的单位——摩尔1、物质的量定义:符号:单位: 表示一定数目微观粒子的
集合体。n摩尔(mol)资料国际单位制(SI)的7个基本单位物质的量摩[尔]mol注意:(1)“物质的量”是一个物理量,是一个整体,不得简化或增加任何字,是个专有名词,
摩尔是它的单位。(2)只适用于微观粒子——分子、原子、 离子、原子团、电子、质子等
(3)使用时应指明粒子的种类。(一般后面跟化学式)
A、物质的量就是物质的质量
B、物质的量指物质的数量
C、物质的量是国际单位制中的一个基
本物理量
D、物质的量是描述物质多少的C[思考与交流]1、下列叙述正确的是( )2、判断并分析下列说法正确的是( )A、0.5mol O B、2 mol Na+
C、2 mol 氧 D、1mol 汽车
E、5mol H2OA、B、E 国际上规定, 1mol粒子集体所含的粒子数与0.012kg 12C中所含的碳原子数相同。约为6.02×1023 定义:2、阿伏加德罗常数符号:NA单位:mol-16.02×1023 mol-1NA≈1mol粒子集体所含粒子数。感受阿伏加德罗常数 如果把6.02×1023个直径为2.5cm的硬币排
成一行,可以来回于地球与太阳之间240.8亿次 如果把 6.02×1023 粒米给全球60亿人吃,
每人每天吃一斤,要吃14万年,只用来表示原子、分子、离子等微观粒子。所以物质的量n 、 NA 、N三者之间的关系N =n × NA问题探究:看下表,找出1mol物质的质量有什么规律结论:1mol任何粒子或物质的质量以g为单位时,数值上都与其相对分子质量(或相对原子质量)相等.16g
27g
2g
18 g
16 27 2 183、摩尔质量定义:单位物质的量的物质所具有的质量。符号:M常用单位:克/摩(g/mol或g·mol-1)
n、m、M三者之间的关系m =n × M24.5g H2SO4的物质的量是多少 ?
(H2SO4的相对分子质量为98)解:H2SO4的摩尔质量为98g/mol n( H2SO4 )==0.25mol答: 24.5gH2SO4 物质的量是0.25mol。例题一滴水的质量约为0.05g,求一滴水中所含水分子的个数? 解:n( H2O )==0.0028mol 答: 一滴水中所含水分子的个数约为1.67X1021练习N=nxNA=0.0028molX6.02X1023mol-1=1.67X1021本节课小结
三个物理量:
三个注意点:
1、物质的量是个专有名词、只适用于:
2、阿伏加德罗常数近似为:
3、摩尔质量(单位为克/摩尔时)数值等于:
物质的量、阿伏加德罗常数、摩尔质量
微观粒子、
使用时指明微粒种类(一般后面跟化学式)
6.02×1023mol-1相对分子质量或相对原子质量三个关系量:N,n,m之间的相互转化巩固练习1、下列说法不正确的是 ( )
A.物质的量是把宏观物质和微观粒子数联系起来的
一个基本物理量
B.摩尔是国际单位制中七个基本物理量之一
C.1摩尔氢气分子可以表示为1mol H2
D. 物质的量为1mol H2所含分子个数约6.02×1023个2、下列关于摩尔质量的说法正确的是 ( )
A.水的摩尔质量是18g
B.2mol水的摩尔质量是1mol水摩尔质量的2倍
C.氧气的摩尔质量与氧原子的摩尔质量相等
D.水的摩尔质量是氢气摩尔质量的9倍
BD 3、2molH2O中含有_______个H2O分子,
______ molH ,约含___________个H原子.
4、已知铁的相对原子质量为56,则1.5mol Fe的
质量是__g,所含铁原子的个数约是__________。
849.03×1023 2NA2.408×10244
