离子晶体
图片预览








文档简介
课件27张PPT。离子晶体 食 盐 雪 花金刚石什么叫晶体?具有规则几何外形的固体叫晶体。晶体中的微粒按一定的规则排列。构成晶体微粒之间的作用力及空间结构。作用力越强,晶体的熔沸点越高,晶体的硬度越大。晶体的概念决定晶体物理性质的因素是什么?依据:
构成晶体的粒子种类及粒子之间的作用晶体的分类:知识目标 1. 了解离子晶体晶体结构模型及其性质的一般特点。
2. 理解离子晶体晶体类型与性质的关系。能力目标 1、空间想象能力。
2、观察能力。
3、逻辑推理能力。
硫酸铜晶体一、离子晶体 1.定义:
离子间通过离子键结合而成的晶体。2.构成
从组成上看:
活泼金属与活泼非金属元素组成的晶体。
从类别看:
强碱:KOH、Ca(OH)2 、NaOH、Ba(OH)2等。
大部分盐类:NaCl、KNO3、Na2SO4、 NH4Cl等。
某些金属氧化物:CaO、K2O等
3.离子晶体中的化学键。
分析:NaOH、Na2O2、NH4Cl、CaF2中的化学键类型 小结:
离子晶体中一定含有离子键,还可能含有
共价键(如NaOH、Ca(ClO)2等)、
离子晶体中不一定含有活泼金属的离子,
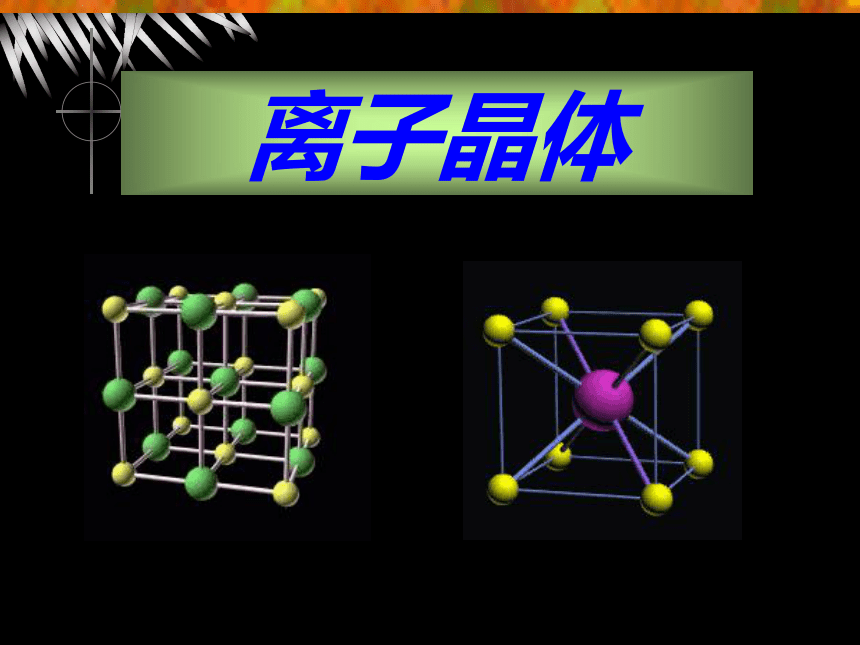
如NH4Cl晶体仅含非金属元素。 4.离子晶体的结构 每个Na+ 周围吸引着6个Cl-NaCl晶体结构模型 4.离子晶体的结构 每个Cl-周围吸引着6个Na+ NaCl晶体结构模型 4.离子晶体的结构 一个Na+ 周围吸引着6个Cl-
一个Cl-周围吸引着6个Na+ Na+和Cl-的个数比为
6:6=1:1
NaCl晶体结构模型 CsCl晶体结构模型 4.离子晶体的结构 CS+ Cl-CsCl晶体结构模型 4.离子晶体的结构 CS+ Cl-一个Cl-周围吸引着8个CS +一个CS+ 周围吸引着8个Cl-CS+ 和Cl-的个数比为:
8:8=1:1结 论:NaCl、CsCl不表示分子式,表示离子晶体中阴阳离子的个数比;离子晶体中无单个分子存在。5.离子晶体的某些物理性质 (1)较高熔点、沸点、难挥发。
(2)硬度较大,质脆。
(3)固体不导电,熔化或溶于水后能导电。
(4)大多数易溶于水中。阴阳离子 离子键 较 高 较大、脆 不导电 导电 小结较 强大多能溶于水课堂练习1、下列物质中,含有极性键的离子化合物是( )
A.CaCl2 B.Na202 C.NaOH D.K2S C2、Cs是IA族元素,F是VIIA族元素,估计Cs和F形成
的化合物可能是( )
A.离子化合物 B.化学式为CsF2
C.熔融状态能导电 D.固体能导电AC3.下列性质中,可以较充分说明某晶体是离子晶体的
是:( )
A、具有较高的熔点 B、固体不导电,水溶液导电
C、可溶于水 D、固体不导电,熔融状态能导电D4.在NaCl晶体中,与每个Na+距离相同且距离最近的几个Cl-所围成的空间几何构型为( )
A.正四面体 B.正六面体
C.正八面体 D正十二面体
C谢 谢 观 赏
构成晶体的粒子种类及粒子之间的作用晶体的分类:知识目标 1. 了解离子晶体晶体结构模型及其性质的一般特点。
2. 理解离子晶体晶体类型与性质的关系。能力目标 1、空间想象能力。
2、观察能力。
3、逻辑推理能力。
硫酸铜晶体一、离子晶体 1.定义:
离子间通过离子键结合而成的晶体。2.构成
从组成上看:
活泼金属与活泼非金属元素组成的晶体。
从类别看:
强碱:KOH、Ca(OH)2 、NaOH、Ba(OH)2等。
大部分盐类:NaCl、KNO3、Na2SO4、 NH4Cl等。
某些金属氧化物:CaO、K2O等
3.离子晶体中的化学键。
分析:NaOH、Na2O2、NH4Cl、CaF2中的化学键类型 小结:
离子晶体中一定含有离子键,还可能含有
共价键(如NaOH、Ca(ClO)2等)、
离子晶体中不一定含有活泼金属的离子,
如NH4Cl晶体仅含非金属元素。 4.离子晶体的结构 每个Na+ 周围吸引着6个Cl-NaCl晶体结构模型 4.离子晶体的结构 每个Cl-周围吸引着6个Na+ NaCl晶体结构模型 4.离子晶体的结构 一个Na+ 周围吸引着6个Cl-
一个Cl-周围吸引着6个Na+ Na+和Cl-的个数比为
6:6=1:1
NaCl晶体结构模型 CsCl晶体结构模型 4.离子晶体的结构 CS+ Cl-CsCl晶体结构模型 4.离子晶体的结构 CS+ Cl-一个Cl-周围吸引着8个CS +一个CS+ 周围吸引着8个Cl-CS+ 和Cl-的个数比为:
8:8=1:1结 论:NaCl、CsCl不表示分子式,表示离子晶体中阴阳离子的个数比;离子晶体中无单个分子存在。5.离子晶体的某些物理性质 (1)较高熔点、沸点、难挥发。
(2)硬度较大,质脆。
(3)固体不导电,熔化或溶于水后能导电。
(4)大多数易溶于水中。阴阳离子 离子键 较 高 较大、脆 不导电 导电 小结较 强大多能溶于水课堂练习1、下列物质中,含有极性键的离子化合物是( )
A.CaCl2 B.Na202 C.NaOH D.K2S C2、Cs是IA族元素,F是VIIA族元素,估计Cs和F形成
的化合物可能是( )
A.离子化合物 B.化学式为CsF2
C.熔融状态能导电 D.固体能导电AC3.下列性质中,可以较充分说明某晶体是离子晶体的
是:( )
A、具有较高的熔点 B、固体不导电,水溶液导电
C、可溶于水 D、固体不导电,熔融状态能导电D4.在NaCl晶体中,与每个Na+距离相同且距离最近的几个Cl-所围成的空间几何构型为( )
A.正四面体 B.正六面体
C.正八面体 D正十二面体
C谢 谢 观 赏
