原电池工作原理的探究
图片预览




文档简介
课件11张PPT。课题引入课题探究小试牛刀原电池工作原理(1)有两种活动性不同的金属或一种
是非金属单质或金属氧化物作电极。 (2)电极材料均插入电解质溶液中。 (3)两极相连形成闭合电路。【构成原电池的条件】 (4)自发的氧化还原反应。【课题引入】如何将化学能转换成电能?将化学能转换成电能的装置【原电池】【探究问题】返回
根据反应: Zn + H2SO4 = ZnSO4 + H2↑
设计一个原电池,并进行实验烧杯,导线,电流计,砂纸,锌片,
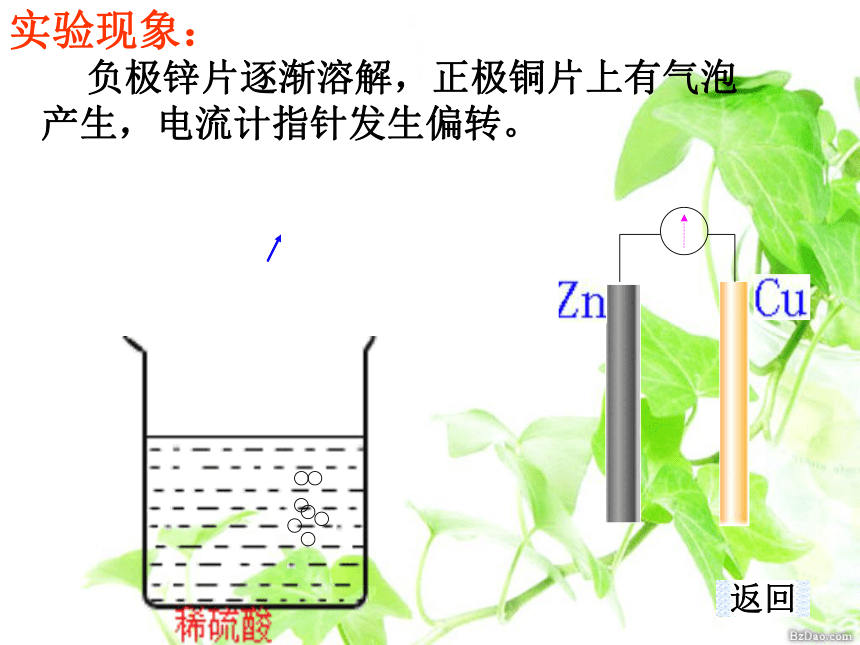
铜片,硫酸溶液工作原理实验现象实验器材实验原理【课题探究-实验探究】 负极锌片逐渐溶解,正极铜片上有气泡产生,电流计指针发生偏转。实验现象:返回1、外电路中电子的流动方向。
2、内电路中阴阳离子的移动方向。
3、产生上述实验现象的原因及电极反应。【工作原理的探究】分组讨论工作原理的探究-动画演示【成果展示】负极:Zn - 2e- = Zn2+ (氧化反应)
正极: 2H+ + 2e- = H2 ↑ (还原反应)阴离子向负极迁移
阳离子向正极迁移
由负极经导线流向正极1、电子:2、离子:3、电极反应: 在氧化还原反应中Zn失去了电子经导线流向正极,H+向正极移动得到电子产生了氢气,硫酸根向负极移动,从而形成了电子、离子的定向移动。即【工作原理】实现了化学能
转换为电能。返回某原电池的总反应的离子方程式为:
2Fe3++Fe == 3Fe2+,
不能实现该反应的原电池组成是( )
A、正极为铜,负极为铁,电解质溶液为FeCl3溶液
B、正极为碳,负极为铁,电解质溶液为Fe(NO3)3溶液
C、正极为铁,负极为锌,电解质溶液为Fe2(SO4)3溶液
D、正极为银,负极为铁,电解质溶液为CuSO4溶液CD小试牛刀下列关于原电池的叙述正确的是( )
A、构成原电池的正极和负极必须是两种不同的金属
B、原电池是将化学能转变为电能的装置
C、原电池中电子流出的一极是负极,该极被还原
D、原电池放电时,电流的方向是从负极到正极B小试牛刀返回
是非金属单质或金属氧化物作电极。 (2)电极材料均插入电解质溶液中。 (3)两极相连形成闭合电路。【构成原电池的条件】 (4)自发的氧化还原反应。【课题引入】如何将化学能转换成电能?将化学能转换成电能的装置【原电池】【探究问题】返回
根据反应: Zn + H2SO4 = ZnSO4 + H2↑
设计一个原电池,并进行实验烧杯,导线,电流计,砂纸,锌片,
铜片,硫酸溶液工作原理实验现象实验器材实验原理【课题探究-实验探究】 负极锌片逐渐溶解,正极铜片上有气泡产生,电流计指针发生偏转。实验现象:返回1、外电路中电子的流动方向。
2、内电路中阴阳离子的移动方向。
3、产生上述实验现象的原因及电极反应。【工作原理的探究】分组讨论工作原理的探究-动画演示【成果展示】负极:Zn - 2e- = Zn2+ (氧化反应)
正极: 2H+ + 2e- = H2 ↑ (还原反应)阴离子向负极迁移
阳离子向正极迁移
由负极经导线流向正极1、电子:2、离子:3、电极反应: 在氧化还原反应中Zn失去了电子经导线流向正极,H+向正极移动得到电子产生了氢气,硫酸根向负极移动,从而形成了电子、离子的定向移动。即【工作原理】实现了化学能
转换为电能。返回某原电池的总反应的离子方程式为:
2Fe3++Fe == 3Fe2+,
不能实现该反应的原电池组成是( )
A、正极为铜,负极为铁,电解质溶液为FeCl3溶液
B、正极为碳,负极为铁,电解质溶液为Fe(NO3)3溶液
C、正极为铁,负极为锌,电解质溶液为Fe2(SO4)3溶液
D、正极为银,负极为铁,电解质溶液为CuSO4溶液CD小试牛刀下列关于原电池的叙述正确的是( )
A、构成原电池的正极和负极必须是两种不同的金属
B、原电池是将化学能转变为电能的装置
C、原电池中电子流出的一极是负极,该极被还原
D、原电池放电时,电流的方向是从负极到正极B小试牛刀返回
