离子反应第一课时
图片预览






文档简介
课件19张PPT。 高一化学组第一课时 电解质1 、电解质的定义电解质:在水溶液里或熔融状态下
能够导电的化合物。(如:酸、碱、盐、部分金属氧化物等)2、电解质和非电解质电解质:凡是在水溶液中或熔融状态下,能导电的化合物。非电解质:凡是在水溶液中和熔融状态下,都不能导电的化合物。凡是在水溶液中或熔融状态下,本身能电离出离子而导电的化合物。凡是在水溶液中或熔融状态下,本身不能电离出离子而导电的化合物。一定要搞清本质!①必须是化合物(而不是混合物或者单质)②在水溶液或熔融状态下
③能够导电
电解质——以上三个条件缺一不可 铁能够导电,食盐溶液也可以导电,
①.铁是不是电解质?答: ①.铁不是电解质。②.铁为什么可以导电?铁的导电跟食盐溶液的导电有什么区别?
②金属导电是因为金属中有能够自由移动的电子。电解质的导电是因为产生能够自由移动的离子。
那么离子又是怎样产生的?何谓电离—— 电解质在水溶液中(熔融时)产生自由移动的离子的过程。实#验 原因:在水中,氯化钠晶体电离并形成了
能够自由移动的水合 钠离子和水合氯离子。
这一电离过程通常用化学用语电离方程式来表示:NaCl=Na+ + Cl- NaCl在水溶液中是如何溶解和电离的?强电解质:
弱电解质:
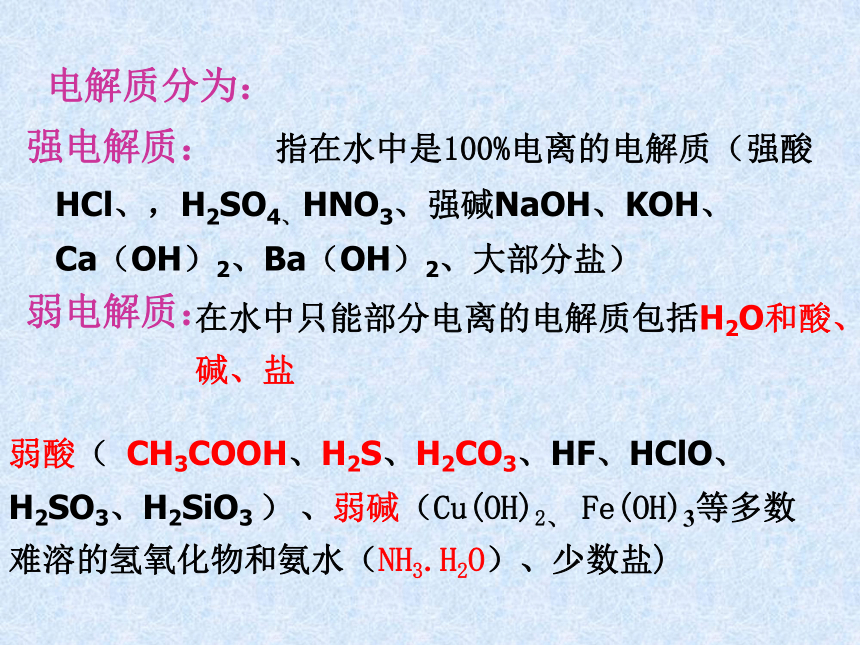
指在水中是100%电离的电解质(强酸HCl、,H2SO4、HNO3、强碱NaOH、KOH、
Ca(OH)2、Ba(OH)2、大部分盐) 在水中只能部分电离的电解质包括H2O和酸、碱、盐电解质分为:弱酸( CH3COOH、H2S、H2CO3、HF、HClO、H2SO3、H2SiO3 ) 、弱碱(Cu(OH)2、 Fe(OH)3等多数难溶的氢氧化物和氨水(NH3.H2O)、少数盐)强电解质与弱电解质的比较能溶于水的电解质一定是强电解质吗?不能溶于水的电解质一定是弱电解质吗? 都不对,溶于水≠电离电解质强弱指在水中能否全部电离,与溶于水是两回事。
如BaSO4难溶于水但是强电解质,而CH3COOH易溶于水却是弱电解质
把下列化合物
HCl、H2SO4、HNO3的电离用电离方程式表示如下:HCl=H+ +Cl- H2SO4=2H+ +SO42- HNO3=H+ +NO3-酸:凡电离时生成的阳离子全部是H+的化合物。把下列化合物NaOH 、Ba(OH)2 、Ca(OH)2的电离用电离方程式表示如下: NaOH=Na+ +OH- Ba(OH)2=Ba 2+ +2OH- Ca(OH)2=Ca 2+ +2OH-碱:凡电离时生成的阴离子全部是OH-离子的化合物。把下列化合物NaCl 、Na2SO4 、 Cu(NO3)2的电离用电离方程式表示如下:NaCl=Na+ +Cl- Na2SO4=2Na+ +SO42- Cu(NO3)2=Cu 2+ +2NO3- 盐:凡电离时生成阳离子全部是金属离子(包括NH4+)和阴离子全部是酸根离子(包括酸式酸根离子)的化合物。K2SO4=2K+ +SO42-电离方程式遵循以下几个原则:1.要遵循质量守恒和电荷守恒定律2.原子团不能拆开来写(如SO42- 不能拆) 已知NaHSO4=Na+ +H+ +SO42-,
据此判断NaHSO4属于哪类物质?
Cu2(OH)2CO3 呢? NaHSO4电离时虽然产生了H+,但是
阳离子中还有Na+,不全部是H+,不符合
酸的定义。它应该属于盐类,是酸式盐。
Cu2(OH)2CO3属于碱式盐。
1. H2SO4 2. Ba(OH)23. Na3PO4做一做把下列化合物的电离用电离方程式表示:下列属于电解质的是:CO2 、SO3 、P2O5 Cu 、Al、石墨、酒精 、 蔗糖等不是化合物NaCl溶液大部分的有机物都不是电解质BaSO4Cu(OH) 2A.B.C.D.D.常见电解质:酸、碱、盐都是电解质HCl、H2SO4 、 HNO3 等酸:NaOH、KOH 等碱:KNO3、NaCl 等盐:非金属氧化物不是电解质(部分的金属氧化物)熔融状态下能够导电的化合物。AgCl1、下列物质中导电性最差的是( )
A、熔融状态的KOH B、石墨棒
C、稀硫酸 D、固态KCl
练一练2.判断下列物质哪些是弱电解质 ①NH3.H2O ② Ca(OH)2 ③ SO3 ④ H2CO3
⑤BaCl2 ⑥ 石墨 ⑦ H2SO4 ⑧KNO3同学们再见
能够导电的化合物。(如:酸、碱、盐、部分金属氧化物等)2、电解质和非电解质电解质:凡是在水溶液中或熔融状态下,能导电的化合物。非电解质:凡是在水溶液中和熔融状态下,都不能导电的化合物。凡是在水溶液中或熔融状态下,本身能电离出离子而导电的化合物。凡是在水溶液中或熔融状态下,本身不能电离出离子而导电的化合物。一定要搞清本质!①必须是化合物(而不是混合物或者单质)②在水溶液或熔融状态下
③能够导电
电解质——以上三个条件缺一不可 铁能够导电,食盐溶液也可以导电,
①.铁是不是电解质?答: ①.铁不是电解质。②.铁为什么可以导电?铁的导电跟食盐溶液的导电有什么区别?
②金属导电是因为金属中有能够自由移动的电子。电解质的导电是因为产生能够自由移动的离子。
那么离子又是怎样产生的?何谓电离—— 电解质在水溶液中(熔融时)产生自由移动的离子的过程。实#验 原因:在水中,氯化钠晶体电离并形成了
能够自由移动的水合 钠离子和水合氯离子。
这一电离过程通常用化学用语电离方程式来表示:NaCl=Na+ + Cl- NaCl在水溶液中是如何溶解和电离的?强电解质:
弱电解质:
指在水中是100%电离的电解质(强酸HCl、,H2SO4、HNO3、强碱NaOH、KOH、
Ca(OH)2、Ba(OH)2、大部分盐) 在水中只能部分电离的电解质包括H2O和酸、碱、盐电解质分为:弱酸( CH3COOH、H2S、H2CO3、HF、HClO、H2SO3、H2SiO3 ) 、弱碱(Cu(OH)2、 Fe(OH)3等多数难溶的氢氧化物和氨水(NH3.H2O)、少数盐)强电解质与弱电解质的比较能溶于水的电解质一定是强电解质吗?不能溶于水的电解质一定是弱电解质吗? 都不对,溶于水≠电离电解质强弱指在水中能否全部电离,与溶于水是两回事。
如BaSO4难溶于水但是强电解质,而CH3COOH易溶于水却是弱电解质
把下列化合物
HCl、H2SO4、HNO3的电离用电离方程式表示如下:HCl=H+ +Cl- H2SO4=2H+ +SO42- HNO3=H+ +NO3-酸:凡电离时生成的阳离子全部是H+的化合物。把下列化合物NaOH 、Ba(OH)2 、Ca(OH)2的电离用电离方程式表示如下: NaOH=Na+ +OH- Ba(OH)2=Ba 2+ +2OH- Ca(OH)2=Ca 2+ +2OH-碱:凡电离时生成的阴离子全部是OH-离子的化合物。把下列化合物NaCl 、Na2SO4 、 Cu(NO3)2的电离用电离方程式表示如下:NaCl=Na+ +Cl- Na2SO4=2Na+ +SO42- Cu(NO3)2=Cu 2+ +2NO3- 盐:凡电离时生成阳离子全部是金属离子(包括NH4+)和阴离子全部是酸根离子(包括酸式酸根离子)的化合物。K2SO4=2K+ +SO42-电离方程式遵循以下几个原则:1.要遵循质量守恒和电荷守恒定律2.原子团不能拆开来写(如SO42- 不能拆) 已知NaHSO4=Na+ +H+ +SO42-,
据此判断NaHSO4属于哪类物质?
Cu2(OH)2CO3 呢? NaHSO4电离时虽然产生了H+,但是
阳离子中还有Na+,不全部是H+,不符合
酸的定义。它应该属于盐类,是酸式盐。
Cu2(OH)2CO3属于碱式盐。
1. H2SO4 2. Ba(OH)23. Na3PO4做一做把下列化合物的电离用电离方程式表示:下列属于电解质的是:CO2 、SO3 、P2O5 Cu 、Al、石墨、酒精 、 蔗糖等不是化合物NaCl溶液大部分的有机物都不是电解质BaSO4Cu(OH) 2A.B.C.D.D.常见电解质:酸、碱、盐都是电解质HCl、H2SO4 、 HNO3 等酸:NaOH、KOH 等碱:KNO3、NaCl 等盐:非金属氧化物不是电解质(部分的金属氧化物)熔融状态下能够导电的化合物。AgCl1、下列物质中导电性最差的是( )
A、熔融状态的KOH B、石墨棒
C、稀硫酸 D、固态KCl
练一练2.判断下列物质哪些是弱电解质 ①NH3.H2O ② Ca(OH)2 ③ SO3 ④ H2CO3
⑤BaCl2 ⑥ 石墨 ⑦ H2SO4 ⑧KNO3同学们再见
