原子结构模型的演变
图片预览






文档简介
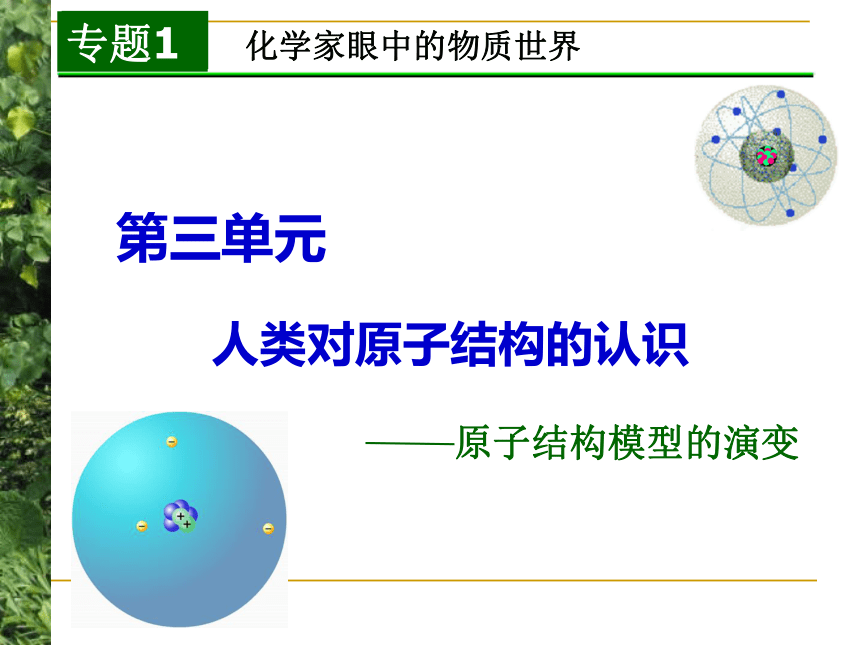
课件22张PPT。你知道吗??化学家眼中的物质世界第三单元
人类对原子结构的认识原子结构模型的演变 道尔顿原子模型(1803年):原子是实心球“葡萄干面包式”原子结构模型带核的原子结构模型分层模型电子云模型1803年,英国科学家道尔顿提出近代原子学说,
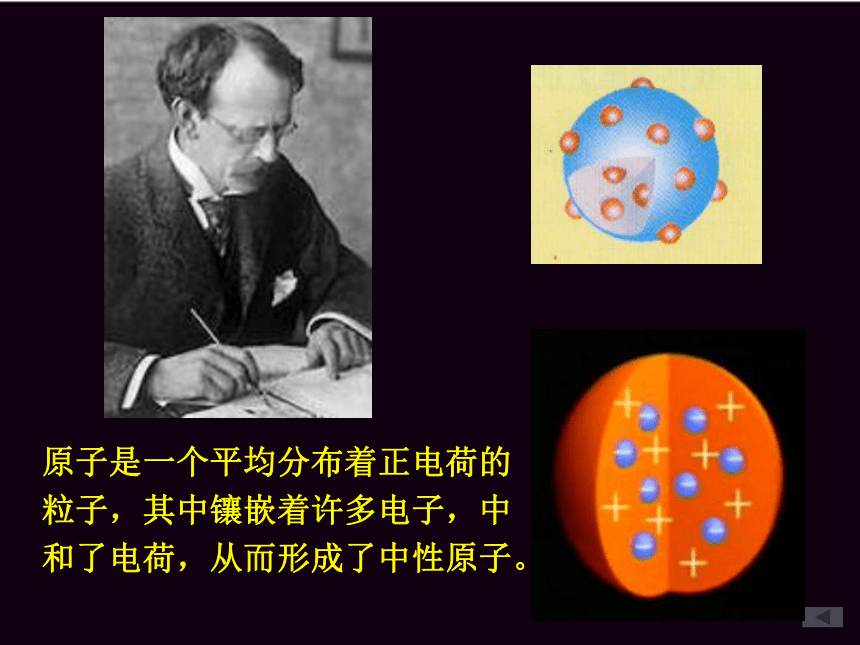
他认为原子是化学变化中不可再分的实心球体。原子是一个平均分布着正电荷的
粒子,其中镶嵌着许多电子,中
和了电荷,从而形成了中性原子。
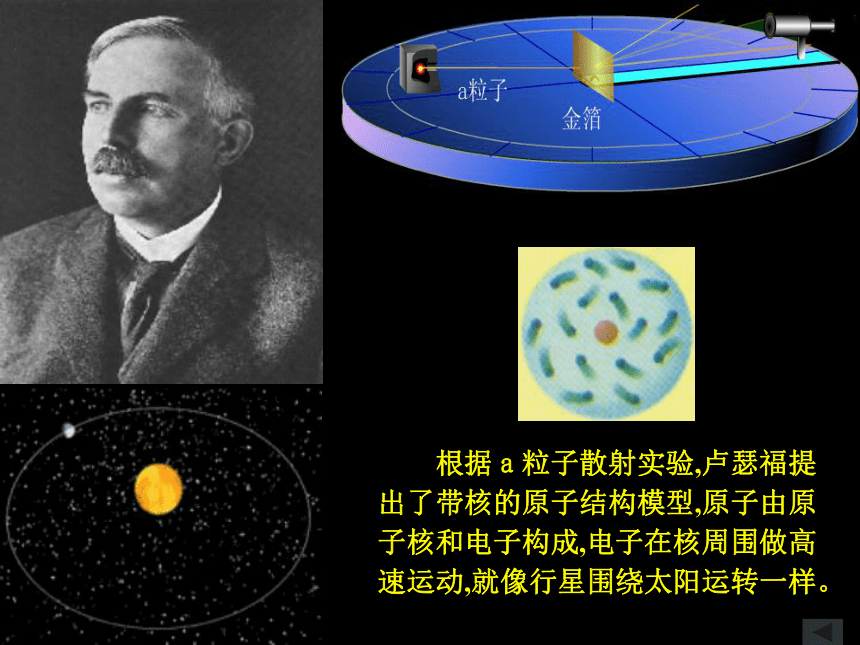
根据a粒子散射实验,卢瑟福提出了带核的原子结构模型,原子由原子核和电子构成,电子在核周围做高速运动,就像行星围绕太阳运转一样。
丹麦物理学家玻尔1913年,丹麦物理学家玻尔提出的原子结构模型,
他认为核外电子是分层排布的。二、原子核外电子排布 1、原子核外电子的分层排布原子核电子层核电荷数该电子层上的电子Ne原子的核外电子分层排布示意图
为了形象地表示原子的结构,人们就创造了“原子结构示意图”这种特殊的图形。15第1层第2层第3层K层L层M层285原子结构示意图+电子离核越远,能量也就越高。
二、原子核外电子排布 1、原子核外电子的分层排布几种原子的核外电子分层排布示意图3、原子核外电子排布规律③? 最外层最多只能容纳 8个电子(K层为最外层是2个);? 次外层最多只能容纳18个电子 倒数第三层最多只能容纳32个电子; ② 每个电子层最多只能容纳2n2电子。①能量最低原理:电子总是尽先排布在能量最低的电子层里; 即由能量 低 高经验:电子排满K层,排 层,
排满 L 层排 层LM② 每个电子层最多只能容纳2n2电子。①能量最低原理:电子总是尽先排布在能量最低的电子层里; 即由能量 低 高根据原子光谱和理论分析
核电荷数为1~20的元素原子核外电子层排布4、原子结构与元素性质的关系(结构决定性质)(1)稳定结构:即最外层为8电子的结构(K层为2个)
特点:原子既不容易失去电子又不容易得到电子(如He、Ne、Ar等)(2)不稳定结构:(如,失去: Na、Mg、Al 得到:F、O、Cl)最外层电子数﹤4时,容易失去电子最外层电子数≧4时,容易得到电子讨论完成下表:少于4易失电子不稳定较活泼多于4不稳定易得电子较活泼2或8稳定不易得失较稳定三类不同元素的原子结构特点与化学性质的关系结论:元素的化学性质与最外层电子数关系密切最外层电子数决定化学性质氧化镁的形成结论1、活泼金属元素的原子容易失去最外层上的电子变为带正电荷的阳离子,阳离子所带正电荷的数目等于原子失去的电子的数目。MgMg2+失去2个电子(带2个单位正电荷)2、活泼非金属元素的原子容易得到电子变为带负电荷的阴离子,阴离子所带负电荷的数目等于原子得到的电子的数目。OO2-得到2个电子(带2个单位负电荷)钠离子Na+氯离子Cl-NaCl元素化合价与最外层电子数的关系:最外层电子数﹤4时,容易失去电子最外层电子数≧4时,容易得到电子
(化合价=+失去的电子数目)
化合价=-(8-最外层电子数)关系:元素化合价在数值上等于原子失去或得到的电子数目(失为正,得为负)
问题解决+11失1+2失2-2得27得11、下列原子结构示意图正确的是( )+2+9+11+202362928102、下列结构示意图中,表示原子结构的是( )+11+17+16+32828828821ABCDABCDAD4、用下面的结构示意图的字母填空:
(1)属于金属原子的是---------;
(2)属于非金属原子的是------;
(3)属于离子结构示意图的是-----;
(4)具有稳定结构的是-------。课堂检测:课堂检测:1、19世纪末,人们开始揭示原子内部的秘密,最早发现
电子的科学家是( )
A、法国的拉瓦锡 B、瑞典的舍勒
C、英国的道尔顿 D、英国的汤姆生2、钠、镁、铝等活泼金属与活泼非金属反应时最容易
--------,氧、氟、氯等活泼非金属与活泼金属反应时容
易-----------。在化学变化过程中,------不发生变化,但
原子的-------可能会发生变化。3、镁原子最外层只有------个电子,在反应过程中容易
--------电子,所以镁元素在化合物中常显----价。写出镁
分别跟氧、氯、氮、硫等元素形成的化合物的化学式---
---。氧原子最外层有------个电子,在反应过程中容易----
电子,所以氧元素在化合物中常显----价。
再见
人类对原子结构的认识原子结构模型的演变 道尔顿原子模型(1803年):原子是实心球“葡萄干面包式”原子结构模型带核的原子结构模型分层模型电子云模型1803年,英国科学家道尔顿提出近代原子学说,
他认为原子是化学变化中不可再分的实心球体。原子是一个平均分布着正电荷的
粒子,其中镶嵌着许多电子,中
和了电荷,从而形成了中性原子。
根据a粒子散射实验,卢瑟福提出了带核的原子结构模型,原子由原子核和电子构成,电子在核周围做高速运动,就像行星围绕太阳运转一样。
丹麦物理学家玻尔1913年,丹麦物理学家玻尔提出的原子结构模型,
他认为核外电子是分层排布的。二、原子核外电子排布 1、原子核外电子的分层排布原子核电子层核电荷数该电子层上的电子Ne原子的核外电子分层排布示意图
为了形象地表示原子的结构,人们就创造了“原子结构示意图”这种特殊的图形。15第1层第2层第3层K层L层M层285原子结构示意图+电子离核越远,能量也就越高。
二、原子核外电子排布 1、原子核外电子的分层排布几种原子的核外电子分层排布示意图3、原子核外电子排布规律③? 最外层最多只能容纳 8个电子(K层为最外层是2个);? 次外层最多只能容纳18个电子 倒数第三层最多只能容纳32个电子; ② 每个电子层最多只能容纳2n2电子。①能量最低原理:电子总是尽先排布在能量最低的电子层里; 即由能量 低 高经验:电子排满K层,排 层,
排满 L 层排 层LM② 每个电子层最多只能容纳2n2电子。①能量最低原理:电子总是尽先排布在能量最低的电子层里; 即由能量 低 高根据原子光谱和理论分析
核电荷数为1~20的元素原子核外电子层排布4、原子结构与元素性质的关系(结构决定性质)(1)稳定结构:即最外层为8电子的结构(K层为2个)
特点:原子既不容易失去电子又不容易得到电子(如He、Ne、Ar等)(2)不稳定结构:(如,失去: Na、Mg、Al 得到:F、O、Cl)最外层电子数﹤4时,容易失去电子最外层电子数≧4时,容易得到电子讨论完成下表:少于4易失电子不稳定较活泼多于4不稳定易得电子较活泼2或8稳定不易得失较稳定三类不同元素的原子结构特点与化学性质的关系结论:元素的化学性质与最外层电子数关系密切最外层电子数决定化学性质氧化镁的形成结论1、活泼金属元素的原子容易失去最外层上的电子变为带正电荷的阳离子,阳离子所带正电荷的数目等于原子失去的电子的数目。MgMg2+失去2个电子(带2个单位正电荷)2、活泼非金属元素的原子容易得到电子变为带负电荷的阴离子,阴离子所带负电荷的数目等于原子得到的电子的数目。OO2-得到2个电子(带2个单位负电荷)钠离子Na+氯离子Cl-NaCl元素化合价与最外层电子数的关系:最外层电子数﹤4时,容易失去电子最外层电子数≧4时,容易得到电子
(化合价=+失去的电子数目)
化合价=-(8-最外层电子数)关系:元素化合价在数值上等于原子失去或得到的电子数目(失为正,得为负)
问题解决+11失1+2失2-2得27得11、下列原子结构示意图正确的是( )+2+9+11+202362928102、下列结构示意图中,表示原子结构的是( )+11+17+16+32828828821ABCDABCDAD4、用下面的结构示意图的字母填空:
(1)属于金属原子的是---------;
(2)属于非金属原子的是------;
(3)属于离子结构示意图的是-----;
(4)具有稳定结构的是-------。课堂检测:课堂检测:1、19世纪末,人们开始揭示原子内部的秘密,最早发现
电子的科学家是( )
A、法国的拉瓦锡 B、瑞典的舍勒
C、英国的道尔顿 D、英国的汤姆生2、钠、镁、铝等活泼金属与活泼非金属反应时最容易
--------,氧、氟、氯等活泼非金属与活泼金属反应时容
易-----------。在化学变化过程中,------不发生变化,但
原子的-------可能会发生变化。3、镁原子最外层只有------个电子,在反应过程中容易
--------电子,所以镁元素在化合物中常显----价。写出镁
分别跟氧、氯、氮、硫等元素形成的化合物的化学式---
---。氧原子最外层有------个电子,在反应过程中容易----
电子,所以氧元素在化合物中常显----价。
再见
