不同类型的晶体
图片预览




文档简介
课件23张PPT。不同类型的晶体晶体有规则的几何外形是因为构成晶体的微粒在空间呈有规则的重复排列。具有规则几何外形的固体叫晶体。
晶体中的微粒按一定的规则排列。
一、离子晶体定义:阴、阳离子按一定的方式有规则
地排列形成的晶体实例:食盐、氯化铯形成离子晶体的物质:
KOH 、 CuSO4、
NH4Cl 、 CaO、等离子化合物
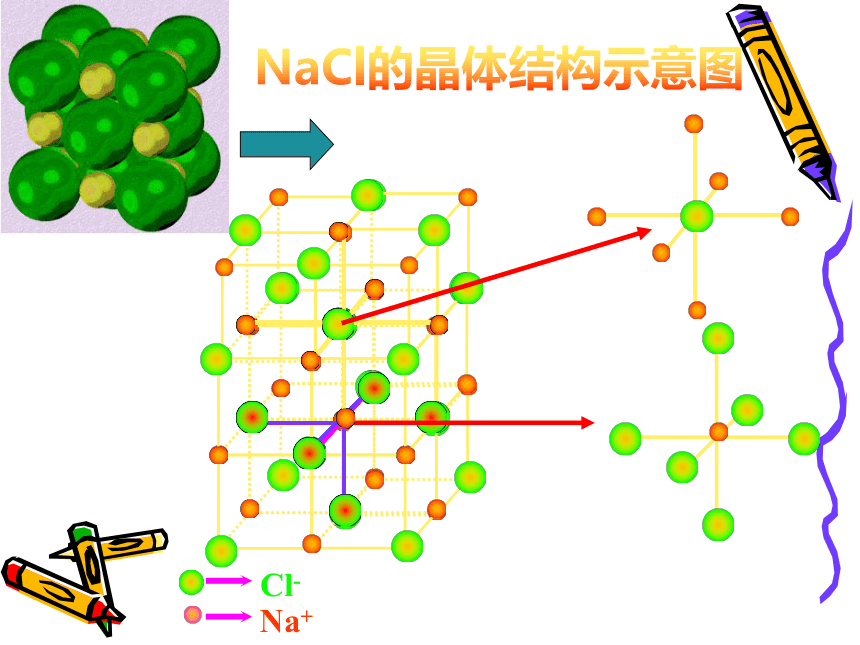
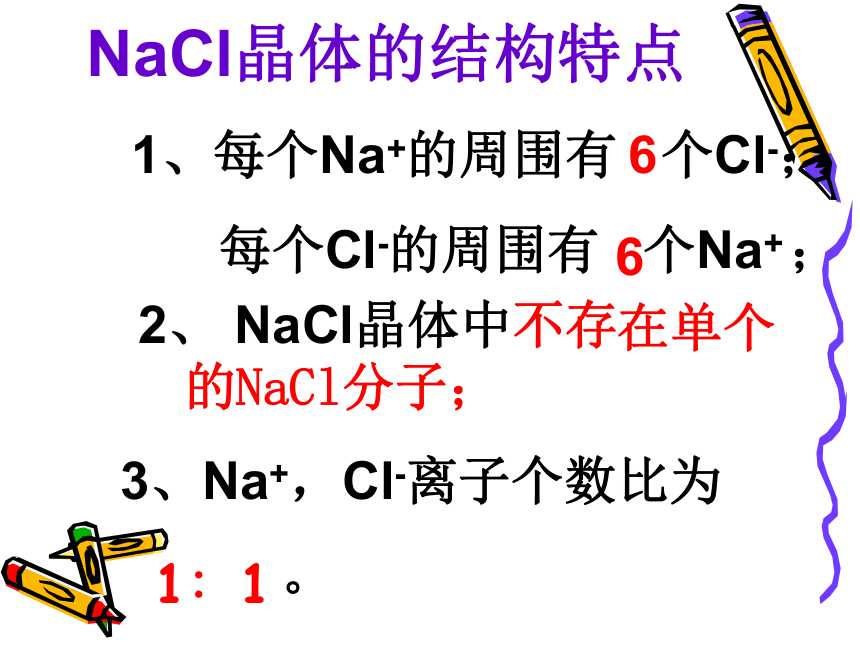
NaCl的晶体结构示意图NaCl晶体的结构特点1、每个Na+的周围有 个Cl-;
每个Cl-的周围有 个Na+ ;2、 NaCl晶体中不存
3、Na+,Cl-离子个数比为
。 在单个
的NaCl分子;
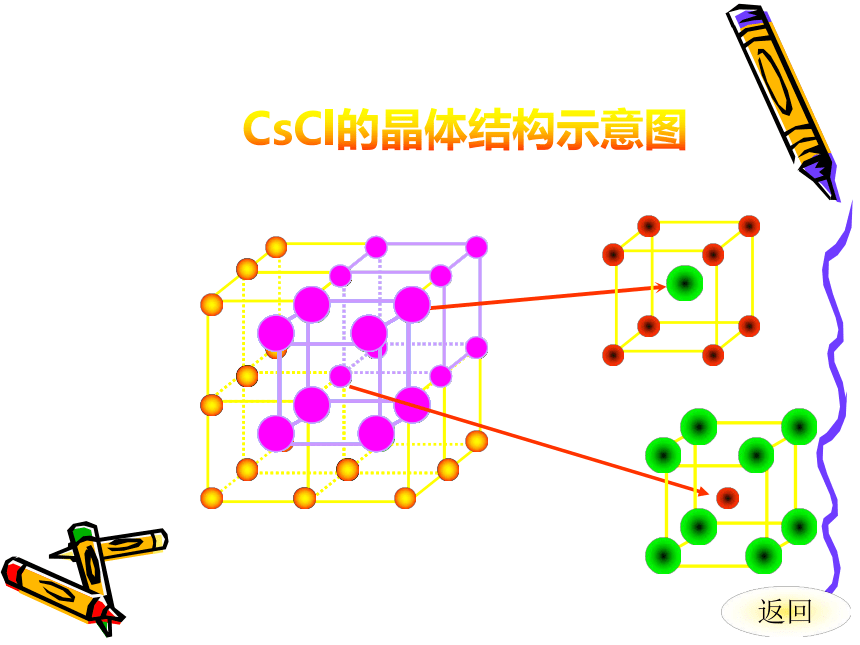
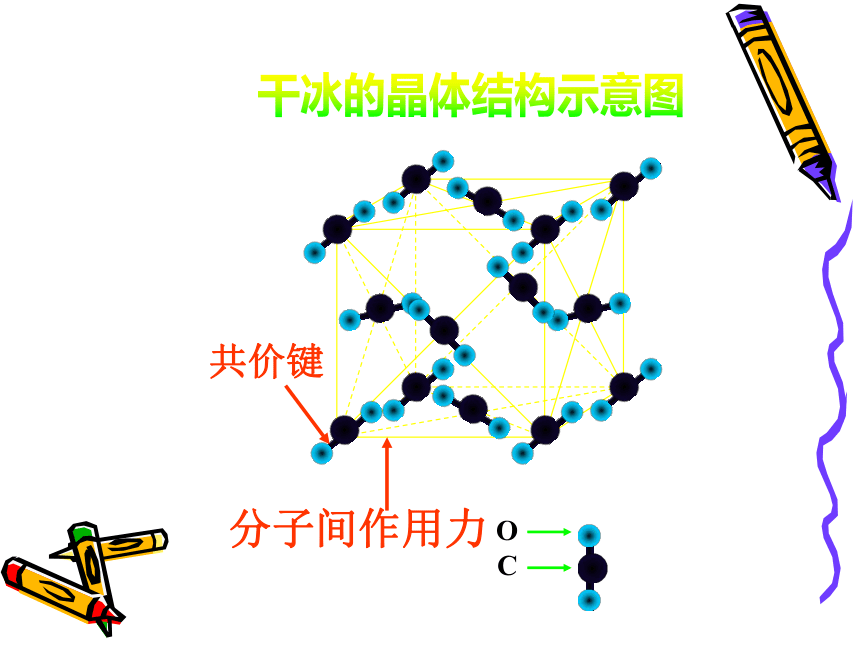
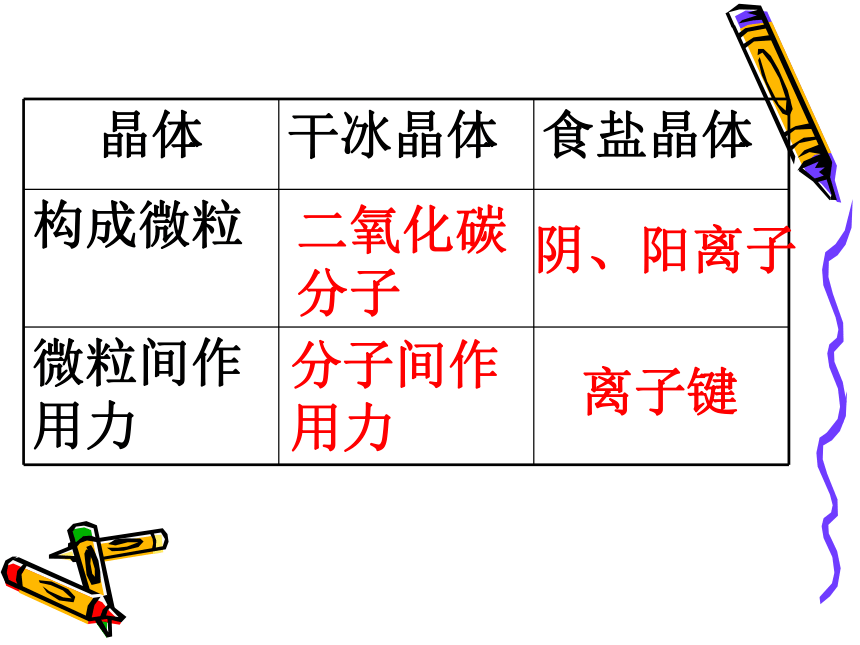
661∶1CsCl的晶体结构示意图返回分子间作用力共价键干冰的晶体结构示意图二氧化碳
分子分子间作
用力阴、阳离子离子键 二、分子晶体定义:实例:如干冰、冰等共价化合物形成分子晶体的物质:I2、He 、HCl 、H2O、CO2等分子间通过分子间作用力相
结合的晶体,叫做分子晶体。109o28′金刚石的晶体结构示意图共价键三、原子晶体定义:实例:如二氧化硅晶体、金刚石常见的原子晶体:金刚石、金刚砂(SiC)、
晶体硅、石英(SiO2)这种相邻原子通过共价键结合而形成
空间网状结构的晶体,叫做原子晶体。Sio二氧化硅的晶体结构示意图共价键返回SiO2晶体的结构特点: 1、每个Si原子与相邻的4个O原子以共价键相结合,每个O原子与2个相邻的Si原子以共价键相结合
2、 SiO2晶体中不存在单个的SiO2分子3、 化学式为SiO2中的1:2代表的是晶体中Si、O原子的数目比干冰晶体结构示意由此可见,每个二氧化碳分子周围有12个二氧化碳分子。干冰晶体的结构特点1、干冰晶体中存在2、C、O原子间存在 ,而CO2分子间存在着3、干冰晶体发生化学变化时,需克服的作用力是4、干冰晶体发生物理变化时,需克服的作用力是 返回单个CO2分子共价键分子间作用力共价键
分子间作用力
判断晶体类型的依据1.根据构成晶体的粒子与粒子间的作用力判断2.根据各类型晶体的性质判断a.如熔沸点低的化合物属于分子晶体b.熔沸点较高,且熔融状态或水溶液状态下
能导电的化合物属于离子晶体c.熔沸点很高,硬度很大,不导电,不溶于
一般溶剂的物质属于原子晶体d.具有延展性,易导电、传热的晶体属于金
属晶体晶体熔沸点规律原子晶体>离子晶体>分子晶体1.尝试对下列物质进行晶体结构分类,看看哪些是
离子晶体,哪些是分子晶体,哪些是原子晶体,哪
些是金属晶体?
A.干冰 B.铜 C.碘 D.氯化钙 E.铁 F.二氧化硅
G.氧化钠 H.金刚石离子晶体:
分子晶体:
原子晶体:
金属晶体:D、GA、CF、HB、E 2、下列物质的晶体中,化学键类型相同,熔化时所
克服的作用力也完全相同的是( )
A、CO2和SiO2 B、NaCl和HCl
C、( NH4 )2 CO3和H2SO4 D、Na2S和KCl
3、关于晶体的下列说法正确的是( )
A、在晶体中只要有阴离子就一定有阳离子
B、在晶体中只要有阳离子就一定有阴离子
C、原子晶体的熔点一定比金属晶体的高
D、分子晶体的熔点一定比金属晶体的低DA4、分析物质的物理性质,判断其晶体类型:
A、碳化铝,黄色晶体,熔点2200℃,熔融态不导电;___________
B、溴化铝,无色晶体,熔点98 ℃,熔融态不导电;___________
C、物质A,无色晶体,熔融时或溶于水中都能导电_____________原子晶体分子晶体离子晶体课 堂 练 习5、下列一组物质都属于分子晶体的是 ( )
A、CaO、NO、CO
B、 CCl4、H2O2、He
C、 CO2、SO2、NaCl
D、CH4、O2、Na2O 6、下列性质符合分子晶体的是 ( )
A、 熔点1070℃,易熔于水,水溶液能导电
B、 熔点是10.31℃,液体不导电,水溶液能导电
C、 熔点97.81℃,质软,能导电,密度是0.97g/cm3
D、 熔点807℃ ,熔化时能导电,水溶液也能导电 BB课 堂 练 习阴、阳离子分子原子离子键分子间作用力共价键高低很高大小很大不导电不导电不导电不导电不导电导电导电可能导电不溶于水离子键分子间作用力共价键食盐等离子化
合物晶体干冰、冰等由分
子构成的晶体金刚石、二氧化
硅晶体等
晶体中的微粒按一定的规则排列。
一、离子晶体定义:阴、阳离子按一定的方式有规则
地排列形成的晶体实例:食盐、氯化铯形成离子晶体的物质:
KOH 、 CuSO4、
NH4Cl 、 CaO、等离子化合物
NaCl的晶体结构示意图NaCl晶体的结构特点1、每个Na+的周围有 个Cl-;
每个Cl-的周围有 个Na+ ;2、 NaCl晶体中不存
3、Na+,Cl-离子个数比为
。 在单个
的NaCl分子;
661∶1CsCl的晶体结构示意图返回分子间作用力共价键干冰的晶体结构示意图二氧化碳
分子分子间作
用力阴、阳离子离子键 二、分子晶体定义:实例:如干冰、冰等共价化合物形成分子晶体的物质:I2、He 、HCl 、H2O、CO2等分子间通过分子间作用力相
结合的晶体,叫做分子晶体。109o28′金刚石的晶体结构示意图共价键三、原子晶体定义:实例:如二氧化硅晶体、金刚石常见的原子晶体:金刚石、金刚砂(SiC)、
晶体硅、石英(SiO2)这种相邻原子通过共价键结合而形成
空间网状结构的晶体,叫做原子晶体。Sio二氧化硅的晶体结构示意图共价键返回SiO2晶体的结构特点: 1、每个Si原子与相邻的4个O原子以共价键相结合,每个O原子与2个相邻的Si原子以共价键相结合
2、 SiO2晶体中不存在单个的SiO2分子3、 化学式为SiO2中的1:2代表的是晶体中Si、O原子的数目比干冰晶体结构示意由此可见,每个二氧化碳分子周围有12个二氧化碳分子。干冰晶体的结构特点1、干冰晶体中存在2、C、O原子间存在 ,而CO2分子间存在着3、干冰晶体发生化学变化时,需克服的作用力是4、干冰晶体发生物理变化时,需克服的作用力是 返回单个CO2分子共价键分子间作用力共价键
分子间作用力
判断晶体类型的依据1.根据构成晶体的粒子与粒子间的作用力判断2.根据各类型晶体的性质判断a.如熔沸点低的化合物属于分子晶体b.熔沸点较高,且熔融状态或水溶液状态下
能导电的化合物属于离子晶体c.熔沸点很高,硬度很大,不导电,不溶于
一般溶剂的物质属于原子晶体d.具有延展性,易导电、传热的晶体属于金
属晶体晶体熔沸点规律原子晶体>离子晶体>分子晶体1.尝试对下列物质进行晶体结构分类,看看哪些是
离子晶体,哪些是分子晶体,哪些是原子晶体,哪
些是金属晶体?
A.干冰 B.铜 C.碘 D.氯化钙 E.铁 F.二氧化硅
G.氧化钠 H.金刚石离子晶体:
分子晶体:
原子晶体:
金属晶体:D、GA、CF、HB、E 2、下列物质的晶体中,化学键类型相同,熔化时所
克服的作用力也完全相同的是( )
A、CO2和SiO2 B、NaCl和HCl
C、( NH4 )2 CO3和H2SO4 D、Na2S和KCl
3、关于晶体的下列说法正确的是( )
A、在晶体中只要有阴离子就一定有阳离子
B、在晶体中只要有阳离子就一定有阴离子
C、原子晶体的熔点一定比金属晶体的高
D、分子晶体的熔点一定比金属晶体的低DA4、分析物质的物理性质,判断其晶体类型:
A、碳化铝,黄色晶体,熔点2200℃,熔融态不导电;___________
B、溴化铝,无色晶体,熔点98 ℃,熔融态不导电;___________
C、物质A,无色晶体,熔融时或溶于水中都能导电_____________原子晶体分子晶体离子晶体课 堂 练 习5、下列一组物质都属于分子晶体的是 ( )
A、CaO、NO、CO
B、 CCl4、H2O2、He
C、 CO2、SO2、NaCl
D、CH4、O2、Na2O 6、下列性质符合分子晶体的是 ( )
A、 熔点1070℃,易熔于水,水溶液能导电
B、 熔点是10.31℃,液体不导电,水溶液能导电
C、 熔点97.81℃,质软,能导电,密度是0.97g/cm3
D、 熔点807℃ ,熔化时能导电,水溶液也能导电 BB课 堂 练 习阴、阳离子分子原子离子键分子间作用力共价键高低很高大小很大不导电不导电不导电不导电不导电导电导电可能导电不溶于水离子键分子间作用力共价键食盐等离子化
合物晶体干冰、冰等由分
子构成的晶体金刚石、二氧化
硅晶体等
