新人教版 化学课件:2.3《化学平衡》课件
文档属性
| 名称 | 新人教版 化学课件:2.3《化学平衡》课件 |

|
|
| 格式 | rar | ||
| 文件大小 | 107.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2010-09-01 00:00:00 | ||
图片预览






文档简介
课件17张PPT。 3、化学平衡复习:平衡的含义【复习】化学平衡状态的定义:
一定条件下,可逆反应里,正反应速率和逆反应速率相等,反应混合物中各组分的浓度保持不变的状态。化学平衡的特征:
逆
等
动
定
变——可逆反应(或可逆过程)
——V正 =V逆(不同的平衡对应不同的速率)
——动态平衡。达平衡后,正逆反应仍在进行(V正=V逆≠0)
——平衡时,各组分浓度、含量保持不变(恒定)
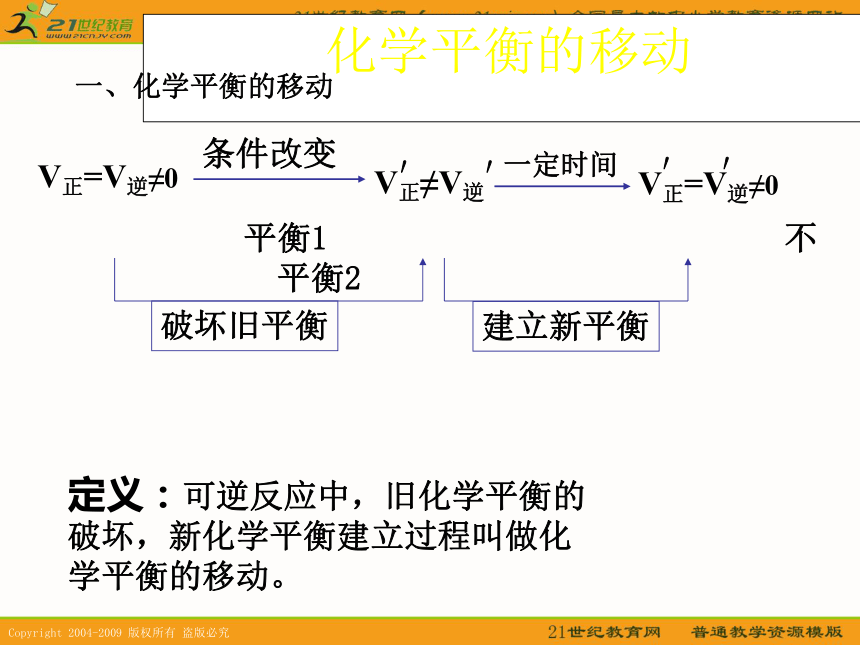
——条件改变,平衡发生改变定义:可逆反应中,旧化学平衡的
破坏,新化学平衡建立过程叫做化
学平衡的移动。V正≠V逆V正=V逆≠0条件改变 平衡1 不平衡 平衡2建立新平衡破坏旧平衡V正=V逆≠0′′化学平衡的移动 一定时间
一、化学平衡的移动
′′影响化学平衡的条件浓 度温 度压 强实验设计 现有实验资源:
药品: 0.01mol/LFeCl3溶液、0.01mol/LKSCN溶液、
1mol/LFeCl3溶液、1mol/LKSCN溶液。
仪器:点滴板、小烧杯、充有NO2气体的连通球实验目的:研究了解浓度和温度这个两个条件对化学平衡的影响实验设计--讨论--确立方案--动手实验实验设计的关键建立平衡体系
控制单个变量进行对照实验浓度对化学平衡的影响浓度对平衡的影响 实验现象及分析:
在相同的平衡体系中,加入溶液后,点滴板孔中溶液
的颜色加深,加入KSCN溶液后点滴板孔中的溶液颜色
也加深,说明任一反应物浓度的增加均使平衡向正反应
方向移动。
【问题】为什么增加任一反应物的浓度都能促使
平衡向正反应方向移动?(试从浓度的变化如何
影响V正 、V逆的速率来解释原因)浓度对平衡影响的v-t图分析1t1 平衡向正反应方向移动浓度对平衡影响的v-t图分析2平衡向正反应方向移动平衡向逆反应方向移动浓度对平衡影响的v-t图分析3t时间平衡向正反应方向移动平衡向逆反应方向移动
一、化学平衡的移动
二、影响化学平衡的条件
1、浓度:增大反应物浓度或减小生成物浓度,
平衡均向正反应方向移动;增大生
成物浓度或减小反应物浓度,平衡
均向逆反应方向移动。温度对化学平衡的影响现象及分析:
降温?颜色变浅?
升温?颜色变深?
反应原理:2NO2 N2O4 (正反应为放热反应) 红棕色 无色(g)(g)平衡向放热方向移动平衡向吸热方向移动压强对化学平衡的影响压强的影响实验原理:利用针筒的推拉改变混合气体的体积,
从而达到增压或减压的目的来进行实验。现象及分析:
加压? ?
减压? ?颜色逐渐变浅颜色逐渐变浅平衡向气体缩小的方向移动
平衡向气体增大的方向移动列表分析条件对三因素回顾、总结、新思考正反应方向减弱反应物浓度
增大的趋势正反应方向吸热反应的方向气体体积增大的反应
方向减弱生成物浓度
减小的趋势减弱温度升高的
趋势减弱压强降低的
趋势平衡移动原理——勒夏特列原理 如果改变影响平衡的一个条件(如浓度、温度、或压强等),平衡就向能够减弱这种改变的方向移动。注意:
①是“减弱”这种改变,不是“消除”这种改变
②只有单个条件改变,才能应用(多个条件改变就要具体问题具体分析)
③勒沙特列原理适用于任何动态平衡体系(如:溶解平衡、电离平衡等),未平衡状态不能用此来分析勒夏特列原理
一、化学平衡的移动
二、影响化学平衡的条件
1、浓度:
2、温度:
3、压强:三、化学平衡移动的原理
勒夏特列原理:如果改变影响平衡的一个条
件(如浓度、温度、或压强等),平衡就向
能够减弱这种改变的方向移动。
催化剂对化学平衡无影响催化剂同等程度的加快或减慢正、逆反应速率(V正=V逆);对化学平衡无影响。催化剂的 影响t时间(b)催化剂能缩短平衡到达的时间
一定条件下,可逆反应里,正反应速率和逆反应速率相等,反应混合物中各组分的浓度保持不变的状态。化学平衡的特征:
逆
等
动
定
变——可逆反应(或可逆过程)
——V正 =V逆(不同的平衡对应不同的速率)
——动态平衡。达平衡后,正逆反应仍在进行(V正=V逆≠0)
——平衡时,各组分浓度、含量保持不变(恒定)
——条件改变,平衡发生改变定义:可逆反应中,旧化学平衡的
破坏,新化学平衡建立过程叫做化
学平衡的移动。V正≠V逆V正=V逆≠0条件改变 平衡1 不平衡 平衡2建立新平衡破坏旧平衡V正=V逆≠0′′化学平衡的移动 一定时间
一、化学平衡的移动
′′影响化学平衡的条件浓 度温 度压 强实验设计 现有实验资源:
药品: 0.01mol/LFeCl3溶液、0.01mol/LKSCN溶液、
1mol/LFeCl3溶液、1mol/LKSCN溶液。
仪器:点滴板、小烧杯、充有NO2气体的连通球实验目的:研究了解浓度和温度这个两个条件对化学平衡的影响实验设计--讨论--确立方案--动手实验实验设计的关键建立平衡体系
控制单个变量进行对照实验浓度对化学平衡的影响浓度对平衡的影响 实验现象及分析:
在相同的平衡体系中,加入溶液后,点滴板孔中溶液
的颜色加深,加入KSCN溶液后点滴板孔中的溶液颜色
也加深,说明任一反应物浓度的增加均使平衡向正反应
方向移动。
【问题】为什么增加任一反应物的浓度都能促使
平衡向正反应方向移动?(试从浓度的变化如何
影响V正 、V逆的速率来解释原因)浓度对平衡影响的v-t图分析1t1 平衡向正反应方向移动浓度对平衡影响的v-t图分析2平衡向正反应方向移动平衡向逆反应方向移动浓度对平衡影响的v-t图分析3t时间平衡向正反应方向移动平衡向逆反应方向移动
一、化学平衡的移动
二、影响化学平衡的条件
1、浓度:增大反应物浓度或减小生成物浓度,
平衡均向正反应方向移动;增大生
成物浓度或减小反应物浓度,平衡
均向逆反应方向移动。温度对化学平衡的影响现象及分析:
降温?颜色变浅?
升温?颜色变深?
反应原理:2NO2 N2O4 (正反应为放热反应) 红棕色 无色(g)(g)平衡向放热方向移动平衡向吸热方向移动压强对化学平衡的影响压强的影响实验原理:利用针筒的推拉改变混合气体的体积,
从而达到增压或减压的目的来进行实验。现象及分析:
加压? ?
减压? ?颜色逐渐变浅颜色逐渐变浅平衡向气体缩小的方向移动
平衡向气体增大的方向移动列表分析条件对三因素回顾、总结、新思考正反应方向减弱反应物浓度
增大的趋势正反应方向吸热反应的方向气体体积增大的反应
方向减弱生成物浓度
减小的趋势减弱温度升高的
趋势减弱压强降低的
趋势平衡移动原理——勒夏特列原理 如果改变影响平衡的一个条件(如浓度、温度、或压强等),平衡就向能够减弱这种改变的方向移动。注意:
①是“减弱”这种改变,不是“消除”这种改变
②只有单个条件改变,才能应用(多个条件改变就要具体问题具体分析)
③勒沙特列原理适用于任何动态平衡体系(如:溶解平衡、电离平衡等),未平衡状态不能用此来分析勒夏特列原理
一、化学平衡的移动
二、影响化学平衡的条件
1、浓度:
2、温度:
3、压强:三、化学平衡移动的原理
勒夏特列原理:如果改变影响平衡的一个条
件(如浓度、温度、或压强等),平衡就向
能够减弱这种改变的方向移动。
催化剂对化学平衡无影响催化剂同等程度的加快或减慢正、逆反应速率(V正=V逆);对化学平衡无影响。催化剂的 影响t时间(b)催化剂能缩短平衡到达的时间
