混合物的分离和提纯
图片预览







文档简介
课件20张PPT。二、混合物的分离和提纯思考与交流
1、利用什么方法和性质将金子与沙子分离
2、如何分离铁屑和沙子
二、混合物的分离与提纯
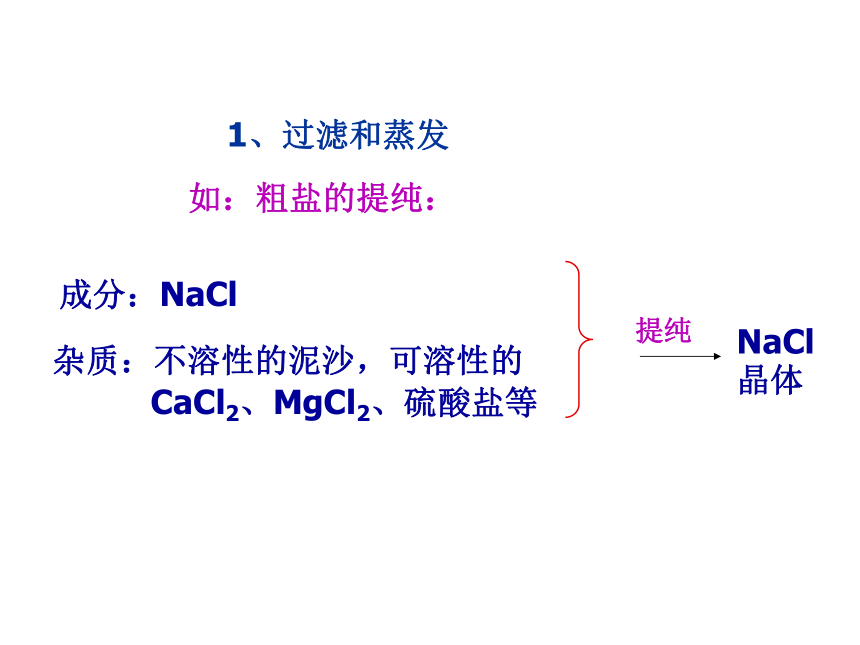
1、过滤和蒸发
①过滤:利用物质的可溶性不同
分离难溶物与可溶物
②蒸发:利用溶液沸点不同
加热使溶剂挥发,分离溶质与溶剂P5:学与问 化学上的杂质不一定是有害或无价值的,如水中含有的一些矿物质和微量元素是对人体有益的。可见要视杂质性质及含量来评价其是否有害或在人类活动中是否有利用的价值。
化学中的除杂,主要是因为杂质的存在会影响某物质的利用价值,如在化学反应中杂质的存在可能会引起一些副反应等1、过滤和蒸发如:粗盐的提纯:杂质:不溶性的泥沙,可溶性的
CaCl2、MgCl2、硫酸盐等成分:NaCl提纯NaCl
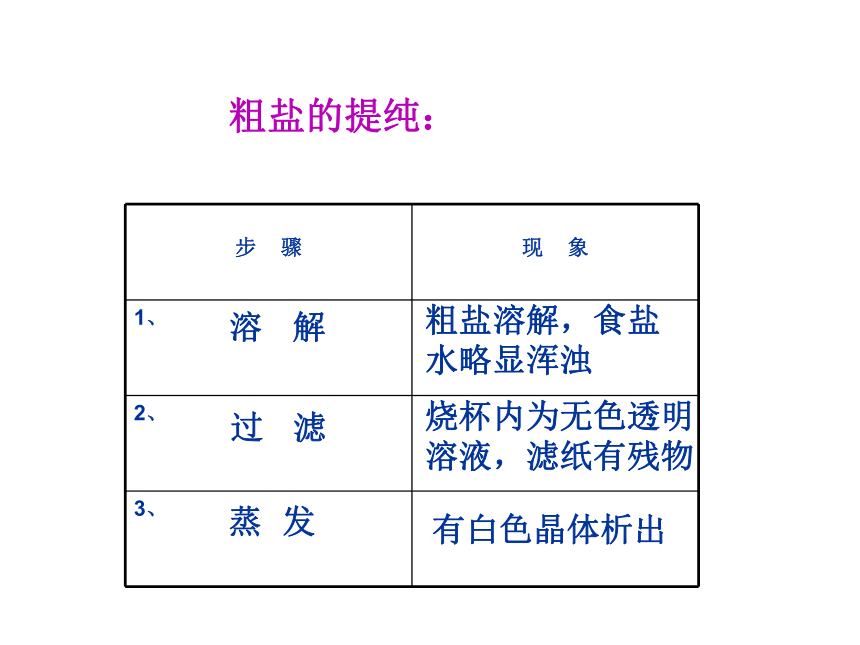
晶体溶 解 过 滤蒸 发烧杯内为无色透明
溶液,滤纸有残物有白色晶体析出粗盐溶解,食盐水略显浑浊粗盐的提纯: 1、固体溶解:
先将固体研细,溶解
时要搅拌,搅拌时玻
璃棒不能碰击容器壁,
以防容器破损
2、过滤:
“一贴”,滤纸紧贴漏斗内壁,中间不留有气泡(操作时要用手压住,用水润湿)
“二低”,滤纸的边缘低于漏斗口,漏斗里的液体液面低于滤纸的边缘
“三靠”,倾倒液体的烧杯尖口要紧靠玻璃棒,玻璃棒的末端轻靠在三层滤纸的一边,漏斗下端的管口靠接液烧杯内壁。
若:滤液浑浊应再过滤一次 3、蒸发
(1)蒸发皿的液体不超过
容积的2/3
(2)加热时,用玻璃棒不断搅拌
(3)出现较多固体时,应停止加热,利用余热蒸干
(4)取下未冷却的蒸发
皿时,要放在石棉网上 问题
1、不溶性的泥沙与盐分离是哪一步骤?
2、过滤后,烧杯内的物质可能是哪些?
3、蒸发过程利用的是物质的什么性质?
4、蒸发后得到的盐的成分可能是么?
5、P6:思考(3)过滤NaCl、CaCl2、MgCl2、可溶性硫酸盐沸点不同NaCl、CaCl2、MgCl2、硫酸盐 三、物质的检验
1、硫酸及可溶性硫酸盐检验(实验1-2)
2、可溶性氯化物的检验(实验1-4)+盐酸酸化(无白色沉淀) + BaCl 2 溶液 白色沉淀(验证)+硝酸酸化 +AgNO3 溶液
白色沉淀(验证)思考与交流如何除掉粗盐中的可溶性杂质CaCl2、
MgCl2和硫酸盐?BaCl2
NaOHNa2CO3BaCl2+Na2SO4=
BaSO4↓+2NaCl
MgCl2+2NaOH=
Mg(OH)2↓+2NaCl
CaCl2+Na2CO3=
CaCO3↓+2NaCl思考与交流加入你选择的试剂除掉杂质后,有没有引入其它离子?想一想可用什么方法再把它们除去?足量BaCl2足量NaOH足量Na2CO3 适量盐酸除杂原则不增不减易分不得引入新的杂质尽量不消耗被提纯的物质
如:不能减少NaCl成分杂质转换为沉淀、气体等易分离除去的物质,如:将NaCl溶液中可能存在的 Na2SO4转换为沉淀BaSO4除杂思路:根据杂质特征选择除杂剂,通常选择易与
杂质反应生成气体、沉淀的物质为除杂剂,
符合( )反应类型复分解 《随堂优化训练》习题选讲1、配对训练1(P2)
2、知识点5例题(P3)
3、配对训练2 (P3)1.某学生发现滴瓶中溶液里有悬浊物,
拟用右图所示操作进行过滤,错误的操作有( )
A.4处 B.3处 C.2处 D.1处 A练 习练 习2.下列实验中,①pH试纸的使用 ②过滤 ③蒸发,均用到的仪器是( )
A.蒸发皿???? B.玻璃棒??
C.试管?? D.分液漏斗B练 习3.下列实验中所选用的仪器合理的是( ) A.用200mL量筒量取5.2mL稀硫酸 B.用100mL烧杯配制100g质量分数为1%的食盐水 C.用托盘天平称量11.7g氯化钠固体 D.用托盘天平称量11.70g氯化钠固体C4. 用石灰水、小苏打、淀粉和食醋等不能完成 的实验是( )
A.碘盐中碘的检验
B.暖瓶中水垢的除去
C.食盐和纯碱的鉴别
D.鸡蛋壳主要成分的检验练 习A5.实验室需要纯净的氯化钠溶液,但手边只有混有硫酸钠、碳酸氢铵的氯化钠。某学生设计了如下方案:(1)操作①可选择 或 仪器。
(2)操作②是否可改为加硝酸钡溶液?为什么?
(3)操作②后,如何判断 SO4 2-已除尽,方法是:
。
(4)操作④的目的是 。蒸发皿 坩埚 取上层清液加入 BaCl 2溶液,若无沉淀生成说明 SO 4 2- 已除尽除去溶解在溶液中的CO2
1、利用什么方法和性质将金子与沙子分离
2、如何分离铁屑和沙子
二、混合物的分离与提纯
1、过滤和蒸发
①过滤:利用物质的可溶性不同
分离难溶物与可溶物
②蒸发:利用溶液沸点不同
加热使溶剂挥发,分离溶质与溶剂P5:学与问 化学上的杂质不一定是有害或无价值的,如水中含有的一些矿物质和微量元素是对人体有益的。可见要视杂质性质及含量来评价其是否有害或在人类活动中是否有利用的价值。
化学中的除杂,主要是因为杂质的存在会影响某物质的利用价值,如在化学反应中杂质的存在可能会引起一些副反应等1、过滤和蒸发如:粗盐的提纯:杂质:不溶性的泥沙,可溶性的
CaCl2、MgCl2、硫酸盐等成分:NaCl提纯NaCl
晶体溶 解 过 滤蒸 发烧杯内为无色透明
溶液,滤纸有残物有白色晶体析出粗盐溶解,食盐水略显浑浊粗盐的提纯: 1、固体溶解:
先将固体研细,溶解
时要搅拌,搅拌时玻
璃棒不能碰击容器壁,
以防容器破损
2、过滤:
“一贴”,滤纸紧贴漏斗内壁,中间不留有气泡(操作时要用手压住,用水润湿)
“二低”,滤纸的边缘低于漏斗口,漏斗里的液体液面低于滤纸的边缘
“三靠”,倾倒液体的烧杯尖口要紧靠玻璃棒,玻璃棒的末端轻靠在三层滤纸的一边,漏斗下端的管口靠接液烧杯内壁。
若:滤液浑浊应再过滤一次 3、蒸发
(1)蒸发皿的液体不超过
容积的2/3
(2)加热时,用玻璃棒不断搅拌
(3)出现较多固体时,应停止加热,利用余热蒸干
(4)取下未冷却的蒸发
皿时,要放在石棉网上 问题
1、不溶性的泥沙与盐分离是哪一步骤?
2、过滤后,烧杯内的物质可能是哪些?
3、蒸发过程利用的是物质的什么性质?
4、蒸发后得到的盐的成分可能是么?
5、P6:思考(3)过滤NaCl、CaCl2、MgCl2、可溶性硫酸盐沸点不同NaCl、CaCl2、MgCl2、硫酸盐 三、物质的检验
1、硫酸及可溶性硫酸盐检验(实验1-2)
2、可溶性氯化物的检验(实验1-4)+盐酸酸化(无白色沉淀) + BaCl 2 溶液 白色沉淀(验证)+硝酸酸化 +AgNO3 溶液
白色沉淀(验证)思考与交流如何除掉粗盐中的可溶性杂质CaCl2、
MgCl2和硫酸盐?BaCl2
NaOHNa2CO3BaCl2+Na2SO4=
BaSO4↓+2NaCl
MgCl2+2NaOH=
Mg(OH)2↓+2NaCl
CaCl2+Na2CO3=
CaCO3↓+2NaCl思考与交流加入你选择的试剂除掉杂质后,有没有引入其它离子?想一想可用什么方法再把它们除去?足量BaCl2足量NaOH足量Na2CO3 适量盐酸除杂原则不增不减易分不得引入新的杂质尽量不消耗被提纯的物质
如:不能减少NaCl成分杂质转换为沉淀、气体等易分离除去的物质,如:将NaCl溶液中可能存在的 Na2SO4转换为沉淀BaSO4除杂思路:根据杂质特征选择除杂剂,通常选择易与
杂质反应生成气体、沉淀的物质为除杂剂,
符合( )反应类型复分解 《随堂优化训练》习题选讲1、配对训练1(P2)
2、知识点5例题(P3)
3、配对训练2 (P3)1.某学生发现滴瓶中溶液里有悬浊物,
拟用右图所示操作进行过滤,错误的操作有( )
A.4处 B.3处 C.2处 D.1处 A练 习练 习2.下列实验中,①pH试纸的使用 ②过滤 ③蒸发,均用到的仪器是( )
A.蒸发皿???? B.玻璃棒??
C.试管?? D.分液漏斗B练 习3.下列实验中所选用的仪器合理的是( ) A.用200mL量筒量取5.2mL稀硫酸 B.用100mL烧杯配制100g质量分数为1%的食盐水 C.用托盘天平称量11.7g氯化钠固体 D.用托盘天平称量11.70g氯化钠固体C4. 用石灰水、小苏打、淀粉和食醋等不能完成 的实验是( )
A.碘盐中碘的检验
B.暖瓶中水垢的除去
C.食盐和纯碱的鉴别
D.鸡蛋壳主要成分的检验练 习A5.实验室需要纯净的氯化钠溶液,但手边只有混有硫酸钠、碳酸氢铵的氯化钠。某学生设计了如下方案:(1)操作①可选择 或 仪器。
(2)操作②是否可改为加硝酸钡溶液?为什么?
(3)操作②后,如何判断 SO4 2-已除尽,方法是:
。
(4)操作④的目的是 。蒸发皿 坩埚 取上层清液加入 BaCl 2溶液,若无沉淀生成说明 SO 4 2- 已除尽除去溶解在溶液中的CO2
