人教版选修三第三章 晶体结构与性质复习教案
文档属性
| 名称 | 人教版选修三第三章 晶体结构与性质复习教案 |
|
|
| 格式 | rar | ||
| 文件大小 | 13.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2010-09-03 09:30:00 | ||
图片预览


文档简介
本资料来自于资源最齐全的21世纪教育网www.21cnjy.com
第三章 晶体结构与性质
教学目标
1.巩固有关晶体粒子、粒子间作用力、晶体结构和晶体性质的基本知识。21世纪教育网
2.掌握有关晶体的简单计算。
教学重点
1.四种晶体类型的基本知识及应用;
2.有关晶体的简单计算。
教学难点
提高归纳和应用知识的能力,训练学生思维的敏捷性和严密性。
教学过程
【引入】在这一章里我们学习了五种不同类型的晶体,这节课我们对这些晶体的性质来进行比较和总结。
【板书】单元复习
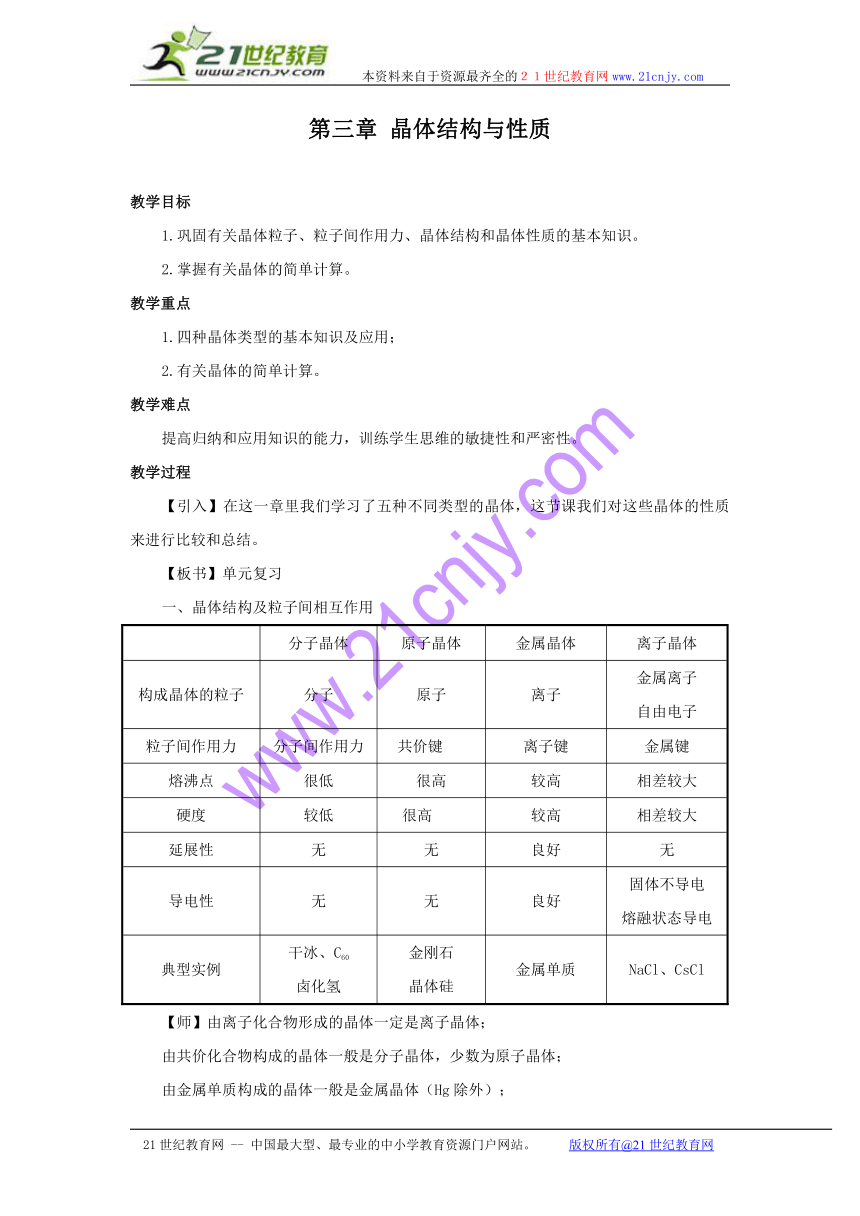
一、晶体结构及粒子间相互作用
分子晶体 原子晶体 金属晶体 离子晶体
构成晶体的粒子 分子 原子 离子 金属离子自由电子
粒子间作用力 分子间作用力 共价键21世纪教育网 离子键 金属键
熔沸点 很低 很高 较高 相差较大
硬度 较低 很高[来源:21世纪教育网] 较高 相差较大
延展性 无 无 良好 无
导电性 无 无 良好 固体不导电熔融状态导电
典型实例 干冰、C60卤化氢 金刚石晶体硅 金属单质 NaCl、CsCl
【师】由离子化合物形成的晶体一定是离子晶体;
由共价化合物构成的晶体一般是分子晶体,少数为原子晶体;
由金属单质构成的晶体一般是金属晶体(Hg除外);
由非金属单质构成的晶体一般是分子晶体,少数为原子晶体。
【板书】
二、晶体熔沸点的比较
1.相同条件下不同状态
固态 > 液态 > 气态
2.不同晶型
多数情况:原子晶体 > 离子晶体 > 分子晶体
3.相同晶型
⑴分子晶体:相对分子质量、氢键、分子的极性
⑵原子晶体:共价键强弱——原子半径大小
⑶金属晶体:金属键强弱——金属离子半径和离子所带电荷数
⑷离子晶体:离子键强弱——离子半径和离子所带电荷数
【例1】下列物质的熔沸点记低顺序正确的是(B )
A.金刚石 > 晶体硅 > 二氧化硅 > 碳化硅 B.CI4 > CBr4 > CCl4 > CF4
C.MgO > H2 > O2 > N2 D.金刚石 > 生铁 > 纯铁 > 钠
【例2】下列各组物质的沸点,按由低到高的顺序排列的是( C )
A.NH3、CH4、NaCl、Na B.H2O、H2S、MgSO4、SO2
C.CH4、H2O、NaCl、SiO2 D.Li、Na、K、Rb、Cs
【板书】三、典型晶体结构
1.干冰、金刚石、二氧化硅、NaCl、CsCl、石墨
2.有关晶胞的计算
【板书】四、判断晶体类型的方法
【师】主要根据各类晶体物理性质的差异:熔沸点、导电性、机械性能、硬度等。
【板书】1.熔沸点高、硬度大的晶体为原子晶体;
2.熔沸点较高、硬而脆的晶体为离子晶体;
3.熔沸点较低,硬度较小的晶体为分子晶体;
4.熔沸点较高,延展性、导电性好的晶体为金属晶体。
【例3】判断下列晶体的类型
⑴熔点120.5℃,沸点271.5℃,易溶于CS2; 分子晶体
⑵熔点2300℃,沸点2550℃,硬度大; 原子晶体
⑶熔点190℃,沸点170℃,易升华; 分子晶体
⑷熔点300℃,沸点1320℃,晶体不导电,水溶液导电。 金属晶体
【总结】本结课我们复习资料了晶体的概念,认识了晶体的宏观外形与微观结构的关系,同时对晶体的性质与晶体类型的关系也进行了归纳。
学习晶体,应学会将立体几何图形与化学物质模型联系起来,将化学概念抽象成数学问题,然后运用数学工具去解决化学问题。
【随堂练习】
1. 参考下表中物质的熔点,回答下列问题。
物质 NaF NaCl NaBr[来源:21世纪教育网] NaI KCl RbCl CsCl
熔点/℃ 995 801 755 651 776 715 646
物质 SiF4[来源:21世纪教育网] SiCl4 SiBr4 SiI4 GeCl4 SbCl4 PbCl4
熔点/℃ -90.4 -70.2 5.2 120 -49.5 -36.2 -15
⑴钠的卤化物及碱金属的氯化物的熔点与卤离子及碱金属离子的 有关,随着 增大,熔点依次降低。
⑵硅的卤化物及硅、锗、锡、铅的氯化物的熔点与 有关,随着 增大,增强,熔点依次升高。
⑶钠的卤化物的熔点比相应的硅的卤化物的熔点高得多,这与 有关,因为一般 比 熔点高。
2. 下列叙述正确的是( C )
A.离子晶体中肯定不含非极性共价键
B.原子晶体的熔点肯定高于其他晶体
C.由分子组成的物质其熔点一定较低
D.原子晶体中除去极性共价键不可能存在其他类型共价键
3. 有关晶体的下列说法中正确的是( B )
A.晶体中分子间作用力越大,分子越稳定 B.原子晶体中共价键越强,熔点越高
C.冰熔化时水分子中共价键发生断裂 D.氯化钠熔化时,离子键未被破坏
【作业】《学习与评价》P89复习题
【板书】
单元复习
一、晶体结构及粒子间相互作用
分子晶体 原子晶体 金属晶体 离子晶体
构成晶体的粒子
粒子间作用力
熔沸点
硬度
延展性
导电性
典型实例
二、晶体熔沸点的比较
1.相同条件下不同状态
固态 > 液态 > 气态
2.不同晶型
多数情况:原子晶体 > 离子晶体 > 分子晶体
3.相同晶型
⑴分子晶体:相对分子质量、氢键、分子的极性
⑵原子晶体:共价键强弱——原子半径大小
⑶金属晶体:金属键强弱——金属离子半径和离子所带电荷数
⑷离子晶体:离子键强弱——离子半径和离子所带电荷数
三、典型晶体结构
1. 干冰、金刚石、二氧化硅、NaCl、CsCl、石墨
2. 有关晶胞的计算
四、判断晶体类型的方法
w.w.w.k.s.5.u.c.o.m
www.
21世纪教育网 -- 中国最大型、最专业的中小学教育资源门户网站。 版权所有@21世纪教育网
第三章 晶体结构与性质
教学目标
1.巩固有关晶体粒子、粒子间作用力、晶体结构和晶体性质的基本知识。21世纪教育网
2.掌握有关晶体的简单计算。
教学重点
1.四种晶体类型的基本知识及应用;
2.有关晶体的简单计算。
教学难点
提高归纳和应用知识的能力,训练学生思维的敏捷性和严密性。
教学过程
【引入】在这一章里我们学习了五种不同类型的晶体,这节课我们对这些晶体的性质来进行比较和总结。
【板书】单元复习
一、晶体结构及粒子间相互作用
分子晶体 原子晶体 金属晶体 离子晶体
构成晶体的粒子 分子 原子 离子 金属离子自由电子
粒子间作用力 分子间作用力 共价键21世纪教育网 离子键 金属键
熔沸点 很低 很高 较高 相差较大
硬度 较低 很高[来源:21世纪教育网] 较高 相差较大
延展性 无 无 良好 无
导电性 无 无 良好 固体不导电熔融状态导电
典型实例 干冰、C60卤化氢 金刚石晶体硅 金属单质 NaCl、CsCl
【师】由离子化合物形成的晶体一定是离子晶体;
由共价化合物构成的晶体一般是分子晶体,少数为原子晶体;
由金属单质构成的晶体一般是金属晶体(Hg除外);
由非金属单质构成的晶体一般是分子晶体,少数为原子晶体。
【板书】
二、晶体熔沸点的比较
1.相同条件下不同状态
固态 > 液态 > 气态
2.不同晶型
多数情况:原子晶体 > 离子晶体 > 分子晶体
3.相同晶型
⑴分子晶体:相对分子质量、氢键、分子的极性
⑵原子晶体:共价键强弱——原子半径大小
⑶金属晶体:金属键强弱——金属离子半径和离子所带电荷数
⑷离子晶体:离子键强弱——离子半径和离子所带电荷数
【例1】下列物质的熔沸点记低顺序正确的是(B )
A.金刚石 > 晶体硅 > 二氧化硅 > 碳化硅 B.CI4 > CBr4 > CCl4 > CF4
C.MgO > H2 > O2 > N2 D.金刚石 > 生铁 > 纯铁 > 钠
【例2】下列各组物质的沸点,按由低到高的顺序排列的是( C )
A.NH3、CH4、NaCl、Na B.H2O、H2S、MgSO4、SO2
C.CH4、H2O、NaCl、SiO2 D.Li、Na、K、Rb、Cs
【板书】三、典型晶体结构
1.干冰、金刚石、二氧化硅、NaCl、CsCl、石墨
2.有关晶胞的计算
【板书】四、判断晶体类型的方法
【师】主要根据各类晶体物理性质的差异:熔沸点、导电性、机械性能、硬度等。
【板书】1.熔沸点高、硬度大的晶体为原子晶体;
2.熔沸点较高、硬而脆的晶体为离子晶体;
3.熔沸点较低,硬度较小的晶体为分子晶体;
4.熔沸点较高,延展性、导电性好的晶体为金属晶体。
【例3】判断下列晶体的类型
⑴熔点120.5℃,沸点271.5℃,易溶于CS2; 分子晶体
⑵熔点2300℃,沸点2550℃,硬度大; 原子晶体
⑶熔点190℃,沸点170℃,易升华; 分子晶体
⑷熔点300℃,沸点1320℃,晶体不导电,水溶液导电。 金属晶体
【总结】本结课我们复习资料了晶体的概念,认识了晶体的宏观外形与微观结构的关系,同时对晶体的性质与晶体类型的关系也进行了归纳。
学习晶体,应学会将立体几何图形与化学物质模型联系起来,将化学概念抽象成数学问题,然后运用数学工具去解决化学问题。
【随堂练习】
1. 参考下表中物质的熔点,回答下列问题。
物质 NaF NaCl NaBr[来源:21世纪教育网] NaI KCl RbCl CsCl
熔点/℃ 995 801 755 651 776 715 646
物质 SiF4[来源:21世纪教育网] SiCl4 SiBr4 SiI4 GeCl4 SbCl4 PbCl4
熔点/℃ -90.4 -70.2 5.2 120 -49.5 -36.2 -15
⑴钠的卤化物及碱金属的氯化物的熔点与卤离子及碱金属离子的 有关,随着 增大,熔点依次降低。
⑵硅的卤化物及硅、锗、锡、铅的氯化物的熔点与 有关,随着 增大,增强,熔点依次升高。
⑶钠的卤化物的熔点比相应的硅的卤化物的熔点高得多,这与 有关,因为一般 比 熔点高。
2. 下列叙述正确的是( C )
A.离子晶体中肯定不含非极性共价键
B.原子晶体的熔点肯定高于其他晶体
C.由分子组成的物质其熔点一定较低
D.原子晶体中除去极性共价键不可能存在其他类型共价键
3. 有关晶体的下列说法中正确的是( B )
A.晶体中分子间作用力越大,分子越稳定 B.原子晶体中共价键越强,熔点越高
C.冰熔化时水分子中共价键发生断裂 D.氯化钠熔化时,离子键未被破坏
【作业】《学习与评价》P89复习题
【板书】
单元复习
一、晶体结构及粒子间相互作用
分子晶体 原子晶体 金属晶体 离子晶体
构成晶体的粒子
粒子间作用力
熔沸点
硬度
延展性
导电性
典型实例
二、晶体熔沸点的比较
1.相同条件下不同状态
固态 > 液态 > 气态
2.不同晶型
多数情况:原子晶体 > 离子晶体 > 分子晶体
3.相同晶型
⑴分子晶体:相对分子质量、氢键、分子的极性
⑵原子晶体:共价键强弱——原子半径大小
⑶金属晶体:金属键强弱——金属离子半径和离子所带电荷数
⑷离子晶体:离子键强弱——离子半径和离子所带电荷数
三、典型晶体结构
1. 干冰、金刚石、二氧化硅、NaCl、CsCl、石墨
2. 有关晶胞的计算
四、判断晶体类型的方法
w.w.w.k.s.5.u.c.o.m
www.
21世纪教育网 -- 中国最大型、最专业的中小学教育资源门户网站。 版权所有@21世纪教育网
