新人教版化学 教案+随堂练习:1.2《化学计量在试验中的应用》1(必修1)
文档属性
| 名称 | 新人教版化学 教案+随堂练习:1.2《化学计量在试验中的应用》1(必修1) |

|
|
| 格式 | rar | ||
| 文件大小 | 24.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2010-09-04 00:00:00 | ||
图片预览

文档简介
本资料来自于资源最齐全的21世纪教育网www.21cnjy.com
第一章 从实验学化学
第二节 化学计量在实验中的应用
(第1课时)
教学目标:
1.使学生认识物质的量及其单位,能用于进行简单的化学计算。
2.使学生知道引入物质的量这一物理量的重要性和必要性,知道阿伏加德罗常数的涵义。
3.通过本部分的学习培养学生演绎推理、归纳推理的能力;调动学生参与知识形成的积极性和主动性。
教学重点、难点
重点:物质的量及其单位
难点:物质的量及其单位
教学环节 教 师 活 动 学 生 活 动
导入新课 物质之间的化学反应,是由肉眼不能看到的原子、分子或离子之间按一定数目关系进行的,同时又是以可称量的物质之间按一定的质量关系进行的。由此可见,在分子、原子等粒子与可称量的物质之间存在着某种联系,这是一种什么联系呢?怎样才能既科学又方便地知道一定量的物质中含有多少分子呢?这就是本节课所要解决的内容。 (1)方程式2H2+O2=2H2O系数的意义是什么? (2)若生成一滴水(约0.05mL)大约含有1.7亿亿个水分子,需要氢气分子和氧气分子各多少个? (3)在实验室中生成36克水,你如何实现 是数分子个数吗
新知学习 问题探究 (1)怎样测量课本中一张纸的厚度?又怎样知道一个水分子的质量呢?
归纳整理 显然,可用确定一个集体的办法,确定一个水分子的集体,这一定数目水分子(粒子)的集体,就把水(可称量物)与水分子(粒子)联系起来了。
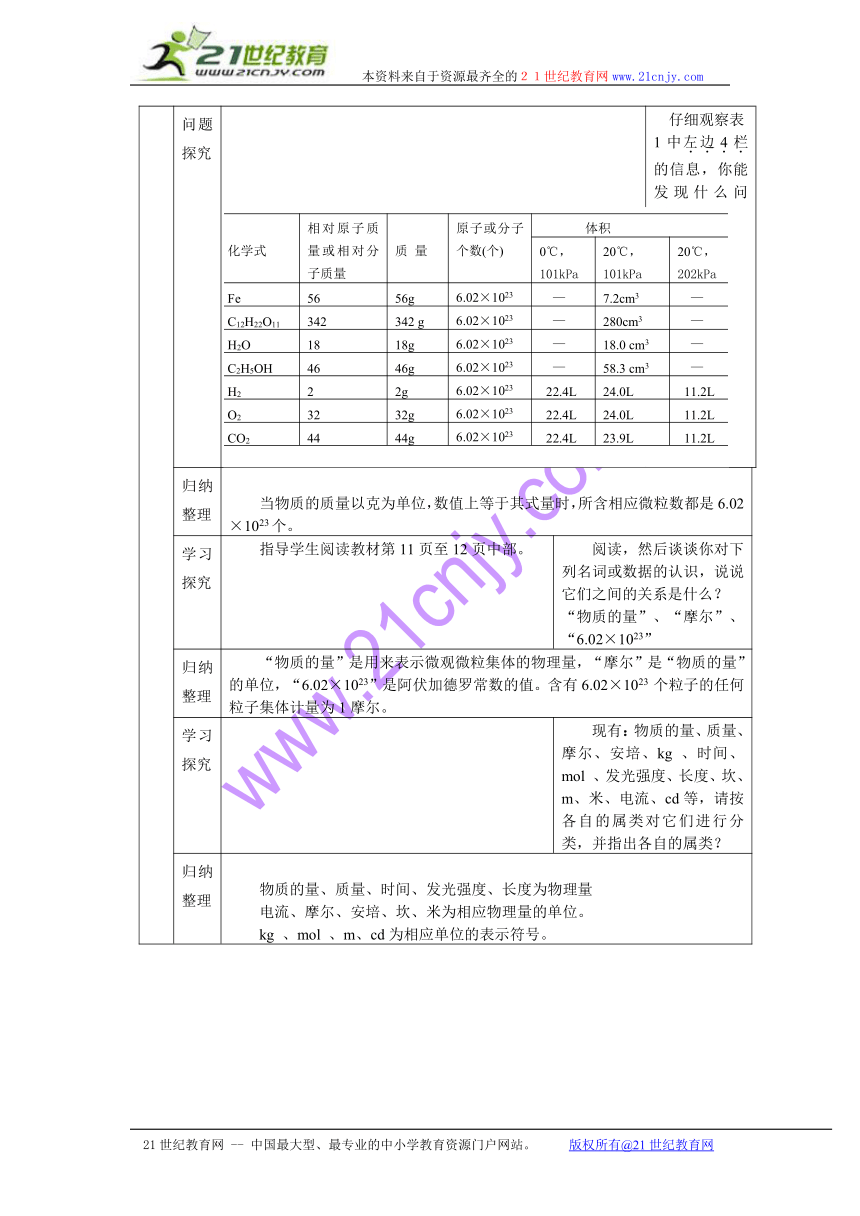
问题探究 仔细观察表1中左边4栏的信息,你能发现什么问题?
归纳整理 当物质的质量以克为单位,数值上等于其式量时,所含相应微粒数都是6.02×1023个。
学习探究 指导学生阅读教材第11页至12页中部。 阅读,然后谈谈你对下列名词或数据的认识,说说它们之间的关系是什么?“物质的量”、“摩尔”、“6.02×1023”
归纳整理 “物质的量”是用来表示微观微粒集体的物理量,“摩尔”是“物质的量”的单位,“6.02×1023”是阿伏加德罗常数的值。含有6.02×1023 个粒子的任何粒子集体计量为1摩尔。
学习探究 现有:物质的量、质量、摩尔、安培、kg 、时间、mol 、发光强度、长度、坎、m、米、电流、cd等,请按各自的属类对它们进行分类,并指出各自的属类?
归纳整理 物质的量、质量、时间、发光强度、长度为物理量 电流、摩尔、安培、坎、米为相应物理量的单位。kg 、mol 、m、cd为相应单位的表示符号。
实践探究 下列表示不正确的是 _________ ,错在何处?①1 molO2 ②1 molH2SO4 ③ molFe3+ ④1 mole- ⑤0.3molSO42- ⑥0.5NA个中子 ⑦0.3mol氢 ⑧1 摩尔H2O ⑨1 mol盐酸 ⑩1 mol铅笔
归纳整理 使用摩尔时必须是微观微粒,必须指明微粒的种类,可以是分数、小数、整数。
学习探究 指导阅读教材12页下半部分 1mol物质的质量在数值上有什么特点?什么是摩尔质量?其单位是什么?
归纳整理 单位物质的量的物质所具有的质量叫做摩尔质量。 摩尔质量是一个具有单位的物理量,要和质量区分开。物质的量(n)、质量(m)和摩尔质量(M)之间具有如下关系:
实践应用 写出下列物质的摩尔质量。Fe___________, H2SO4_____________, CO32-______________, K+___________
板书设计 一、物质的量的单位——摩尔1、物质的量:2、阿伏加德罗常数:3.摩尔质量: 定义: 单位: 表达式:n=
巩固练习:
1.下列关于物质的量的叙述中,错误的是 ( )
A. 1mol任何物质都含有6.02×1023个分子
B.0.012Kg12C中含有6.02×1023个碳原子
C.1molH2O中含有2 mol氢和1mol氧
D. 1molH2O中含有3 mol原子
2.下列说法正确的是 ( )
A. H2的摩尔质量是2 g
B. 1molH2O 的质量是18 g
C.氧气的摩尔质量是32 g/ mol
D.2g H2含1mol H
3.比较1.0mol N2和1.0mol CO的下列物理量:①质量 ②分子总数 ③原子总数,其中相同的是 ( )
A. ① B. ①② C. ①②③ D. ②③
4.相同质量的下列物质,所含分子数目最多的是 ( )
A.CH4 B.NH3 C.H2O D.HF
5.2.5 molBa(OH)2中含有 个Ba2+,含有 个OH-;5molNa2SO4溶于水电离出Na+ 个;含SO42-0.6mol的Al2(SO4)3 中含Al3+ mol。
6. 0.1 mol L-1Na2O放入 克水中才能使溶液中Na+与H2O的个数比为1∶100。
7.请你在括号内填入适当的数字,完成这幅关系图。
8.49g H3PO4的物质的量是多少?1.5 molNaOH的质量是多少
9.在求相同质量的SO2和SO3所含硫原子的个数比时,不同的同学用了不同的解法。
解法1:设SO2和SO3的质量均为mg,每个硫原子的质量为ag。
或
解法2:设SO2和SO3的质量均为mg。
解法3:设SO2和SO3的质量均为mg。
这几种解法在解题思路上有什么差异?你倾向于使用哪一种解法?为什么?
10.血液中的血清素(摩尔质量为176g mol-1)在人体中起着镇定情绪、解出忧虑的作用。血清素所含碳元素的质量分数为68.2%,所含氢元素的质量分数为6.82%,所含氮元素的质量分数为15.9%,所含氧元素的质量分数为9.08%。请你尝试写出血清素的化学式。
参考答案
1.AC 2.BC 3.C 4.A
5.1.505×1024 、3.01×1024、6.021024 、0.4
6.361.8g
7.略
8. 0.5 mol 60 g
9.解法1先求出硫元素的总质量(以质量为计算基础),再比上一个硫原子的质量求硫原子数
解法2先求出硫元素的物质的量(以物质的量为计算基础),再乘以阿佛加德罗常数求原子个数
解法3根据阿佛加德罗定律的推论求解.
倾向于解法3,简洁易懂.
(此题可各抒己见)
10.C10H12N2O
化学式 相对原子质量或相对分子质量 质 量 原子或分子个数(个) 体积
0℃,101kPa 20℃,101kPa 20℃,202kPa
Fe 56 56g 6.02×1023 — 7.2cm3 —
C12H22O11 342 342 g 6.02×1023 — 280cm3 —
H2O 18 18g 6.02×1023 — 18.0 cm3 —
C2H5OH 46 46g 6.02×1023 — 58.3 cm3 —
H2 2 2g 6.02×1023 22.4L 24.0L 11.2L
O2 32 32g 6.02×1023 22.4L 24.0L 11.2L
CO2 44 44g 6.02×1023 22.4L 23.9L 11.2L
微粒数( )氢原子
6.02×1023个水分子
微粒数( )氧原子
物质的量( )H
物质的量( )O
1 mol H2O
质量( )H2O
21世纪教育网 -- 中国最大型、最专业的中小学教育资源门户网站。 版权所有@21世纪教育网
第一章 从实验学化学
第二节 化学计量在实验中的应用
(第1课时)
教学目标:
1.使学生认识物质的量及其单位,能用于进行简单的化学计算。
2.使学生知道引入物质的量这一物理量的重要性和必要性,知道阿伏加德罗常数的涵义。
3.通过本部分的学习培养学生演绎推理、归纳推理的能力;调动学生参与知识形成的积极性和主动性。
教学重点、难点
重点:物质的量及其单位
难点:物质的量及其单位
教学环节 教 师 活 动 学 生 活 动
导入新课 物质之间的化学反应,是由肉眼不能看到的原子、分子或离子之间按一定数目关系进行的,同时又是以可称量的物质之间按一定的质量关系进行的。由此可见,在分子、原子等粒子与可称量的物质之间存在着某种联系,这是一种什么联系呢?怎样才能既科学又方便地知道一定量的物质中含有多少分子呢?这就是本节课所要解决的内容。 (1)方程式2H2+O2=2H2O系数的意义是什么? (2)若生成一滴水(约0.05mL)大约含有1.7亿亿个水分子,需要氢气分子和氧气分子各多少个? (3)在实验室中生成36克水,你如何实现 是数分子个数吗
新知学习 问题探究 (1)怎样测量课本中一张纸的厚度?又怎样知道一个水分子的质量呢?
归纳整理 显然,可用确定一个集体的办法,确定一个水分子的集体,这一定数目水分子(粒子)的集体,就把水(可称量物)与水分子(粒子)联系起来了。
问题探究 仔细观察表1中左边4栏的信息,你能发现什么问题?
归纳整理 当物质的质量以克为单位,数值上等于其式量时,所含相应微粒数都是6.02×1023个。
学习探究 指导学生阅读教材第11页至12页中部。 阅读,然后谈谈你对下列名词或数据的认识,说说它们之间的关系是什么?“物质的量”、“摩尔”、“6.02×1023”
归纳整理 “物质的量”是用来表示微观微粒集体的物理量,“摩尔”是“物质的量”的单位,“6.02×1023”是阿伏加德罗常数的值。含有6.02×1023 个粒子的任何粒子集体计量为1摩尔。
学习探究 现有:物质的量、质量、摩尔、安培、kg 、时间、mol 、发光强度、长度、坎、m、米、电流、cd等,请按各自的属类对它们进行分类,并指出各自的属类?
归纳整理 物质的量、质量、时间、发光强度、长度为物理量 电流、摩尔、安培、坎、米为相应物理量的单位。kg 、mol 、m、cd为相应单位的表示符号。
实践探究 下列表示不正确的是 _________ ,错在何处?①1 molO2 ②1 molH2SO4 ③ molFe3+ ④1 mole- ⑤0.3molSO42- ⑥0.5NA个中子 ⑦0.3mol氢 ⑧1 摩尔H2O ⑨1 mol盐酸 ⑩1 mol铅笔
归纳整理 使用摩尔时必须是微观微粒,必须指明微粒的种类,可以是分数、小数、整数。
学习探究 指导阅读教材12页下半部分 1mol物质的质量在数值上有什么特点?什么是摩尔质量?其单位是什么?
归纳整理 单位物质的量的物质所具有的质量叫做摩尔质量。 摩尔质量是一个具有单位的物理量,要和质量区分开。物质的量(n)、质量(m)和摩尔质量(M)之间具有如下关系:
实践应用 写出下列物质的摩尔质量。Fe___________, H2SO4_____________, CO32-______________, K+___________
板书设计 一、物质的量的单位——摩尔1、物质的量:2、阿伏加德罗常数:3.摩尔质量: 定义: 单位: 表达式:n=
巩固练习:
1.下列关于物质的量的叙述中,错误的是 ( )
A. 1mol任何物质都含有6.02×1023个分子
B.0.012Kg12C中含有6.02×1023个碳原子
C.1molH2O中含有2 mol氢和1mol氧
D. 1molH2O中含有3 mol原子
2.下列说法正确的是 ( )
A. H2的摩尔质量是2 g
B. 1molH2O 的质量是18 g
C.氧气的摩尔质量是32 g/ mol
D.2g H2含1mol H
3.比较1.0mol N2和1.0mol CO的下列物理量:①质量 ②分子总数 ③原子总数,其中相同的是 ( )
A. ① B. ①② C. ①②③ D. ②③
4.相同质量的下列物质,所含分子数目最多的是 ( )
A.CH4 B.NH3 C.H2O D.HF
5.2.5 molBa(OH)2中含有 个Ba2+,含有 个OH-;5molNa2SO4溶于水电离出Na+ 个;含SO42-0.6mol的Al2(SO4)3 中含Al3+ mol。
6. 0.1 mol L-1Na2O放入 克水中才能使溶液中Na+与H2O的个数比为1∶100。
7.请你在括号内填入适当的数字,完成这幅关系图。
8.49g H3PO4的物质的量是多少?1.5 molNaOH的质量是多少
9.在求相同质量的SO2和SO3所含硫原子的个数比时,不同的同学用了不同的解法。
解法1:设SO2和SO3的质量均为mg,每个硫原子的质量为ag。
或
解法2:设SO2和SO3的质量均为mg。
解法3:设SO2和SO3的质量均为mg。
这几种解法在解题思路上有什么差异?你倾向于使用哪一种解法?为什么?
10.血液中的血清素(摩尔质量为176g mol-1)在人体中起着镇定情绪、解出忧虑的作用。血清素所含碳元素的质量分数为68.2%,所含氢元素的质量分数为6.82%,所含氮元素的质量分数为15.9%,所含氧元素的质量分数为9.08%。请你尝试写出血清素的化学式。
参考答案
1.AC 2.BC 3.C 4.A
5.1.505×1024 、3.01×1024、6.021024 、0.4
6.361.8g
7.略
8. 0.5 mol 60 g
9.解法1先求出硫元素的总质量(以质量为计算基础),再比上一个硫原子的质量求硫原子数
解法2先求出硫元素的物质的量(以物质的量为计算基础),再乘以阿佛加德罗常数求原子个数
解法3根据阿佛加德罗定律的推论求解.
倾向于解法3,简洁易懂.
(此题可各抒己见)
10.C10H12N2O
化学式 相对原子质量或相对分子质量 质 量 原子或分子个数(个) 体积
0℃,101kPa 20℃,101kPa 20℃,202kPa
Fe 56 56g 6.02×1023 — 7.2cm3 —
C12H22O11 342 342 g 6.02×1023 — 280cm3 —
H2O 18 18g 6.02×1023 — 18.0 cm3 —
C2H5OH 46 46g 6.02×1023 — 58.3 cm3 —
H2 2 2g 6.02×1023 22.4L 24.0L 11.2L
O2 32 32g 6.02×1023 22.4L 24.0L 11.2L
CO2 44 44g 6.02×1023 22.4L 23.9L 11.2L
微粒数( )氢原子
6.02×1023个水分子
微粒数( )氧原子
物质的量( )H
物质的量( )O
1 mol H2O
质量( )H2O
21世纪教育网 -- 中国最大型、最专业的中小学教育资源门户网站。 版权所有@21世纪教育网
