新人教版化学 教案+随堂练习:2.2《离子反应》2(必修1)
文档属性
| 名称 | 新人教版化学 教案+随堂练习:2.2《离子反应》2(必修1) |  | |
| 格式 | rar | ||
| 文件大小 | 19.3KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2010-09-04 09:13:00 | ||
图片预览

文档简介
本资料来自于资源最齐全的21世纪教育网www.21cnjy.com
第2节 离子反应
(第二课时)
教学目标:
1. 通过实验事实认识离子反应及其发生的条件
1. 初步学会判断离子方程式的正误
1. 将实验探究与讨论交流密切结合,通过比较、归纳、分析、综合,加深对离子反应概念及其反应条件的理解
1. 使学生体验科学探究的快乐,养成务实求真、勇于探索的科学态度
教学重点、难点
重点:离子反应发生的条件
难点:离子反应发生的条件
教学过程:
教学环节 教师活动 学生活动
新课导入 书写三组电离方程式:HCl、H2SO4、HNO3NaOH、KOH、Ba(OH)2KNO3、NaCl、AgNO3
新知学习新知学习 学习探究 引导分析混合液中的离子数目有无增减,并引导讨论原因 若将100mL 1mol·L-1 KNO3溶液与100mL 1mol·L-1 NaCl溶液混合,求混合液中的离子种类及数目_______________________________若将100mL 1mol·L-1 AgNO3溶液与100mL 1mol·L-1 NaCl溶液混合,求混合液中的离子种类及数目_______________________________
总结归纳 第1种情况中,混合液里含有K+、NO3-、Na+、Cl-四种离子各0.1mol,说明这些离子在溶液中是共存的,相互之间没有反应;而第2种情况中,溶液里仅存在NO3-、Na+两种离子各0.1mol,原因是0.1mol Ag+与0.1mol Cl-恰好结合生成了难溶的AgCl沉淀
思考讨论 提出问题:什么是离子反应 如上述2中在溶液中电解质电离产生的离子之间所发生的反应
指导阅读 提出问题:离子反应发生的条件 阅读教材有关内容并思考讨论
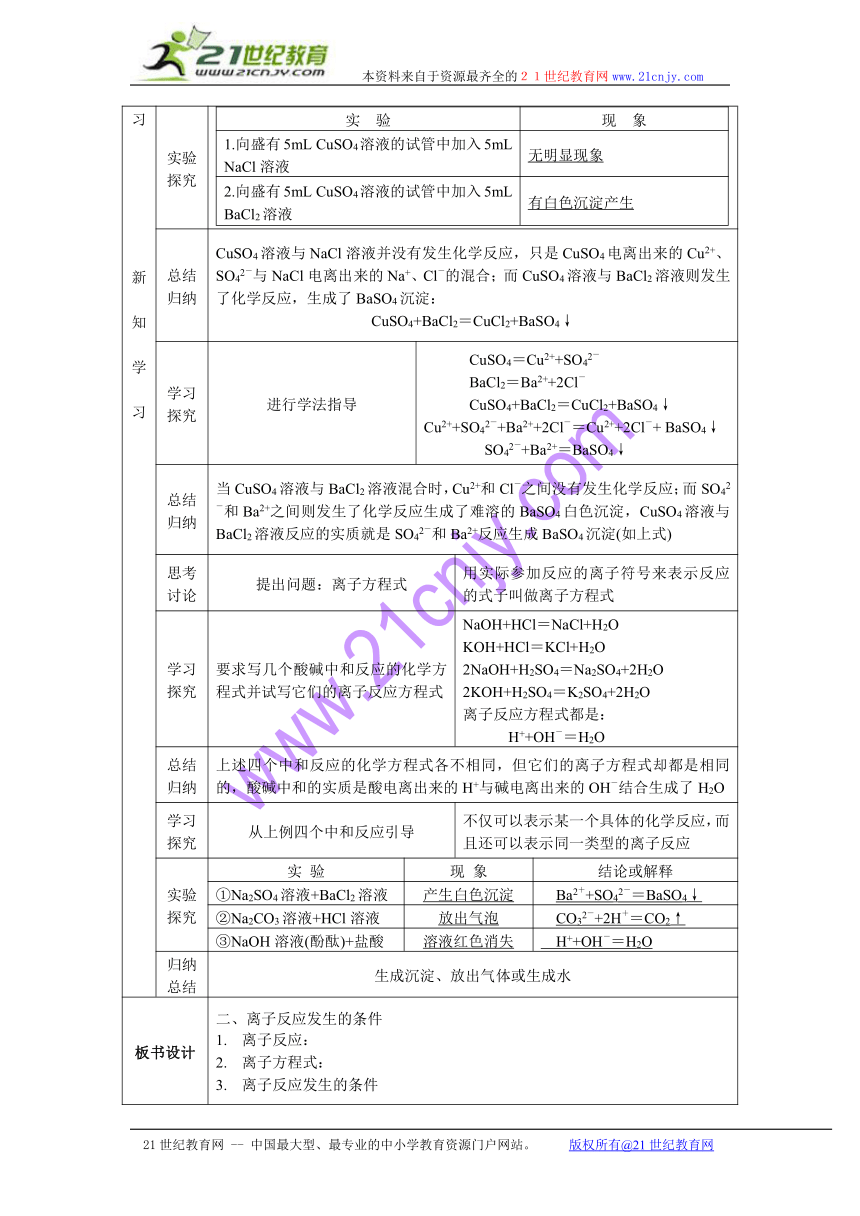
实验探究 实 验现 象1.向盛有5mL CuSO4溶液的试管中加入5mL NaCl溶液无明显现象2.向盛有5mL CuSO4溶液的试管中加入5mL BaCl2溶液有白色沉淀产生
总结归纳 CuSO4溶液与NaCl溶液并没有发生化学反应,只是CuSO4电离出来的Cu2+、SO42-与NaCl电离出来的Na+、Cl-的混合;而CuSO4溶液与BaCl2溶液则发生了化学反应,生成了BaSO4沉淀:CuSO4+BaCl2=CuCl2+BaSO4↓
学习探究 进行学法指导 CuSO4=Cu2++SO42-BaCl2=Ba2++2Cl-CuSO4+BaCl2=CuCl2+BaSO4↓Cu2++SO42-+Ba2++2Cl-=Cu2++2Cl-+ BaSO4↓SO42-+Ba2+=BaSO4↓
总结归纳 当CuSO4溶液与BaCl2溶液混合时,Cu2+和Cl-之间没有发生化学反应;而SO42-和Ba2+之间则发生了化学反应生成了难溶的BaSO4白色沉淀,CuSO4溶液与BaCl2溶液反应的实质就是SO42-和Ba2+反应生成BaSO4沉淀(如上式)
思考讨论 提出问题:离子方程式 用实际参加反应的离子符号来表示反应的式子叫做离子方程式
学习探究 要求写几个酸碱中和反应的化学方程式并试写它们的离子反应方程式 NaOH+HCl=NaCl+H2OKOH+HCl=KCl+H2O2NaOH+H2SO4=Na2SO4+2H2O2KOH+H2SO4=K2SO4+2H2O离子反应方程式都是: H++OH-=H2O
总结归纳 上述四个中和反应的化学方程式各不相同,但它们的离子方程式却都是相同的,酸碱中和的实质是酸电离出来的H+与碱电离出来的OH-结合生成了H2O
学习探究 从上例四个中和反应引导 不仅可以表示某一个具体的化学反应,而且还可以表示同一类型的离子反应
实验探究 实 验 现 象 结论或解释
①Na2SO4溶液+BaCl2溶液 产生白色沉淀 Ba2++SO42-=BaSO4↓
②Na2CO3溶液+HCl溶液 放出气泡 CO32-+2H+=CO2↑
③NaOH溶液(酚酞)+盐酸 溶液红色消失 H++OH-=H2O
归纳总结 生成沉淀、放出气体或生成水
板书设计 二、离子反应发生的条件离子反应:离子方程式:离子反应发生的条件
巩固练习:
1. 下列各组反应中,不能用同一个离子方程式表示的是( )
A.盐酸分别与NaOH溶液、Ca(OH)2溶液反应
B.硫酸分别与NaOH溶液、Ba(OH)2溶液反应
C. 硝酸分别与Na2CO3溶液、K2CO3溶液反应
D. 锌分别与稀盐酸、稀硫酸反应
2. 不能用离子方程式CO32-+2H+=CO2↑+H2O表示的是( )
A. Na2CO3+2HCl=2NaCl +CO2↑+H2O
B. NaHCO3+HCl=NaCl +CO2↑+H2O
C. K2CO3+H2SO4=Na2SO4 +CO2↑+H2O
D. K2CO3+2HNO3=2KNO3 +CO2↑+H2O
3. 下列离子方程式错误的是( )
A.铁与稀硫酸反应:2Fe+6H+=2Fe3++3H2↑
B.盐酸与氢氧化钡溶液:H++OH-=H2O
C.碳酸钙与稀硝酸:CaCO3+2H+=2Ca2++ CO2↑+H2O
D.硫酸铜溶液与氢氧化钡溶液:Cu2++SO42-+Ba2++2OH-=Cu(OH)2↓+BaSO4↓
4. 在pH=1的无色为溶液中,能大量共存的离子组是( )
A.NH4+、Mg2+、SO42-、Cl-
B. Ba2+、K+、OH-、Cl-
C.Al3+、MnO4-、SO42-、Cl-
D.Na+、Cu2+、Cl-、Ba2+
5. 对四种无色溶液进行离子检验,检验结果如下,其中明显不正确的是( )
A. SO32-、OH-、Cl-、K+
B. Na+、NO3-、OH-、Cl-
C. K+ 、Na+、NO3-、Cl-
D. K+ 、CO32-、 H+ 、Ba2+
6. 将两种物质的溶液相混合,有魄白色沉淀生成,加入稀硝酸后,沉淀消失并有气泡生成,再加入AgNO3溶液,又生成白色沉淀,则这两种物质是( )
A.MgCl2和Na2CO3 B.K2SO4和BaCl2
C.NaOH和CuSO4 D. K2CO3和Ca(NO3)2
7. 离子方程式CO32-+2H+=CO2↑+H2O表示的意义是________________________________
____________________________________________________________________________________________________________________________________,写出实现该离子反应的一个化学方程式__________________________________
8. 某溶液中可能存在下列阴离子:Cl-、SO42-、CO32-中的一种或几种
(1) 当溶液中存在大量H+时,________________不能在溶液中大量存在
(1) 当溶液中存在大量Ag+时,________________不能在溶液中大量存在
(1) 当向溶液中加入Ba(NO3)2溶液能生成白色沉淀,则原溶液中存在的离子是__________
为了进一步确定的溶液中存在哪种离子,可继续向溶液中加入_______________,通过观察
_______________再作出进一步的判断。
备课参考
1. 练习答案:1.B 2.B 3.A 4.A 5.D 6.A
7.可溶性碳酸盐与强酸溶液反应生成二氧化碳和水 Na2CO3+2HCl=2NaCl +CO2↑+H2O
8. (1)CO32- (2)Cl-、SO42-、CO32- (3)SO42-、CO32-至少有一种;稀硝酸;沉淀是否部分溶解或全部溶解或都不溶解
1. 备课资料:
1.离子反应发生的条件
(1) 生成难溶物质或微溶物:如SO42-与Ag+、SO42-与Ca2+、CO32-与Mg2+等生成微溶物导致离子反应发生
(1) 生成气体或挥发性物质:如NH4+与OH-、H+与、CO32-、HCO3-、S2-、HS-、
SO32-、HSO3-等之间发生离子反应
(1) 生成弱电解质:如H+与CH3COO-、CO32-、S2-、SO32-、F-等生成弱酸;OH-与NH4+、Cu2+、Fe3+等生成弱碱;H+与OH-生成水(水是一种极弱的电解质)
2.书写离子方程式的步骤:
(1) 写:写出正确的化学方程式
(1) 拆:将化学式中易溶于水且能完全电离的物质拆写成阴、阳离子符号;而难溶于水、难电离、气体、水、单质等仍用化学式表示
(1) 删:删去方程式等号两边重复的离子
(1) 查:检查是否满足元素原子守恒、反应前后电荷守恒等。
21世纪教育网 -- 中国最大型、最专业的中小学教育资源门户网站。 版权所有@21世纪教育网
第2节 离子反应
(第二课时)
教学目标:
1. 通过实验事实认识离子反应及其发生的条件
1. 初步学会判断离子方程式的正误
1. 将实验探究与讨论交流密切结合,通过比较、归纳、分析、综合,加深对离子反应概念及其反应条件的理解
1. 使学生体验科学探究的快乐,养成务实求真、勇于探索的科学态度
教学重点、难点
重点:离子反应发生的条件
难点:离子反应发生的条件
教学过程:
教学环节 教师活动 学生活动
新课导入 书写三组电离方程式:HCl、H2SO4、HNO3NaOH、KOH、Ba(OH)2KNO3、NaCl、AgNO3
新知学习新知学习 学习探究 引导分析混合液中的离子数目有无增减,并引导讨论原因 若将100mL 1mol·L-1 KNO3溶液与100mL 1mol·L-1 NaCl溶液混合,求混合液中的离子种类及数目_______________________________若将100mL 1mol·L-1 AgNO3溶液与100mL 1mol·L-1 NaCl溶液混合,求混合液中的离子种类及数目_______________________________
总结归纳 第1种情况中,混合液里含有K+、NO3-、Na+、Cl-四种离子各0.1mol,说明这些离子在溶液中是共存的,相互之间没有反应;而第2种情况中,溶液里仅存在NO3-、Na+两种离子各0.1mol,原因是0.1mol Ag+与0.1mol Cl-恰好结合生成了难溶的AgCl沉淀
思考讨论 提出问题:什么是离子反应 如上述2中在溶液中电解质电离产生的离子之间所发生的反应
指导阅读 提出问题:离子反应发生的条件 阅读教材有关内容并思考讨论
实验探究 实 验现 象1.向盛有5mL CuSO4溶液的试管中加入5mL NaCl溶液无明显现象2.向盛有5mL CuSO4溶液的试管中加入5mL BaCl2溶液有白色沉淀产生
总结归纳 CuSO4溶液与NaCl溶液并没有发生化学反应,只是CuSO4电离出来的Cu2+、SO42-与NaCl电离出来的Na+、Cl-的混合;而CuSO4溶液与BaCl2溶液则发生了化学反应,生成了BaSO4沉淀:CuSO4+BaCl2=CuCl2+BaSO4↓
学习探究 进行学法指导 CuSO4=Cu2++SO42-BaCl2=Ba2++2Cl-CuSO4+BaCl2=CuCl2+BaSO4↓Cu2++SO42-+Ba2++2Cl-=Cu2++2Cl-+ BaSO4↓SO42-+Ba2+=BaSO4↓
总结归纳 当CuSO4溶液与BaCl2溶液混合时,Cu2+和Cl-之间没有发生化学反应;而SO42-和Ba2+之间则发生了化学反应生成了难溶的BaSO4白色沉淀,CuSO4溶液与BaCl2溶液反应的实质就是SO42-和Ba2+反应生成BaSO4沉淀(如上式)
思考讨论 提出问题:离子方程式 用实际参加反应的离子符号来表示反应的式子叫做离子方程式
学习探究 要求写几个酸碱中和反应的化学方程式并试写它们的离子反应方程式 NaOH+HCl=NaCl+H2OKOH+HCl=KCl+H2O2NaOH+H2SO4=Na2SO4+2H2O2KOH+H2SO4=K2SO4+2H2O离子反应方程式都是: H++OH-=H2O
总结归纳 上述四个中和反应的化学方程式各不相同,但它们的离子方程式却都是相同的,酸碱中和的实质是酸电离出来的H+与碱电离出来的OH-结合生成了H2O
学习探究 从上例四个中和反应引导 不仅可以表示某一个具体的化学反应,而且还可以表示同一类型的离子反应
实验探究 实 验 现 象 结论或解释
①Na2SO4溶液+BaCl2溶液 产生白色沉淀 Ba2++SO42-=BaSO4↓
②Na2CO3溶液+HCl溶液 放出气泡 CO32-+2H+=CO2↑
③NaOH溶液(酚酞)+盐酸 溶液红色消失 H++OH-=H2O
归纳总结 生成沉淀、放出气体或生成水
板书设计 二、离子反应发生的条件离子反应:离子方程式:离子反应发生的条件
巩固练习:
1. 下列各组反应中,不能用同一个离子方程式表示的是( )
A.盐酸分别与NaOH溶液、Ca(OH)2溶液反应
B.硫酸分别与NaOH溶液、Ba(OH)2溶液反应
C. 硝酸分别与Na2CO3溶液、K2CO3溶液反应
D. 锌分别与稀盐酸、稀硫酸反应
2. 不能用离子方程式CO32-+2H+=CO2↑+H2O表示的是( )
A. Na2CO3+2HCl=2NaCl +CO2↑+H2O
B. NaHCO3+HCl=NaCl +CO2↑+H2O
C. K2CO3+H2SO4=Na2SO4 +CO2↑+H2O
D. K2CO3+2HNO3=2KNO3 +CO2↑+H2O
3. 下列离子方程式错误的是( )
A.铁与稀硫酸反应:2Fe+6H+=2Fe3++3H2↑
B.盐酸与氢氧化钡溶液:H++OH-=H2O
C.碳酸钙与稀硝酸:CaCO3+2H+=2Ca2++ CO2↑+H2O
D.硫酸铜溶液与氢氧化钡溶液:Cu2++SO42-+Ba2++2OH-=Cu(OH)2↓+BaSO4↓
4. 在pH=1的无色为溶液中,能大量共存的离子组是( )
A.NH4+、Mg2+、SO42-、Cl-
B. Ba2+、K+、OH-、Cl-
C.Al3+、MnO4-、SO42-、Cl-
D.Na+、Cu2+、Cl-、Ba2+
5. 对四种无色溶液进行离子检验,检验结果如下,其中明显不正确的是( )
A. SO32-、OH-、Cl-、K+
B. Na+、NO3-、OH-、Cl-
C. K+ 、Na+、NO3-、Cl-
D. K+ 、CO32-、 H+ 、Ba2+
6. 将两种物质的溶液相混合,有魄白色沉淀生成,加入稀硝酸后,沉淀消失并有气泡生成,再加入AgNO3溶液,又生成白色沉淀,则这两种物质是( )
A.MgCl2和Na2CO3 B.K2SO4和BaCl2
C.NaOH和CuSO4 D. K2CO3和Ca(NO3)2
7. 离子方程式CO32-+2H+=CO2↑+H2O表示的意义是________________________________
____________________________________________________________________________________________________________________________________,写出实现该离子反应的一个化学方程式__________________________________
8. 某溶液中可能存在下列阴离子:Cl-、SO42-、CO32-中的一种或几种
(1) 当溶液中存在大量H+时,________________不能在溶液中大量存在
(1) 当溶液中存在大量Ag+时,________________不能在溶液中大量存在
(1) 当向溶液中加入Ba(NO3)2溶液能生成白色沉淀,则原溶液中存在的离子是__________
为了进一步确定的溶液中存在哪种离子,可继续向溶液中加入_______________,通过观察
_______________再作出进一步的判断。
备课参考
1. 练习答案:1.B 2.B 3.A 4.A 5.D 6.A
7.可溶性碳酸盐与强酸溶液反应生成二氧化碳和水 Na2CO3+2HCl=2NaCl +CO2↑+H2O
8. (1)CO32- (2)Cl-、SO42-、CO32- (3)SO42-、CO32-至少有一种;稀硝酸;沉淀是否部分溶解或全部溶解或都不溶解
1. 备课资料:
1.离子反应发生的条件
(1) 生成难溶物质或微溶物:如SO42-与Ag+、SO42-与Ca2+、CO32-与Mg2+等生成微溶物导致离子反应发生
(1) 生成气体或挥发性物质:如NH4+与OH-、H+与、CO32-、HCO3-、S2-、HS-、
SO32-、HSO3-等之间发生离子反应
(1) 生成弱电解质:如H+与CH3COO-、CO32-、S2-、SO32-、F-等生成弱酸;OH-与NH4+、Cu2+、Fe3+等生成弱碱;H+与OH-生成水(水是一种极弱的电解质)
2.书写离子方程式的步骤:
(1) 写:写出正确的化学方程式
(1) 拆:将化学式中易溶于水且能完全电离的物质拆写成阴、阳离子符号;而难溶于水、难电离、气体、水、单质等仍用化学式表示
(1) 删:删去方程式等号两边重复的离子
(1) 查:检查是否满足元素原子守恒、反应前后电荷守恒等。
21世纪教育网 -- 中国最大型、最专业的中小学教育资源门户网站。 版权所有@21世纪教育网
