北京10届高三化学试题分类汇编(电化学)
文档属性
| 名称 | 北京10届高三化学试题分类汇编(电化学) |

|
|
| 格式 | rar | ||
| 文件大小 | 812.2KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2010-09-07 11:47:00 | ||
图片预览

文档简介
北京10届高三化学试题分类汇编(电化学)
1、(10届崇文区二模)11.用铅蓄电池(总反应:Pb+PbO2+4H++2SO42-2PbSO4+2H2O电解苦卤水(含C1-、Br-、Na+、Mg2+)的装置如图所示(a、b为石墨电极)。
下列说法中正确的是:
A.铅蓄电池放电时的正极反应是:PbO2+4H++SO42-=PbSO4+2H2O
B.电解苦卤水时,a电极首先放电的是Br-而不是Cl-,说明当其它条件相同时Br-的还原性强于Cl-
C.铅蓄电池充电时,A极应与外接电源负极相连
D.忽略能量消耗,当b极产生0.02g气体时,铅蓄电池中消耗0.01mol H2SO4
2、(10届朝阳区二模)10.右图是水煤气(成分为CO、H2)空气燃料电池的工作原理示意图,a、b均为惰性电极。下列叙述中正确的是:
A.A处通入的是空气,B处通入的是水煤气
B.a电极发生还原反应,b电极发生氧化反应
C.a电极的反应式包括:CO+4OH-+2e-=CO32-+2H2O
D.如用这种电池电镀铜,待镀金属增重6.4g,则至少消耗标准状况下的水煤气2.24 L
3、(10届东城区二模)11.如图,a、b是石墨电极,通电一段时间后,b极附近溶液显红色。下列说法正确的是:
A.X极是电源负极,Y极是电源正极
B.a极的电极反应是2Cl--2e-=Cl2↑
C.电解过程中CuSO4溶液的pH逐渐增大
D.Pt极上有6.4gCu析出时,b极产生2.24L(标准状况)气体
4、(10届丰台区二模)10.用铅蓄电池电解甲、乙池中的溶液。已知铅蓄电池的总反应为:
Pb(s)+PbO2(s)+2H2SO4(aq)2PbSO4(s)+2H2O(1)
A.d极为阴极; B.若利用甲池精炼铜,b极应为粗铜
C.放电时铅蓄电池负极的电极反应式为:
PbO2(s)+4H+(aq)+SO42-(aq)+4e-=PbSO4(s)+2H2O(1)
D.若四个电极材料均为石墨,当析出6.4 g Cu时,两池中共产生气体3.36 L(标准状况下)
5、(10届上西城区)8.下列叙述中,正确的是
A.在船舶的外壳装上铜块可防止其发生电化学腐蚀
B.MnO2、FeCl3和CuSO4都可加快H2O2的分解速率
C.FeCl3溶液和Fe2(SO4)3溶液加热蒸干、灼烧都得到Fe2O3
D.用惰性电极分别电解CuCl2溶液和MgCl2溶液分别得到单质Cu和Mg
6、(10届上西城区)17.用酸性氢氧燃料电池为电源进行电解的实验装置示意图如下图所示。下列说法中,正确的是
A.燃料电池工作时,正极反应为:O2 +2H2O+4e-=4OH-
B.a极是铁,b极是铜时,b极逐渐溶解,a极上有铜析出;
C.a极是粗铜,b极是纯铜时,a极逐渐溶解,b极上有铜析出
D.a、b两极均是石墨时,在相同条件下a极产生的气体与电池中消耗的H2体积相等
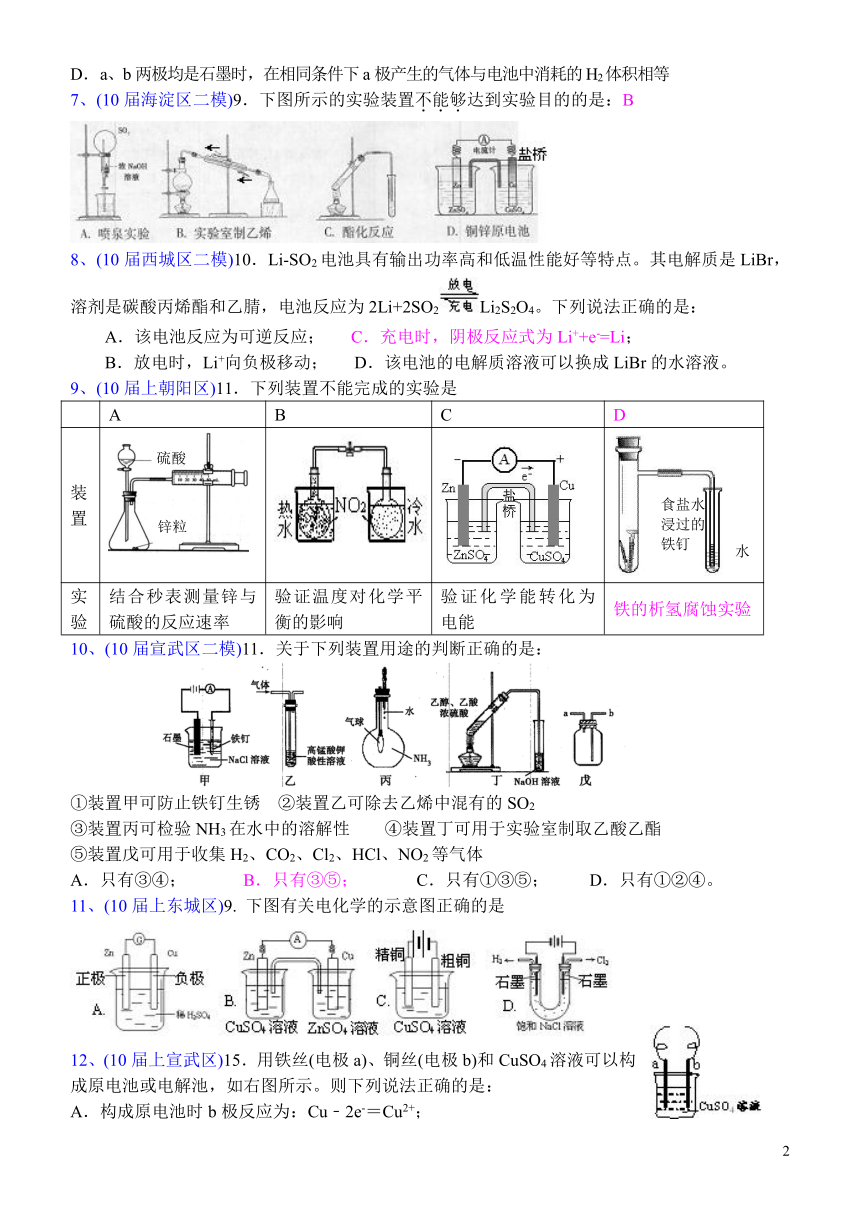
7、(10届海淀区二模)9.下图所示的实验装置不能够达到实验目的的是:B
8、(10届西城区二模)10.Li-SO2电池具有输出功率高和低温性能好等特点。其电解质是LiBr,溶剂是碳酸丙烯酯和乙腈,电池反应为2Li+2SO2Li2S2O4。下列说法正确的是:
A.该电池反应为可逆反应; C.充电时,阴极反应式为Li++e-=Li;
B.放电时,Li+向负极移动; D.该电池的电解质溶液可以换成LiBr的水溶液。
9、(10届上朝阳区)11.下列装置不能完成的实验是
A
B
C
D
装置
实验
结合秒表测量锌与硫酸的反应速率
验证温度对化学平衡的影响
验证化学能转化为电能
铁的析氢腐蚀实验
10、(10届宣武区二模)11.关于下列装置用途的判断正确的是:
①装置甲可防止铁钉生锈 ②装置乙可除去乙烯中混有的SO2
③装置丙可检验NH3在水中的溶解性 ④装置丁可用于实验室制取乙酸乙酯
⑤装置戊可用于收集H2、CO2、Cl2、HCl、NO2等气体
A.只有③④; B.只有③⑤; C.只有①③⑤; D.只有①②④。
11、(10届上东城区)9. 下图有关电化学的示意图正确的是
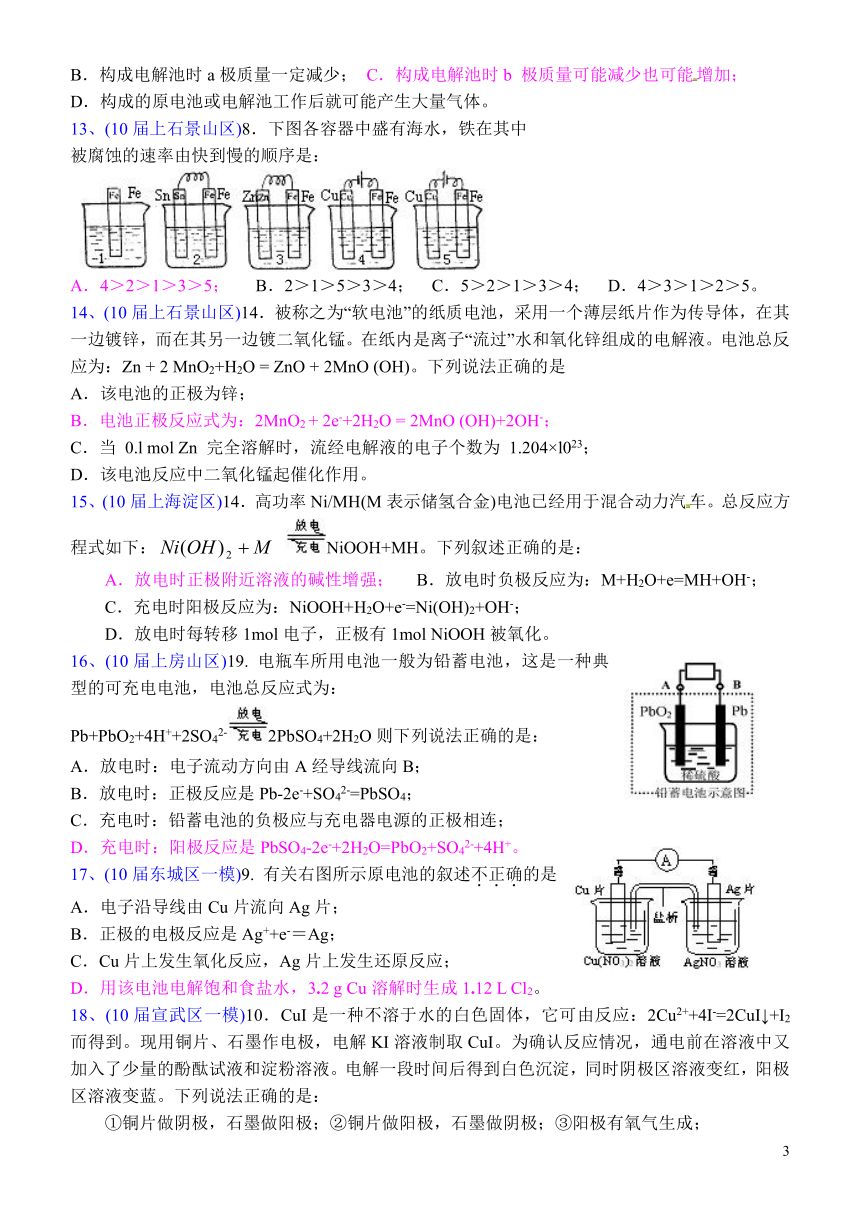
12、(10届上宣武区)15.用铁丝(电极a)、铜丝(电极b)和CuSO4溶液可以构成原电池或电解池,如右图所示。则下列说法正确的是:
A.构成原电池时b极反应为:Cu﹣2e-=Cu2+;
B.构成电解池时a极质量一定减少; C.构成电解池时b 极质量可能减少也可能增加;
D.构成的原电池或电解池工作后就可能产生大量气体。
13、(10届上石景山区)8.下图各容器中盛有海水,铁在其中
被腐蚀的速率由快到慢的顺序是:
A.4>2>1>3>5; B.2>1>5>3>4; C.5>2>1>3>4; D.4>3>1>2>5。
14、(10届上石景山区)14.被称之为“软电池”的纸质电池,采用一个薄层纸片作为传导体,在其一边镀锌,而在其另一边镀二氧化锰。在纸内是离子“流过”水和氧化锌组成的电解液。电池总反应为:Zn + 2 MnO2+H2O = ZnO + 2MnO (OH)。下列说法正确的是
A.该电池的正极为锌;
B.电池正极反应式为:2MnO2 + 2e-+2H2O = 2MnO (OH)+2OH-;
C.当 0.l mol Zn 完全溶解时,流经电解液的电子个数为 1.204×l023;
D.该电池反应中二氧化锰起催化作用。
15、(10届上海淀区)14.高功率Ni/MH(M表示储氢合金)电池已经用于混合动力汽车。总反应方程式如下: NiOOH+MH。下列叙述正确的是:
A.放电时正极附近溶液的碱性增强; B.放电时负极反应为:M+H2O+e=MH+OH-;
C.充电时阳极反应为:NiOOH+H2O+e-=Ni(OH)2+OH-;
D.放电时每转移1mol电子,正极有1mol NiOOH被氧化。
16、(10届上房山区)19. 电瓶车所用电池一般为铅蓄电池,这是一种典型的可充电电池,电池总反应式为:
Pb+PbO2+4H++2SO42-2PbSO4+2H2O则下列说法正确的是:
A.放电时:电子流动方向由A经导线流向B;
B.放电时:正极反应是Pb-2e-+SO42-=PbSO4;
C.充电时:铅蓄电池的负极应与充电器电源的正极相连;
D.充电时:阳极反应是PbSO4-2e-+2H2O=PbO2+SO42-+4H+。
17、(10届东城区一模)9. 有关右图所示原电池的叙述不正确的是
A.电子沿导线由Cu片流向Ag片;
B.正极的电极反应是Ag++e-=Ag;
C.Cu片上发生氧化反应,Ag片上发生还原反应;
D.用该电池电解饱和食盐水,3.2 g Cu溶解时生成1.12 L Cl2。
18、(10届宣武区一模)10.CuI是一种不溶于水的白色固体,它可由反应:2Cu2++4I-=2CuI↓+I2而得到。现用铜片、石墨作电极,电解KI溶液制取CuI。为确认反应情况,通电前在溶液中又加入了少量的酚酞试液和淀粉溶液。电解一段时间后得到白色沉淀,同时阴极区溶液变红,阳极区溶液变蓝。下列说法正确的是:
①铜片做阴极,石墨做阳极;②铜片做阳极,石墨做阴极;③阳极有氧气生成;
④阴极有氢气生成; ⑤白色沉淀在阳极附近生成;⑥白色沉淀在阴极附近生成;
⑦阳极区溶液变蓝的原因是2Cu+4I-―4e-=2CuI↓+I2 碘遇淀粉变蓝
⑧阳极区溶液变蓝的原因是4OH-―4e-=2H2O+O2↑,O2将I-氧化为I2,碘遇淀粉变蓝。
A.只有②④⑤⑦;B.只有①④⑥⑦;C.只有②③⑤⑧;D.只有①③⑥⑧。
19、(10届延庆区一模)9.右图中,两电极上发生的电极反应为:
a极:Cu2++2e-=Cu;b极:Fe-2e-=Fe2+下列说法不正确的是: A.装置中电解质溶液一定含有Cu2+;B.该装置一定是化学能转化为电能;
C.a、b可能是同种电极材料; D.a极上一定发生还原反应。
20、(10届上房山区)24.(12分)一个完整的氧化还原反应方程式可以拆写成两个“半反应式”,一个是“氧化反应式”,一个是“还原反应式”。如2Fe3++Cu=2Fe2++Cu2+,可拆写为氧化反应式:Cu-2e-=Cu2+,还原反应式:2Fe3++2e-=2Fe2+。并由此实现了化学能与电能的相互转化。据此,回答下列问题: (1)将反应Zn+2H+=Zn2++H2↑拆写为两个“半反应式”:
其中,氧化反应式为:_____________________。
(2)由题(1)反应,设计成原电池如右图所示:
若电极a为Zn,电极b可选择材料:_________ (只填一种);
电解质溶液甲是__________;电极b处的电极反应式:_________。
(3)由反应2H2+O2=2H2O,设计出以稀硫酸为电解质溶液的燃料电池,其电极反应式为:负极_______,正极_____________________。
(4)以惰性材料为电极,电解100mL pH=6的硫酸铜溶液,当电解池内溶液的pH为1时,电极上析出的铜的质量为_________________________(忽略电解前后溶液体积的变化)。
21、(10届朝阳区一模)25.(14分)已知X+、Y3+、Z-、W2-是短周期元素X、Y、Z、W形成的离子,下图中的甲、乙、丙均是由上述四种离子中的两种组成的化合物。
回答下列问题:(1)通常状况下,Z的单质是一种黄绿色气体,工业上常用电解溶液C的方法制备该单质,制备反应的化学方程式是 。(2)①甲的化学式是 ,乙的化学式可能是 (写一种即可) ②若将溶液A与溶液B混合,产生白色沉淀,则该反应的离子方程式是 。
若W2-和Z-具有相同电子层结构,则乙的电子式是 。
(3)Y单质可用来制造Y—空气燃料电池,该电池通常以溶液C或氢氧化钾溶液为电解质溶液,通入空气的电极为正极。①若以溶液C为电解质溶液时,正极的反应式为 。
②若以氢氧化钾溶液为电解质溶液时,电池的总反应式为 。
(4)欲实现反应Cu+H2SO4==CuSO4+H2,在你认为能实现该转化的装置中的括号内,标出电极材料(填“Cu”或“C”)
20、(12分)(1)Zn-2e-=Zn2+(2分);(2)Cu(合理给1分),ZnSO4(1分),2H++2e-=H2↑(2分).
(3)负极:2H2- 4e-= 4H+,正极:O2+4H++4e- = 2H2O(4分);(4)0.32g(2分)
21.(14分,每空2分) (1)2NaCl+2H2OH2↑+Cl2↑+2NaOH (2)①AlCl3 Na2S或Na2O
②Al3++3OH-+Al(OH)3↓或2Al3++3S2-+6H2O=2Al(OH)3↓+3H2S↑
(3)①O2+2H2+4e-=4OH- ②4Al+3O2+4KOH=4KAlO2+2H2O
22、(10届海淀区一模)27.(14分)电浮选凝聚法是工业上采用的一种污水处理方法:保持污水的pH在5.0~6.0之间,通过电解生成Fe(OH)3沉淀。Fe(OH)3有吸附性,可吸附污物而沉积下来,具有净化水的作用。阴极产生的气泡把污水中悬浮物带到水面形成浮渣层,刮去(或撇掉)浮渣层,即起到了浮选净化的作用。
某科研小组用电浮选凝聚法处理污水,设计装置如图所示:
(1)实验时若污水中离子浓度较小,导电能力较差,产生气泡速率缓慢,无法使悬浮物形成浮渣。此时,应向污水中加入适量的 。
a.H2SO4;b.BaSO4;c.Na2SO4;d.NaOH;e.CH3CH2OH。
(2)电解池阳极的电极反应分别是① ;
②4OH- -4e-=2H2O+O2↑。
(3)电极反应①和②的生成物反应得到Fe(OH)3沉淀的离子方程式是 。
(4)熔融盐燃料电池是以熔融碳酸盐为电解质,以CH4为燃料,空气为氧化剂,稀土金属材料为电极。
已知负极的电极反应是CH4+4CO32- -8e-=5CO2+2H2O。 ①正极的电极反应是 。
②为了使该燃料电池长时间稳定运行,电池的电解质组成应保持稳定。为此电池工作时必须有部分A物质参加循环。则A物质的化学式是 。
(5)实验过程中,若在阴极产生了44.8 L(标准状况)气体,则熔融盐燃料电池消耗CH4(标准状况) L。
22、(14分)⑴c(2分);⑵Fe-2e-=Fe2+(2分);⑶4Fe2++10H2O+O2=4Fe(OH)3↓+8H+(3分);
⑷①O2+2CO2+4e-=2CO32-( 2O2+4CO2+8e-=4CO32-)(3分);②CO2(2分);⑸11.2(2分);
23、(10届门头沟区一模)28.(14分)已知粗铜中含有少量的锌、铁、银、金等金属和少量矿物杂质(杂质与酸不反应)。某化学兴趣小组在实验室条件下以硫酸铜溶液为电解液,用电解的方法实现了粗铜的提纯,并对阳极泥和电解液中金属进行回收和含量测定。
步骤一:电解精制:
电解时,粗铜应与电源的 _极相连,阴极上的电极反应式为 。
电解过程中,硫酸铜的浓度会 ▲ (选填:变大、不变、变小)。
步骤二:电解完成后,该小组同学按以下流程对电解液进行处理:
(1)阳极泥的综合利用:
稀硝酸处理阳极泥得到硝酸银稀溶液,请你写出该步反应的离子方程式: 。残渣含有极少量的黄金。为了回收金,他们查阅了有关资料(见下表):
序号
反应
化学平衡常数
1
Au + 6HNO3(浓) Au(NO3)3 + 3NO2↑+ 3H2O
<< 1
2
Au3+ + 4Cl- = AuCl4-
>>1
从资料中可知,金很难与硝酸反应,但却可溶于王水(浓硝酸与盐酸按体积比1∶3的混合物),请你从化学平衡移动的角度简要解释金能够溶于王水的原因 。
(2)滤液含量的测定:以下是该小组探究滤液的一个实验流程:
则100mL滤液中Cu2+ 的浓度为 mol·L-1,Fe2+的浓度为 mol·L-1
23、(每空2分,共14分)步骤一:正 Cu2+ + 2e- = Cu 变小
步骤二:(1) 3Ag + 4H+ +NO3- = 3Ag+ + NO↑+ 2H2O
王水中的Cl-与Au3+反应,降低了Au3+的浓度,使平衡向正反应方向移动,Au不断溶解
(2) 0.5 0.1 注:其它合理答案酌情给分
24、(10届上石景山区)28.⑹随着对合成氨研究的发展,2001年两位希腊化学家提出了电解合成氨的方法,即在常压下把氢气和用氦气稀释的氮气,分别通入一个加热到570℃的电解池中,采用高质子导电性的SCY陶瓷(能传递H+)为介质,用吸附在它内外表面上的金属钯多晶薄膜做电极,实现了常压、570℃条件下高转化率的电解法合成氨(装置如下图)。
请回答:在电解法合成氨的电解池中 (填“能”或“不能”) 用水作电解质溶液的溶剂,原因是 。
钯电极A是电解池的 极(填“阳”或“阴”),该极上的电极反应式是 。
24、(6)不能;新法合成氨电解池的反应温度是570℃时,水为水蒸气; 阴;N2 + 6e- +6H+ = 2NH3
25、(10届宣武区二模) (3)写出以氢氧化钾为电解质的甲醇燃料电池的负极反应式 。
当电子转移为 mol时,参加反应的氧气的体积是6.72L(标准状况下)。
26、(10届崇文区二模)(3)现欲以右图所示装置用电化学原理将CO2、SO2转化为重要化工原料。
①若A为CO2,B为H2,C为CH3OH则通入H2的一极为 极;
②若A为SO2,B为O2,C为H2SO4,则负极的电极反应式为 。
26、(3)①负(2分);②SO2+2H2O-2e-=SO2-4+4H+(2分)
27、(10届上丰台区)23.(9分)
下图是目前世界上比较先进的电解法制烧碱技术—阳离子交换膜法的示意图。
(1)精制饱和食盐水从_______口加入,从另一口加入水(含少量NaOH)。水中加入NaOH的作用是____________________________;制得的烧碱溶液从_____口导出。
(2)为有效除去粗盐中的Ca2+、Mg2+、SO42-,加入试剂的合理顺序为_________(填字母)。
a.先加NaOH,再加Na2CO3,最后加钡试剂;
b.先加NaOH,再加钡试剂,最后加Na2CO3;
c.先加钡试剂,再加Na2CO3,最后加NaOH。
(3)现有1000mL食盐水,用石墨电极电解。当阴极产生气体的体积为112mL(标准状况)时停止电解,阳极的电极反应式为_______________________,电解后,溶液在常温下的pH约为_____。
27、(本题9分)(1)F(1分) 增强溶液的导电性(1分) C(1分)
(2)bc (2分)(3)2Cl--2e- = Cl2↑(2分) 12(2分)
28、(10届上崇文区)18.(10分)
(1)在298K时,1molC2H6在氧气中完全燃烧生成二氧化碳和液态水,放出热量1558.3kJ。写出该反应的热化学方程式 。
(2)利用该反应设计一个燃料电池:用氢氧化钾溶液作电解质溶液,多孔石墨做电极,在电极上分别通入乙烷和氧气。通入乙烷气体的电极应为 极(填写“正”或“负”),该电极上发生的电极反应是 (填字母代号)。a.2C2H6-14e- +7O2 =4CO2+6H2O;
b.C2H6-14 e- + 18OH-==2CO32-+12H2O;
c. O2 +2H2O+4e- ==4OH-;d. O2-4e- +4H+==2H2O。
(3)在右图所示实验装置中,石墨棒上的电极反应式为 ;如果起始时盛有1000mL pH=5的硫酸铜溶液(25℃,CuSO4足量),一段时间后溶液的pH变为1,此时可观察到的现象是 ;若要使溶液恢复到起始浓度(温度不变,忽略溶液体积的变化),可向溶液中加入 (填物质名称),其质量约为 。
28.(10分)(1)2 C2H6(g) + 7 O2(g)=== 4 CO2(g)+ 6 H2O(l) △H = -3116.6 kJ/mol (2分)
(2)负 (1分);b (1分);(3)4OH- — 4 e- = O2↑+ 2H2O (2分)
石墨电极表面有气泡产生, 铁电极上附着一层红色物质,溶液颜色变浅 (2分)
氧化铜(或碳酸铜) (1分); 4g(或6.2g) (1分)
29、(10届上西城区)22.(6分)海水资源的利用具有非常广阔的前景。
(1)海水淡化的主要方法有(只写出1种即可) 。
(2)海水中丰富的氯化钠是重要的化工原料,如电解饱和食盐水可以制备多种化工产品。
①用石墨电极电解饱和食盐水时,阳极的电极反应式是 。
②常温下,用石墨电极电解饱和食盐水,当阴极产生的气体体积为112 mL(已折算为标准状况)时停止电解,此时溶液体积为1 L,若忽略气体的溶解,最终溶液的pH约为 。
29.(6分)(1)(2分)蒸馏法(或电渗析法 或离子交换法)
(2)①(2分)2Cl--2e-= Cl2↑ ②(2分)12
1、(10届崇文区二模)11.用铅蓄电池(总反应:Pb+PbO2+4H++2SO42-2PbSO4+2H2O电解苦卤水(含C1-、Br-、Na+、Mg2+)的装置如图所示(a、b为石墨电极)。
下列说法中正确的是:
A.铅蓄电池放电时的正极反应是:PbO2+4H++SO42-=PbSO4+2H2O
B.电解苦卤水时,a电极首先放电的是Br-而不是Cl-,说明当其它条件相同时Br-的还原性强于Cl-
C.铅蓄电池充电时,A极应与外接电源负极相连
D.忽略能量消耗,当b极产生0.02g气体时,铅蓄电池中消耗0.01mol H2SO4
2、(10届朝阳区二模)10.右图是水煤气(成分为CO、H2)空气燃料电池的工作原理示意图,a、b均为惰性电极。下列叙述中正确的是:
A.A处通入的是空气,B处通入的是水煤气
B.a电极发生还原反应,b电极发生氧化反应
C.a电极的反应式包括:CO+4OH-+2e-=CO32-+2H2O
D.如用这种电池电镀铜,待镀金属增重6.4g,则至少消耗标准状况下的水煤气2.24 L
3、(10届东城区二模)11.如图,a、b是石墨电极,通电一段时间后,b极附近溶液显红色。下列说法正确的是:
A.X极是电源负极,Y极是电源正极
B.a极的电极反应是2Cl--2e-=Cl2↑
C.电解过程中CuSO4溶液的pH逐渐增大
D.Pt极上有6.4gCu析出时,b极产生2.24L(标准状况)气体
4、(10届丰台区二模)10.用铅蓄电池电解甲、乙池中的溶液。已知铅蓄电池的总反应为:
Pb(s)+PbO2(s)+2H2SO4(aq)2PbSO4(s)+2H2O(1)
A.d极为阴极; B.若利用甲池精炼铜,b极应为粗铜
C.放电时铅蓄电池负极的电极反应式为:
PbO2(s)+4H+(aq)+SO42-(aq)+4e-=PbSO4(s)+2H2O(1)
D.若四个电极材料均为石墨,当析出6.4 g Cu时,两池中共产生气体3.36 L(标准状况下)
5、(10届上西城区)8.下列叙述中,正确的是
A.在船舶的外壳装上铜块可防止其发生电化学腐蚀
B.MnO2、FeCl3和CuSO4都可加快H2O2的分解速率
C.FeCl3溶液和Fe2(SO4)3溶液加热蒸干、灼烧都得到Fe2O3
D.用惰性电极分别电解CuCl2溶液和MgCl2溶液分别得到单质Cu和Mg
6、(10届上西城区)17.用酸性氢氧燃料电池为电源进行电解的实验装置示意图如下图所示。下列说法中,正确的是
A.燃料电池工作时,正极反应为:O2 +2H2O+4e-=4OH-
B.a极是铁,b极是铜时,b极逐渐溶解,a极上有铜析出;
C.a极是粗铜,b极是纯铜时,a极逐渐溶解,b极上有铜析出
D.a、b两极均是石墨时,在相同条件下a极产生的气体与电池中消耗的H2体积相等
7、(10届海淀区二模)9.下图所示的实验装置不能够达到实验目的的是:B
8、(10届西城区二模)10.Li-SO2电池具有输出功率高和低温性能好等特点。其电解质是LiBr,溶剂是碳酸丙烯酯和乙腈,电池反应为2Li+2SO2Li2S2O4。下列说法正确的是:
A.该电池反应为可逆反应; C.充电时,阴极反应式为Li++e-=Li;
B.放电时,Li+向负极移动; D.该电池的电解质溶液可以换成LiBr的水溶液。
9、(10届上朝阳区)11.下列装置不能完成的实验是
A
B
C
D
装置
实验
结合秒表测量锌与硫酸的反应速率
验证温度对化学平衡的影响
验证化学能转化为电能
铁的析氢腐蚀实验
10、(10届宣武区二模)11.关于下列装置用途的判断正确的是:
①装置甲可防止铁钉生锈 ②装置乙可除去乙烯中混有的SO2
③装置丙可检验NH3在水中的溶解性 ④装置丁可用于实验室制取乙酸乙酯
⑤装置戊可用于收集H2、CO2、Cl2、HCl、NO2等气体
A.只有③④; B.只有③⑤; C.只有①③⑤; D.只有①②④。
11、(10届上东城区)9. 下图有关电化学的示意图正确的是
12、(10届上宣武区)15.用铁丝(电极a)、铜丝(电极b)和CuSO4溶液可以构成原电池或电解池,如右图所示。则下列说法正确的是:
A.构成原电池时b极反应为:Cu﹣2e-=Cu2+;
B.构成电解池时a极质量一定减少; C.构成电解池时b 极质量可能减少也可能增加;
D.构成的原电池或电解池工作后就可能产生大量气体。
13、(10届上石景山区)8.下图各容器中盛有海水,铁在其中
被腐蚀的速率由快到慢的顺序是:
A.4>2>1>3>5; B.2>1>5>3>4; C.5>2>1>3>4; D.4>3>1>2>5。
14、(10届上石景山区)14.被称之为“软电池”的纸质电池,采用一个薄层纸片作为传导体,在其一边镀锌,而在其另一边镀二氧化锰。在纸内是离子“流过”水和氧化锌组成的电解液。电池总反应为:Zn + 2 MnO2+H2O = ZnO + 2MnO (OH)。下列说法正确的是
A.该电池的正极为锌;
B.电池正极反应式为:2MnO2 + 2e-+2H2O = 2MnO (OH)+2OH-;
C.当 0.l mol Zn 完全溶解时,流经电解液的电子个数为 1.204×l023;
D.该电池反应中二氧化锰起催化作用。
15、(10届上海淀区)14.高功率Ni/MH(M表示储氢合金)电池已经用于混合动力汽车。总反应方程式如下: NiOOH+MH。下列叙述正确的是:
A.放电时正极附近溶液的碱性增强; B.放电时负极反应为:M+H2O+e=MH+OH-;
C.充电时阳极反应为:NiOOH+H2O+e-=Ni(OH)2+OH-;
D.放电时每转移1mol电子,正极有1mol NiOOH被氧化。
16、(10届上房山区)19. 电瓶车所用电池一般为铅蓄电池,这是一种典型的可充电电池,电池总反应式为:
Pb+PbO2+4H++2SO42-2PbSO4+2H2O则下列说法正确的是:
A.放电时:电子流动方向由A经导线流向B;
B.放电时:正极反应是Pb-2e-+SO42-=PbSO4;
C.充电时:铅蓄电池的负极应与充电器电源的正极相连;
D.充电时:阳极反应是PbSO4-2e-+2H2O=PbO2+SO42-+4H+。
17、(10届东城区一模)9. 有关右图所示原电池的叙述不正确的是
A.电子沿导线由Cu片流向Ag片;
B.正极的电极反应是Ag++e-=Ag;
C.Cu片上发生氧化反应,Ag片上发生还原反应;
D.用该电池电解饱和食盐水,3.2 g Cu溶解时生成1.12 L Cl2。
18、(10届宣武区一模)10.CuI是一种不溶于水的白色固体,它可由反应:2Cu2++4I-=2CuI↓+I2而得到。现用铜片、石墨作电极,电解KI溶液制取CuI。为确认反应情况,通电前在溶液中又加入了少量的酚酞试液和淀粉溶液。电解一段时间后得到白色沉淀,同时阴极区溶液变红,阳极区溶液变蓝。下列说法正确的是:
①铜片做阴极,石墨做阳极;②铜片做阳极,石墨做阴极;③阳极有氧气生成;
④阴极有氢气生成; ⑤白色沉淀在阳极附近生成;⑥白色沉淀在阴极附近生成;
⑦阳极区溶液变蓝的原因是2Cu+4I-―4e-=2CuI↓+I2 碘遇淀粉变蓝
⑧阳极区溶液变蓝的原因是4OH-―4e-=2H2O+O2↑,O2将I-氧化为I2,碘遇淀粉变蓝。
A.只有②④⑤⑦;B.只有①④⑥⑦;C.只有②③⑤⑧;D.只有①③⑥⑧。
19、(10届延庆区一模)9.右图中,两电极上发生的电极反应为:
a极:Cu2++2e-=Cu;b极:Fe-2e-=Fe2+下列说法不正确的是: A.装置中电解质溶液一定含有Cu2+;B.该装置一定是化学能转化为电能;
C.a、b可能是同种电极材料; D.a极上一定发生还原反应。
20、(10届上房山区)24.(12分)一个完整的氧化还原反应方程式可以拆写成两个“半反应式”,一个是“氧化反应式”,一个是“还原反应式”。如2Fe3++Cu=2Fe2++Cu2+,可拆写为氧化反应式:Cu-2e-=Cu2+,还原反应式:2Fe3++2e-=2Fe2+。并由此实现了化学能与电能的相互转化。据此,回答下列问题: (1)将反应Zn+2H+=Zn2++H2↑拆写为两个“半反应式”:
其中,氧化反应式为:_____________________。
(2)由题(1)反应,设计成原电池如右图所示:
若电极a为Zn,电极b可选择材料:_________ (只填一种);
电解质溶液甲是__________;电极b处的电极反应式:_________。
(3)由反应2H2+O2=2H2O,设计出以稀硫酸为电解质溶液的燃料电池,其电极反应式为:负极_______,正极_____________________。
(4)以惰性材料为电极,电解100mL pH=6的硫酸铜溶液,当电解池内溶液的pH为1时,电极上析出的铜的质量为_________________________(忽略电解前后溶液体积的变化)。
21、(10届朝阳区一模)25.(14分)已知X+、Y3+、Z-、W2-是短周期元素X、Y、Z、W形成的离子,下图中的甲、乙、丙均是由上述四种离子中的两种组成的化合物。
回答下列问题:(1)通常状况下,Z的单质是一种黄绿色气体,工业上常用电解溶液C的方法制备该单质,制备反应的化学方程式是 。(2)①甲的化学式是 ,乙的化学式可能是 (写一种即可) ②若将溶液A与溶液B混合,产生白色沉淀,则该反应的离子方程式是 。
若W2-和Z-具有相同电子层结构,则乙的电子式是 。
(3)Y单质可用来制造Y—空气燃料电池,该电池通常以溶液C或氢氧化钾溶液为电解质溶液,通入空气的电极为正极。①若以溶液C为电解质溶液时,正极的反应式为 。
②若以氢氧化钾溶液为电解质溶液时,电池的总反应式为 。
(4)欲实现反应Cu+H2SO4==CuSO4+H2,在你认为能实现该转化的装置中的括号内,标出电极材料(填“Cu”或“C”)
20、(12分)(1)Zn-2e-=Zn2+(2分);(2)Cu(合理给1分),ZnSO4(1分),2H++2e-=H2↑(2分).
(3)负极:2H2- 4e-= 4H+,正极:O2+4H++4e- = 2H2O(4分);(4)0.32g(2分)
21.(14分,每空2分) (1)2NaCl+2H2OH2↑+Cl2↑+2NaOH (2)①AlCl3 Na2S或Na2O
②Al3++3OH-+Al(OH)3↓或2Al3++3S2-+6H2O=2Al(OH)3↓+3H2S↑
(3)①O2+2H2+4e-=4OH- ②4Al+3O2+4KOH=4KAlO2+2H2O
22、(10届海淀区一模)27.(14分)电浮选凝聚法是工业上采用的一种污水处理方法:保持污水的pH在5.0~6.0之间,通过电解生成Fe(OH)3沉淀。Fe(OH)3有吸附性,可吸附污物而沉积下来,具有净化水的作用。阴极产生的气泡把污水中悬浮物带到水面形成浮渣层,刮去(或撇掉)浮渣层,即起到了浮选净化的作用。
某科研小组用电浮选凝聚法处理污水,设计装置如图所示:
(1)实验时若污水中离子浓度较小,导电能力较差,产生气泡速率缓慢,无法使悬浮物形成浮渣。此时,应向污水中加入适量的 。
a.H2SO4;b.BaSO4;c.Na2SO4;d.NaOH;e.CH3CH2OH。
(2)电解池阳极的电极反应分别是① ;
②4OH- -4e-=2H2O+O2↑。
(3)电极反应①和②的生成物反应得到Fe(OH)3沉淀的离子方程式是 。
(4)熔融盐燃料电池是以熔融碳酸盐为电解质,以CH4为燃料,空气为氧化剂,稀土金属材料为电极。
已知负极的电极反应是CH4+4CO32- -8e-=5CO2+2H2O。 ①正极的电极反应是 。
②为了使该燃料电池长时间稳定运行,电池的电解质组成应保持稳定。为此电池工作时必须有部分A物质参加循环。则A物质的化学式是 。
(5)实验过程中,若在阴极产生了44.8 L(标准状况)气体,则熔融盐燃料电池消耗CH4(标准状况) L。
22、(14分)⑴c(2分);⑵Fe-2e-=Fe2+(2分);⑶4Fe2++10H2O+O2=4Fe(OH)3↓+8H+(3分);
⑷①O2+2CO2+4e-=2CO32-( 2O2+4CO2+8e-=4CO32-)(3分);②CO2(2分);⑸11.2(2分);
23、(10届门头沟区一模)28.(14分)已知粗铜中含有少量的锌、铁、银、金等金属和少量矿物杂质(杂质与酸不反应)。某化学兴趣小组在实验室条件下以硫酸铜溶液为电解液,用电解的方法实现了粗铜的提纯,并对阳极泥和电解液中金属进行回收和含量测定。
步骤一:电解精制:
电解时,粗铜应与电源的 _极相连,阴极上的电极反应式为 。
电解过程中,硫酸铜的浓度会 ▲ (选填:变大、不变、变小)。
步骤二:电解完成后,该小组同学按以下流程对电解液进行处理:
(1)阳极泥的综合利用:
稀硝酸处理阳极泥得到硝酸银稀溶液,请你写出该步反应的离子方程式: 。残渣含有极少量的黄金。为了回收金,他们查阅了有关资料(见下表):
序号
反应
化学平衡常数
1
Au + 6HNO3(浓) Au(NO3)3 + 3NO2↑+ 3H2O
<< 1
2
Au3+ + 4Cl- = AuCl4-
>>1
从资料中可知,金很难与硝酸反应,但却可溶于王水(浓硝酸与盐酸按体积比1∶3的混合物),请你从化学平衡移动的角度简要解释金能够溶于王水的原因 。
(2)滤液含量的测定:以下是该小组探究滤液的一个实验流程:
则100mL滤液中Cu2+ 的浓度为 mol·L-1,Fe2+的浓度为 mol·L-1
23、(每空2分,共14分)步骤一:正 Cu2+ + 2e- = Cu 变小
步骤二:(1) 3Ag + 4H+ +NO3- = 3Ag+ + NO↑+ 2H2O
王水中的Cl-与Au3+反应,降低了Au3+的浓度,使平衡向正反应方向移动,Au不断溶解
(2) 0.5 0.1 注:其它合理答案酌情给分
24、(10届上石景山区)28.⑹随着对合成氨研究的发展,2001年两位希腊化学家提出了电解合成氨的方法,即在常压下把氢气和用氦气稀释的氮气,分别通入一个加热到570℃的电解池中,采用高质子导电性的SCY陶瓷(能传递H+)为介质,用吸附在它内外表面上的金属钯多晶薄膜做电极,实现了常压、570℃条件下高转化率的电解法合成氨(装置如下图)。
请回答:在电解法合成氨的电解池中 (填“能”或“不能”) 用水作电解质溶液的溶剂,原因是 。
钯电极A是电解池的 极(填“阳”或“阴”),该极上的电极反应式是 。
24、(6)不能;新法合成氨电解池的反应温度是570℃时,水为水蒸气; 阴;N2 + 6e- +6H+ = 2NH3
25、(10届宣武区二模) (3)写出以氢氧化钾为电解质的甲醇燃料电池的负极反应式 。
当电子转移为 mol时,参加反应的氧气的体积是6.72L(标准状况下)。
26、(10届崇文区二模)(3)现欲以右图所示装置用电化学原理将CO2、SO2转化为重要化工原料。
①若A为CO2,B为H2,C为CH3OH则通入H2的一极为 极;
②若A为SO2,B为O2,C为H2SO4,则负极的电极反应式为 。
26、(3)①负(2分);②SO2+2H2O-2e-=SO2-4+4H+(2分)
27、(10届上丰台区)23.(9分)
下图是目前世界上比较先进的电解法制烧碱技术—阳离子交换膜法的示意图。
(1)精制饱和食盐水从_______口加入,从另一口加入水(含少量NaOH)。水中加入NaOH的作用是____________________________;制得的烧碱溶液从_____口导出。
(2)为有效除去粗盐中的Ca2+、Mg2+、SO42-,加入试剂的合理顺序为_________(填字母)。
a.先加NaOH,再加Na2CO3,最后加钡试剂;
b.先加NaOH,再加钡试剂,最后加Na2CO3;
c.先加钡试剂,再加Na2CO3,最后加NaOH。
(3)现有1000mL食盐水,用石墨电极电解。当阴极产生气体的体积为112mL(标准状况)时停止电解,阳极的电极反应式为_______________________,电解后,溶液在常温下的pH约为_____。
27、(本题9分)(1)F(1分) 增强溶液的导电性(1分) C(1分)
(2)bc (2分)(3)2Cl--2e- = Cl2↑(2分) 12(2分)
28、(10届上崇文区)18.(10分)
(1)在298K时,1molC2H6在氧气中完全燃烧生成二氧化碳和液态水,放出热量1558.3kJ。写出该反应的热化学方程式 。
(2)利用该反应设计一个燃料电池:用氢氧化钾溶液作电解质溶液,多孔石墨做电极,在电极上分别通入乙烷和氧气。通入乙烷气体的电极应为 极(填写“正”或“负”),该电极上发生的电极反应是 (填字母代号)。a.2C2H6-14e- +7O2 =4CO2+6H2O;
b.C2H6-14 e- + 18OH-==2CO32-+12H2O;
c. O2 +2H2O+4e- ==4OH-;d. O2-4e- +4H+==2H2O。
(3)在右图所示实验装置中,石墨棒上的电极反应式为 ;如果起始时盛有1000mL pH=5的硫酸铜溶液(25℃,CuSO4足量),一段时间后溶液的pH变为1,此时可观察到的现象是 ;若要使溶液恢复到起始浓度(温度不变,忽略溶液体积的变化),可向溶液中加入 (填物质名称),其质量约为 。
28.(10分)(1)2 C2H6(g) + 7 O2(g)=== 4 CO2(g)+ 6 H2O(l) △H = -3116.6 kJ/mol (2分)
(2)负 (1分);b (1分);(3)4OH- — 4 e- = O2↑+ 2H2O (2分)
石墨电极表面有气泡产生, 铁电极上附着一层红色物质,溶液颜色变浅 (2分)
氧化铜(或碳酸铜) (1分); 4g(或6.2g) (1分)
29、(10届上西城区)22.(6分)海水资源的利用具有非常广阔的前景。
(1)海水淡化的主要方法有(只写出1种即可) 。
(2)海水中丰富的氯化钠是重要的化工原料,如电解饱和食盐水可以制备多种化工产品。
①用石墨电极电解饱和食盐水时,阳极的电极反应式是 。
②常温下,用石墨电极电解饱和食盐水,当阴极产生的气体体积为112 mL(已折算为标准状况)时停止电解,此时溶液体积为1 L,若忽略气体的溶解,最终溶液的pH约为 。
29.(6分)(1)(2分)蒸馏法(或电渗析法 或离子交换法)
(2)①(2分)2Cl--2e-= Cl2↑ ②(2分)12
