人教版选修四第四章 电化学基础复习教案
文档属性
| 名称 | 人教版选修四第四章 电化学基础复习教案 |

|
|
| 格式 | rar | ||
| 文件大小 | 71.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2010-09-06 00:00:00 | ||
图片预览

文档简介
本资料来自于资源最齐全的21世纪教育网www.21cnjy.com
第4章 电化学基础复习教案
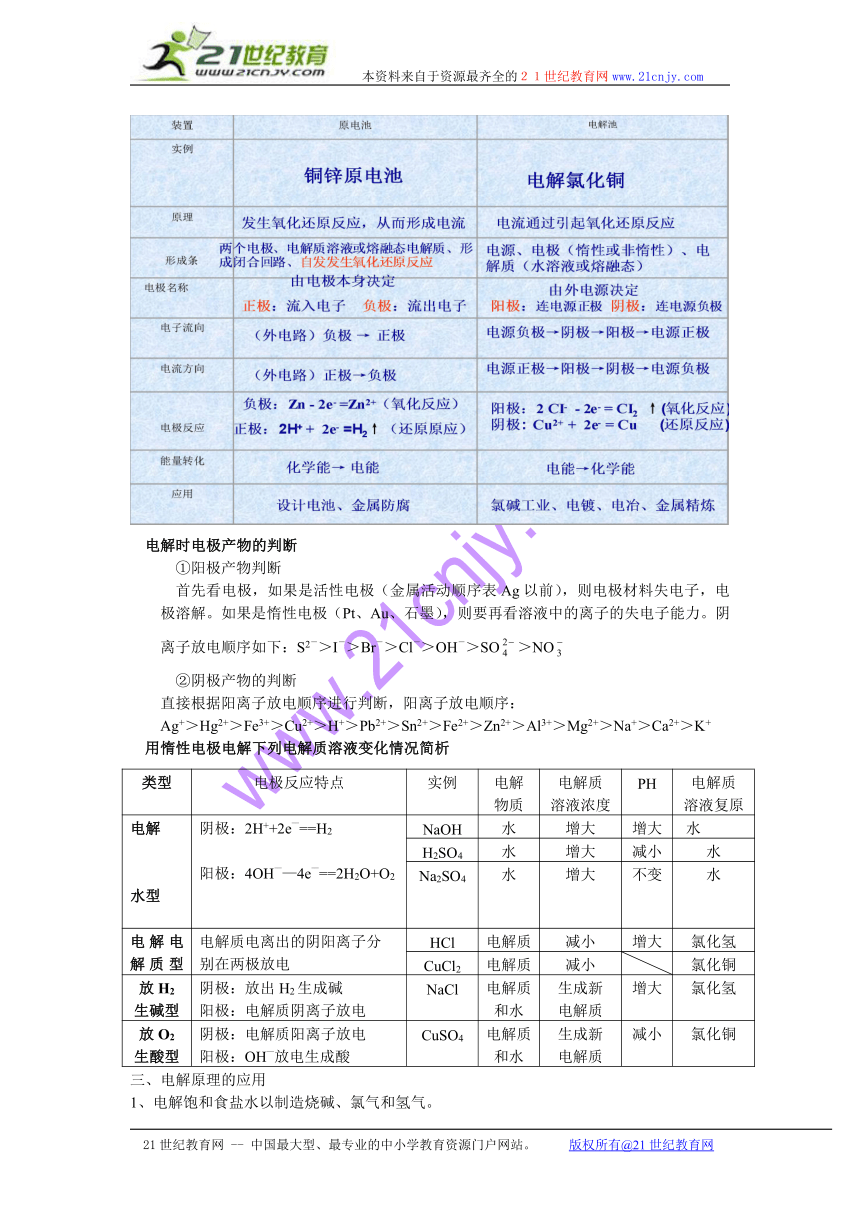
一、原电池
1、定义:把化学能转化为电能的装置
2、原电池的两极确定
失去电子的一极叫负极,用 - 表示。
得到电子的一极叫正极,用 + 表示。
电极反应
负极:(Zn ) Zn - 2e- = Zn2+ (氧化反应)
正极:(Cu) 2H++ 2e- = H2↑ (还原反应
总反应式:综合正极和负极电极反应式而得:
Zn+ 2H+ = Zn2+ + H2↑
4、原电池的形成条件
构成前提:两个电极中至少有一个可以和电解质溶液自发地发生氧化还原反应
1、活动性不同的金属(其中一种可以为
非金属,即作导体用)作电极。
2、两电极插入电解质溶液中。
3、形成闭合回路。(两电极外线用导线连接,可以接用电器。)
4常见电池
二电解池
电解池(电解槽):把电能转化为化学能的装置。
电解时电极产物的判断
①阳极产物判断
首先看电极,如果是活性电极(金属活动顺序表Ag以前),则电极材料失电子,电极溶解。如果是惰性电极(Pt、Au、石墨),则要再看溶液中的离子的失电子能力。阴离子放电顺序如下:S2->I->Br->Cl->OH->SO>NO
②阴极产物的判断
直接根据阳离子放电顺序进行判断,阳离子放电顺序:
Ag+>Hg2+>Fe3+>Cu2+>H+>Pb2+>Sn2+>Fe2+>Zn2+>Al3+>Mg2+>Na+>Ca2+>K+
用惰性电极电解下列电解质溶液变化情况简析
类型 电极反应特点 实例 电解物质 电解质溶液浓度 PH 电解质溶液复原
电解[来源:21世纪教育网]21世纪教育网水型[来源:21世纪教育网]21世纪教育网21世纪教育网 阴极:2H++2e—==H2[来源:21世纪教育网]阳极:4OH——4e—==2H2O+O2 NaOH 水 增大 增大 水21世纪教育网21世纪教育网
H2SO4 水 增大 减小 水
Na2SO4 水 增大 不变 水
电解电解质型 电解质电离出的阴阳离子分别在两极放电 HCl 电解质 减小 增大 氯化氢
CuCl2 电解质 减小 氯化铜
放H2生碱型 阴极:放出H2生成碱阳极:电解质阴离子放电 NaCl 电解质和水 生成新电解质 增大 氯化氢
放O2生酸型 阴极:电解质阳离子放电阳极:OH—放电生成酸 CuSO4 电解质和水 生成新电解质 减小 氯化铜
三、电解原理的应用
1、电解饱和食盐水以制造烧碱、氯气和氢气。
2、电镀
阳极:镀层金属
电镀液:含有镀层金属的电解质
阴极:待镀金属制品
3电镀应用于铜的电解精练
电极反应式
阴极(纯铜): Cu2+ + 2e- = Cu (还原反应)
阳极(粗铜): Cu - 2e- = Cu2+ (氧化反应)
4、电冶金
制取金属钠 :电解熔融状态的氯化钠。
2NaCl(熔融) 2Na + Cl2 ↑
二、金属的腐蚀和防护
金属腐蚀:金属(或合金)跟周围接触到的气体(或液体)反应而腐蚀损耗的过程。
金属腐蚀的本质:金属原子 金属阳离子
金属腐蚀类型:化学腐蚀和电化学腐蚀
化学腐蚀 电化腐蚀
条件 金属跟非金属单质直接接触 不纯金属或合金跟电解质溶液接触
现象 无电流产生 有微弱电流产生
本质 金属被氧化 较活泼金属被氧化
联系 两者往往同时发生,电化腐蚀更普遍
4.钢铁的析氢腐蚀和吸氧腐蚀比较
析氢腐蚀 吸氧腐蚀
条件 水膜呈酸性。 水膜呈中性或酸性很弱。
电极反应 负极Fe(-)正极C(+)总反应: Fe-2e=Fe2+2H++2e-=H2Fe + 2H+= Fe2+ H2↑ 2Fe-4e=2Fe2+O2+2H2O+4e=4OH-2Fe+2H2O+O2= 2 Fe(OH)24Fe(OH)2+2H2O+O2=4Fe(OH)3Fe2O3 · nH2O
通常两种腐蚀同时存在,但以后者更普遍。
二、金属的电化学保护
1、牺牲阳极保护法
2、外加电流阴极保护法
其它金属防腐蚀的方法:将金属制成合金,采用喷油漆,涂油脂,电镀,喷镀或表面钝化
21世纪教育网 -- 中国最大型、最专业的中小学教育资源门户网站。 版权所有@21世纪教育网
第4章 电化学基础复习教案
一、原电池
1、定义:把化学能转化为电能的装置
2、原电池的两极确定
失去电子的一极叫负极,用 - 表示。
得到电子的一极叫正极,用 + 表示。
电极反应
负极:(Zn ) Zn - 2e- = Zn2+ (氧化反应)
正极:(Cu) 2H++ 2e- = H2↑ (还原反应
总反应式:综合正极和负极电极反应式而得:
Zn+ 2H+ = Zn2+ + H2↑
4、原电池的形成条件
构成前提:两个电极中至少有一个可以和电解质溶液自发地发生氧化还原反应
1、活动性不同的金属(其中一种可以为
非金属,即作导体用)作电极。
2、两电极插入电解质溶液中。
3、形成闭合回路。(两电极外线用导线连接,可以接用电器。)
4常见电池
二电解池
电解池(电解槽):把电能转化为化学能的装置。
电解时电极产物的判断
①阳极产物判断
首先看电极,如果是活性电极(金属活动顺序表Ag以前),则电极材料失电子,电极溶解。如果是惰性电极(Pt、Au、石墨),则要再看溶液中的离子的失电子能力。阴离子放电顺序如下:S2->I->Br->Cl->OH->SO>NO
②阴极产物的判断
直接根据阳离子放电顺序进行判断,阳离子放电顺序:
Ag+>Hg2+>Fe3+>Cu2+>H+>Pb2+>Sn2+>Fe2+>Zn2+>Al3+>Mg2+>Na+>Ca2+>K+
用惰性电极电解下列电解质溶液变化情况简析
类型 电极反应特点 实例 电解物质 电解质溶液浓度 PH 电解质溶液复原
电解[来源:21世纪教育网]21世纪教育网水型[来源:21世纪教育网]21世纪教育网21世纪教育网 阴极:2H++2e—==H2[来源:21世纪教育网]阳极:4OH——4e—==2H2O+O2 NaOH 水 增大 增大 水21世纪教育网21世纪教育网
H2SO4 水 增大 减小 水
Na2SO4 水 增大 不变 水
电解电解质型 电解质电离出的阴阳离子分别在两极放电 HCl 电解质 减小 增大 氯化氢
CuCl2 电解质 减小 氯化铜
放H2生碱型 阴极:放出H2生成碱阳极:电解质阴离子放电 NaCl 电解质和水 生成新电解质 增大 氯化氢
放O2生酸型 阴极:电解质阳离子放电阳极:OH—放电生成酸 CuSO4 电解质和水 生成新电解质 减小 氯化铜
三、电解原理的应用
1、电解饱和食盐水以制造烧碱、氯气和氢气。
2、电镀
阳极:镀层金属
电镀液:含有镀层金属的电解质
阴极:待镀金属制品
3电镀应用于铜的电解精练
电极反应式
阴极(纯铜): Cu2+ + 2e- = Cu (还原反应)
阳极(粗铜): Cu - 2e- = Cu2+ (氧化反应)
4、电冶金
制取金属钠 :电解熔融状态的氯化钠。
2NaCl(熔融) 2Na + Cl2 ↑
二、金属的腐蚀和防护
金属腐蚀:金属(或合金)跟周围接触到的气体(或液体)反应而腐蚀损耗的过程。
金属腐蚀的本质:金属原子 金属阳离子
金属腐蚀类型:化学腐蚀和电化学腐蚀
化学腐蚀 电化腐蚀
条件 金属跟非金属单质直接接触 不纯金属或合金跟电解质溶液接触
现象 无电流产生 有微弱电流产生
本质 金属被氧化 较活泼金属被氧化
联系 两者往往同时发生,电化腐蚀更普遍
4.钢铁的析氢腐蚀和吸氧腐蚀比较
析氢腐蚀 吸氧腐蚀
条件 水膜呈酸性。 水膜呈中性或酸性很弱。
电极反应 负极Fe(-)正极C(+)总反应: Fe-2e=Fe2+2H++2e-=H2Fe + 2H+= Fe2+ H2↑ 2Fe-4e=2Fe2+O2+2H2O+4e=4OH-2Fe+2H2O+O2= 2 Fe(OH)24Fe(OH)2+2H2O+O2=4Fe(OH)3Fe2O3 · nH2O
通常两种腐蚀同时存在,但以后者更普遍。
二、金属的电化学保护
1、牺牲阳极保护法
2、外加电流阴极保护法
其它金属防腐蚀的方法:将金属制成合金,采用喷油漆,涂油脂,电镀,喷镀或表面钝化
21世纪教育网 -- 中国最大型、最专业的中小学教育资源门户网站。 版权所有@21世纪教育网
