气体摩尔体积
图片预览










文档简介
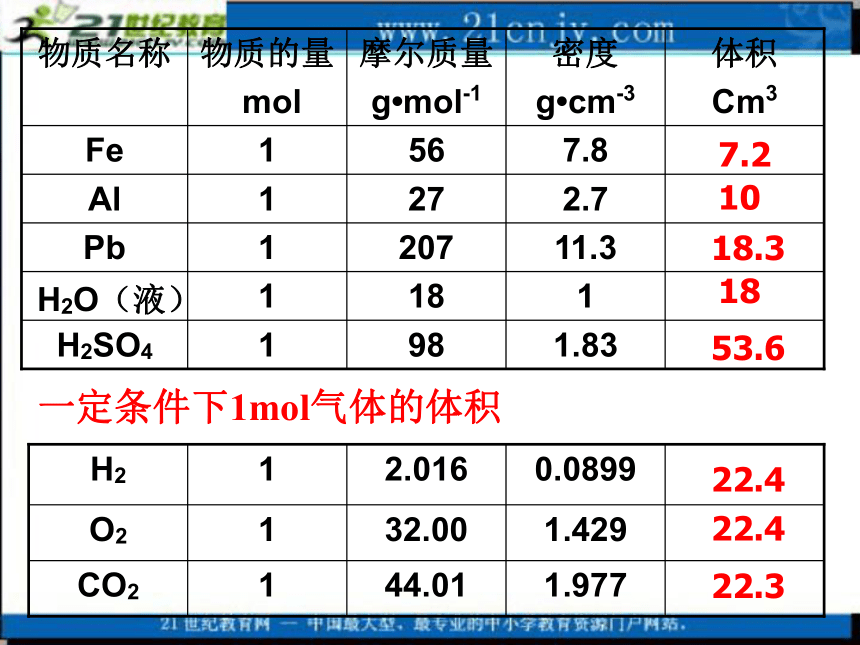
课件34张PPT。气体摩尔体积濮阳市油田第三高级中学 孙宪群复习:2、1mol任何物质的质量,我们可以通过摩尔质量求出,若要通过质量求体积 还要知道什么? 密度,V=m/ρ3、下面就请同学们计算填表:(气体是指相同状况下)科学探究:1、见书本第13页第1题1.83981H2SO41181H2O(液)11.32071Pb2.7271Al7.8561Fe体积
Cm3密度
g?cm-3摩尔质量
g?mol-1物质的量
mol物质名称7.21018.31853.61.97744.011CO21.42932.001O20.08992.0161H222.422.422.3一定条件下1mol气体的体积分析上述两表,得出什么结论?1、1mol不同的固态或液态物质,体积不同。
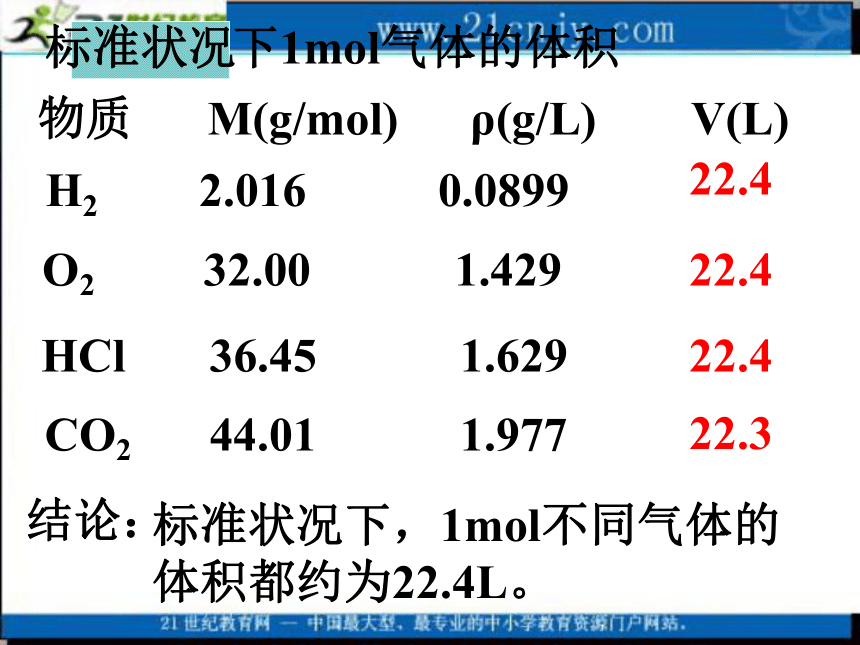
2、在相同状态下,1mol气体的体积基本相同。那么不同状态的物质,体积大小跟哪些因素有关呢?粒子数目粒子大小粒子间距现在我们讨论1mol物质的体积,也就是粒子数是6.02?1023。固、液体6.02?1023 6.02?1023?1、对于固、液体,粒子间距很小,粒子的大小是决定物质体积大小的主要因素。在固态和液态中粒子本身的大小不同,决定了其体积不同。所以,1mol固体、液体的体积主要决定于原子、分子、离子的大小。2、对于气体,粒子间距较大,决定物质体积大小的主要因素是粒子间的距离。而不同的气体在一定温度和压强下,分子间的距离可以看作是相等的,所以1mol任何气体的体积基本相同忽略?气体忽略温度、压强对气体体积的影响:温度越高气体体积越大压强越小分子间距离增大实 质0oC、101kPa标准状况需在相同温度、压强下比较气体体积(标况)( S. T. P)常温常压通常状况某条件下1mol气体的体积 22.422.322.422.4物质 M(g/mol) ρ(g/L) V(L)标准状况下,1mol不同气体的
体积都约为22.4L。结论:H2 2.016 0.0899 CO2 44.01 1.977O2 32.00 1.429HCl 36.45 1.629标准状况二、气体摩尔体积1、定义:单位物质的量的气体所占的体积Vm4、表达式:思考与交流1、3.01×1023个CO2分子的质量是多少g?2、决定物质体积的因素有哪些?3、为什么在相同状况下,1mol不同气体的体积却相同?4、在通常状况下,1mol任何气体的体积都约为22.4L,对吗?物质
质量物质
的量微粒
数÷M×M×NA÷NA×22.4L/mol÷22.4L/mol[小结](标准状况)气体体积几点注意:1、状态:气体
2、状况:一定温度和压强下,一般指标准状况
3、气体体积与微粒数目有关,与种类无关。
4、结论:在标准状况下,1mol任何气体所占的体积都约为22 .4L。5、有关计算:(标准状况下)
V=n×22.4L/mol(n---气体的物质的量) 下列说法是否正确?
(1)1摩尔氢气的体积约为22.4L
(2)标准状况下,1摩尔水的体积约22.4升。
(3)20oC时, 1摩尔氧气的体积约22.4升。
(4)2×105Pa时,1摩尔氮气的体积小于22.4升。练习:讨论20 ℃,101kPa时,气体摩尔体积与标准状况时相比大还是小?只有在标况时Vm=22.4L·mol-1吗?填写下列表格(标准状况)1、下列说法中,正确的是( )
A、1mol某气体的体积是22.4L,该气体所处的状况不一定是标准状况.
B、非标准状况下,1molO2的体积必定不是22.4L
C、某物质含有阿伏加德罗常数个微粒,该物质在标准状况下的体积为22.4L
D、标准状况下,1molH2和O2的混合气体的体积不一定为22.4L练习:A[练习]下列说法正确的是( )
(A)在标准状况下,1mol水和1molH2的体积都约是22.4L
(B)常温常压下2gH2和44gCO2的体积相等,并大于22.4L
(C)气体的摩尔体积是22.4L/mol
(D)在标准状况下,1gH2和11.2LO2的物质的量相等[答案] (BD)
友情提醒:涉及到气体的体积或密度时,要看条件和状态!
即是不是气体?在相同条件下还是标准状态下,还是未交待? 2、标准状况下:
(1)44.8升氢气的物质的量是多少?
(2)0.5摩尔氧气的体积是多少?
(3)14克CO的体积是多少?
(4)33.6升氮气中含多少个氮分子?3、在标准状况下,0.2L容器里所含某气体的质量为0.25g,求该气体的相对分子质量?[讨论] 在一定温度和压强下,并不一定是标准状况,1mol不同的气体体积是否相同?在同温同压下,相同分子数的气体,其体积( );相同这是阿伏加德罗定律(也称“四同定律”或“三同定一同”)则:气体摩尔体积22.4L/mol是阿伏加德罗定律的特例。 在同温同压下,体积相同的气体,其分子数( ) ;在同温同压下,气体体积的大小与分子数目成( )比。相同正[练习1] 在相同状况下,两种物质的量相同的气体必然
A、体积均为22.4 L/mol B、具有相同的体积
C、具有相同的原子数目 D、具有相同的质量[答案] B[练习2] 在同温同压下,相同质量的下列气体,占有的体积由大到小的顺序是——①Cl2 ②N2 ③H2 ④CO2 ⑤O2[答案] ③>②>⑤>④>①[练习3] 在同温同压下,某容器充满O2重116g,若充满CO2重122g,现充满某气体X重114g,则该气体的相对分子质量可能是
A、28 B、44 C、32 D、60[练习3] 在同温同压下,某容器充满O2重116g,若充满CO2重122g,现充满某气体X重114g,则该气体的相对分子质量可能是
A、28 B、44 C、32 D、60[解题技巧]
法一:普通法
设瓶重mg,该气体摩尔质量为Mx,因容积不变,
nO2=nCO2=nX=(116-m)/32=(122-m)/44=(114-m)/Mx
法二:差量法
nO2=nCO2=nX=(116-114)/(32-Mx)=(122-116)/(44-32)
法三:估算法:
因物质的量相同,m与M成正比。Mx<32 选A克拉珀龙方程:
(理想气体的气态方程)
P V = n R T
*
标准状态下:
1.01?105Pa ?22.4L=1mol ?R ?273K
则常量R=8.314 Pa·m3·mol-1·K-1
知三求一!三、阿伏加德罗定律的推论 依据:PV=nRT 或 PV=
“二同”推导出“一比例”
1. 同温同压下,气体体积之比等于物质的量之比T、P相同:同温同压下,任何气体密度比等于式量之比T、P相同: 三、阿伏加德罗定律的推论 依据:PV=nRT 或 PV=
T、P、V相同: 3. 同温同压下,同体积任何气体的质量比等于式量之比三、阿伏加德罗定律的推论 依据:PV=nRT 或 PV=
同温同体积下,气体的压强之比等于物质的量之比T、V相同:三、阿伏加德罗定律的推论 依据:PV=nRT 或 PV=
同温同压下,相同质量的任何气体的体积与其式量成反比T、P、m相同 :三、阿伏加德罗定律的推论 依据:PV=nRT 或 PV=
( 请自行推导!)练:同温同压下,将1体积的CO2和2体积的CO进行比较,则CO2与CO的: (1)分子数之比为 ; (2)原子数之比为 ; (3)质量之比为 ___________;
(4)物质的量之比为——————;
(5)密度之比为 ___________;
(6)摩尔质量之比为——————;1:23:411:141:211:711:7固体物质液体物质构成固态结构微粒间的距离很小构成液态结构微粒间的距离也小所以,固体和液体是很难被压缩的。气体分子间距离很大分子平均距离是分子直径的10倍左右所以气体很容易被压缩
Cm3密度
g?cm-3摩尔质量
g?mol-1物质的量
mol物质名称7.21018.31853.61.97744.011CO21.42932.001O20.08992.0161H222.422.422.3一定条件下1mol气体的体积分析上述两表,得出什么结论?1、1mol不同的固态或液态物质,体积不同。
2、在相同状态下,1mol气体的体积基本相同。那么不同状态的物质,体积大小跟哪些因素有关呢?粒子数目粒子大小粒子间距现在我们讨论1mol物质的体积,也就是粒子数是6.02?1023。固、液体6.02?1023 6.02?1023?1、对于固、液体,粒子间距很小,粒子的大小是决定物质体积大小的主要因素。在固态和液态中粒子本身的大小不同,决定了其体积不同。所以,1mol固体、液体的体积主要决定于原子、分子、离子的大小。2、对于气体,粒子间距较大,决定物质体积大小的主要因素是粒子间的距离。而不同的气体在一定温度和压强下,分子间的距离可以看作是相等的,所以1mol任何气体的体积基本相同忽略?气体忽略温度、压强对气体体积的影响:温度越高气体体积越大压强越小分子间距离增大实 质0oC、101kPa标准状况需在相同温度、压强下比较气体体积(标况)( S. T. P)常温常压通常状况某条件下1mol气体的体积 22.422.322.422.4物质 M(g/mol) ρ(g/L) V(L)标准状况下,1mol不同气体的
体积都约为22.4L。结论:H2 2.016 0.0899 CO2 44.01 1.977O2 32.00 1.429HCl 36.45 1.629标准状况二、气体摩尔体积1、定义:单位物质的量的气体所占的体积Vm4、表达式:思考与交流1、3.01×1023个CO2分子的质量是多少g?2、决定物质体积的因素有哪些?3、为什么在相同状况下,1mol不同气体的体积却相同?4、在通常状况下,1mol任何气体的体积都约为22.4L,对吗?物质
质量物质
的量微粒
数÷M×M×NA÷NA×22.4L/mol÷22.4L/mol[小结](标准状况)气体体积几点注意:1、状态:气体
2、状况:一定温度和压强下,一般指标准状况
3、气体体积与微粒数目有关,与种类无关。
4、结论:在标准状况下,1mol任何气体所占的体积都约为22 .4L。5、有关计算:(标准状况下)
V=n×22.4L/mol(n---气体的物质的量) 下列说法是否正确?
(1)1摩尔氢气的体积约为22.4L
(2)标准状况下,1摩尔水的体积约22.4升。
(3)20oC时, 1摩尔氧气的体积约22.4升。
(4)2×105Pa时,1摩尔氮气的体积小于22.4升。练习:讨论20 ℃,101kPa时,气体摩尔体积与标准状况时相比大还是小?只有在标况时Vm=22.4L·mol-1吗?填写下列表格(标准状况)1、下列说法中,正确的是( )
A、1mol某气体的体积是22.4L,该气体所处的状况不一定是标准状况.
B、非标准状况下,1molO2的体积必定不是22.4L
C、某物质含有阿伏加德罗常数个微粒,该物质在标准状况下的体积为22.4L
D、标准状况下,1molH2和O2的混合气体的体积不一定为22.4L练习:A[练习]下列说法正确的是( )
(A)在标准状况下,1mol水和1molH2的体积都约是22.4L
(B)常温常压下2gH2和44gCO2的体积相等,并大于22.4L
(C)气体的摩尔体积是22.4L/mol
(D)在标准状况下,1gH2和11.2LO2的物质的量相等[答案] (BD)
友情提醒:涉及到气体的体积或密度时,要看条件和状态!
即是不是气体?在相同条件下还是标准状态下,还是未交待? 2、标准状况下:
(1)44.8升氢气的物质的量是多少?
(2)0.5摩尔氧气的体积是多少?
(3)14克CO的体积是多少?
(4)33.6升氮气中含多少个氮分子?3、在标准状况下,0.2L容器里所含某气体的质量为0.25g,求该气体的相对分子质量?[讨论] 在一定温度和压强下,并不一定是标准状况,1mol不同的气体体积是否相同?在同温同压下,相同分子数的气体,其体积( );相同这是阿伏加德罗定律(也称“四同定律”或“三同定一同”)则:气体摩尔体积22.4L/mol是阿伏加德罗定律的特例。 在同温同压下,体积相同的气体,其分子数( ) ;在同温同压下,气体体积的大小与分子数目成( )比。相同正[练习1] 在相同状况下,两种物质的量相同的气体必然
A、体积均为22.4 L/mol B、具有相同的体积
C、具有相同的原子数目 D、具有相同的质量[答案] B[练习2] 在同温同压下,相同质量的下列气体,占有的体积由大到小的顺序是——①Cl2 ②N2 ③H2 ④CO2 ⑤O2[答案] ③>②>⑤>④>①[练习3] 在同温同压下,某容器充满O2重116g,若充满CO2重122g,现充满某气体X重114g,则该气体的相对分子质量可能是
A、28 B、44 C、32 D、60[练习3] 在同温同压下,某容器充满O2重116g,若充满CO2重122g,现充满某气体X重114g,则该气体的相对分子质量可能是
A、28 B、44 C、32 D、60[解题技巧]
法一:普通法
设瓶重mg,该气体摩尔质量为Mx,因容积不变,
nO2=nCO2=nX=(116-m)/32=(122-m)/44=(114-m)/Mx
法二:差量法
nO2=nCO2=nX=(116-114)/(32-Mx)=(122-116)/(44-32)
法三:估算法:
因物质的量相同,m与M成正比。Mx<32 选A克拉珀龙方程:
(理想气体的气态方程)
P V = n R T
*
标准状态下:
1.01?105Pa ?22.4L=1mol ?R ?273K
则常量R=8.314 Pa·m3·mol-1·K-1
知三求一!三、阿伏加德罗定律的推论 依据:PV=nRT 或 PV=
“二同”推导出“一比例”
1. 同温同压下,气体体积之比等于物质的量之比T、P相同:同温同压下,任何气体密度比等于式量之比T、P相同: 三、阿伏加德罗定律的推论 依据:PV=nRT 或 PV=
T、P、V相同: 3. 同温同压下,同体积任何气体的质量比等于式量之比三、阿伏加德罗定律的推论 依据:PV=nRT 或 PV=
同温同体积下,气体的压强之比等于物质的量之比T、V相同:三、阿伏加德罗定律的推论 依据:PV=nRT 或 PV=
同温同压下,相同质量的任何气体的体积与其式量成反比T、P、m相同 :三、阿伏加德罗定律的推论 依据:PV=nRT 或 PV=
( 请自行推导!)练:同温同压下,将1体积的CO2和2体积的CO进行比较,则CO2与CO的: (1)分子数之比为 ; (2)原子数之比为 ; (3)质量之比为 ___________;
(4)物质的量之比为——————;
(5)密度之比为 ___________;
(6)摩尔质量之比为——————;1:23:411:141:211:711:7固体物质液体物质构成固态结构微粒间的距离很小构成液态结构微粒间的距离也小所以,固体和液体是很难被压缩的。气体分子间距离很大分子平均距离是分子直径的10倍左右所以气体很容易被压缩
