第二节 燃烧热能源(上课)
图片预览











文档简介
课件33张PPT。 第二节
燃烧热 能源桃源九中朱高林高二新授课课件1. 写出下列反应的热化学方程式(常温常压条件)1) 1molN2与适量O2反应生成NO2,吸收68kJ的热量课堂练习2) 1molCu与适量O2反应生成CuO(s),放出157kJ热量;N2(g)+2O2(g)==2NO2(g) △H=+68 kJ/mol2Cu(s)+ O2(g)== 2CuO(s) △H=-314 kJ/mol2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l)
△H=-4b kJ/mol
B. C2H2(g)+5/2O2(g)=2CO2(g)+H2O(l)
△H=+2b kJ/mol
C. 2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l)
△H=-2b kJ/mol
D. 2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l)
△H=+b kJ/mol2. 已知充分燃烧a g 乙炔(C2H2) 气体时生成 1 mol二氧
化碳气体和液态水,并放出热量b kJ,则乙炔燃烧的
热化学方程式正确的是( )A课堂练习3. 根据下面事实,写出热化学方程式。
实验测得在25℃、101kPa时,1molCH4完全燃烧放出890.31kJ的热量。CH4(g)+2O2 (g) =CO2 (g) +2H2O (l)
ΔH= - 890.31kJ/mol燃烧热、中和热、溶解热等都属于特殊条件下的反应热。 一、燃烧热:注意点2:2C8H18(l)+ 25O2(g)=16CO2+18H2O(l) △H=-11036KJ/mol思考:C8H18的燃烧热为多少? 在25℃、101KPa时,1mol纯物质完全燃烧生成稳定的氧化物时所放出的热量叫该物质的燃烧热。△H=-5518KJ/mol注意点1:C→CO2(g),H→H2O(l),S→SO2(g)1、定义:研究的条件燃烧物的量反应程度反应程度单位一般用kJ/mol 2、表示的意义: 如:CH4的燃烧热为890.3KJ/mol,
含义: 在101KPa时, 1molCH4完全燃烧时,放出
890.3KJ的热量。 3、燃烧热的热化学方程式的书写: 应以1mol物质的标准来配平其余物质的化学
计量数(常出现分数) H2(g)+1/2O2(g)=H2O(l) ΔH=-285.8 kJ/mol1、已知:
2H2(g)+O2(g)=2H2O(l),△H=-571.6KJ/mol
2H2(g)+O2(g)=2H2O(g),△H=-483.6KJ/mol
则氢气的燃烧热为( )
A.571.6KJ/mol B.483.6KJ/mol
C.285.8KJ/mol D.241.8KJ/mol C[练习]2、分析以下几个热化学方程式,哪两个分别是表示固
态碳和气态氢气燃烧时的燃烧热的?为什么?
A.C(s)+O2(g)=CO (g) ΔH=-110.5 kJ/mol
B.C(s)+O2(g)=CO2(g) ΔH=-393.5 kJ/mol
C. H2(g)+1/2O2(g)=H2O(l)ΔH=-285.8 kJ/mol
D.H2(g)+O2(g)=H2O(g) ΔH=-241.8 kJ/mol
C. H2(g)+1/2O2(g)=H2O(l)ΔH=-285.8 kJ/molB.C(s)+O2(g)=CO2(g) ΔH=-393.5 kJ/mol3、0.3mol的气态高能燃料乙炔(C2H2)
在氧气中完全燃烧,生成气态CO2和液态
水,放出389.88kJ热量,其热化学方程式
为 ;
其燃烧热为 。
表示燃烧热的热化学方程式为_________
___________________________________。 2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l) △H=-2599.2kJ/mol
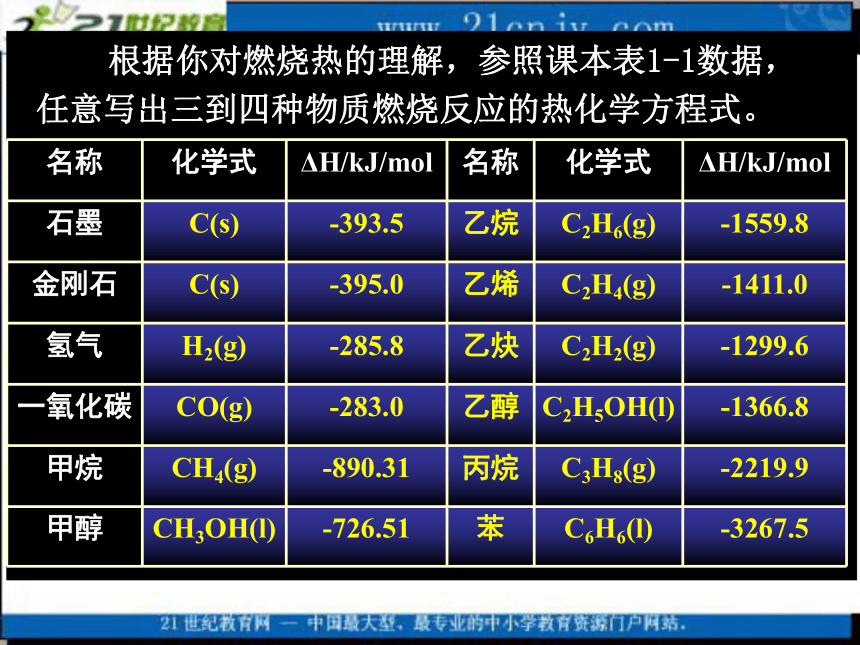
1299.6kJ/molC2H2(g)+5/2O2(g)=2CO2(g)+H2O(l) △H=-1299.6kJ/mol 根据你对燃烧热的理解,参照课本表1-1数据,
任意写出三到四种物质燃烧反应的热化学方程式。4、可燃物完全燃烧时放出的热量Q放=n(可燃物) ×△H5、燃烧热的计算及应用[例题1]在101kPa时,1molCH4完全燃烧生成CO2和液态H2O,放出890.3 kJ的热量,CH4的燃烧热为多少?1000 L CH4(标准状况)燃烧后所产生的热量为多少?
解:(1)根据题意,在101 kPa时,1 molCH4完全燃烧的热化学方程式为:
CH4(g)+2O2(g)==CO2(g)+2H2O(l) ΔH =-890.3 kJ/mol
即CH4的燃烧热为890.3 kJ/mol。1mol CH4完全燃烧放出890.3kJ的热量,44.6 molCH4完全燃烧
放出的热量为:
44.6 mol×890.3kJ/mol=3.97×104kJ[例题1]在101kPa时,1molCH4完全燃烧生成CO2和液态H2O,放出890.3 kJ的热量,CH4的燃烧热为多少?1000 LCH4(标准状况)燃烧后所产生的热量为多少? 【例题2】葡萄糖是人体所需能量的重要来源之一。葡萄糖燃烧的热化学方程式为:
C6H12O6(s)+6O2(g)== 6CO2(g)+6H2O(l)
ΔH =-2 800 kJ/mol 葡萄糖在人体组织中氧化的热化学方程式与它燃烧的热化学方程式相同。计算100 g葡萄糖在人体中完全氧化时所产生的热量。解析:根据题意,葡萄糖的燃烧热为2800kJ/mol
100g葡萄糖的物质的量为:n(C6H12O6)==0.556mol
1molC6H12O6完全燃烧放出2800 kJ的热量,0.556 molC6H12O6完全燃烧放出的热量为:
0.556mol×2800 kJ/mol=1557kJ
答案:100g葡萄糖在人体中完全氧化时产生1557 kJ的热量。
若2.6g乙炔(C2H2,气态)完全燃烧生成液态水和CO2(g)时放热130kJ。则乙炔燃烧的热化学方程式为 C2H2(g)+ O2(g)= 2CO2(g)+H2O(l)ΔH=-1300 kJ/mol2C2H2(g)+5O2(g)= 4CO2(g)+2H2O(l) ΔH=-2600 kJ/mol练习应根据什么标准来选择燃料?举例说明。提示:可从物质的燃烧热、燃料的储量、
开采、运输、储存的条件、价格、对生态
环境的影响等各方面综合考虑。思考与交流二、能源阅读P8-P9,小组内展开讨论,弄清楚以下问题
什么是能源?可从能源的储量、在世界所占地位、
能源总消费与人均消费情况等方面
讨论我国目前的能源状况如何? 解决能源危机有哪些办法?能
源 ①化石燃料——煤、石油、天然气②阳光、风力、流水、潮汐、地热…③柴草二、能源1、能源能提供能量的资源定义:分类地位:是国民经济和社会发展的重要物质基础2、我国目前的能源状况(1)主要能源是化石燃料(2)化石燃料的特点蕴藏量有限不能再生污染严重最终将会枯竭(3)能源利用率低3、解决能源危机的方法(1)科学地控制燃烧反应,使燃料充分燃烧,提高能源的使用效率是节约能源的重要措施。(2)寻找新能源,现正在探索的新能源有太阳能、氢能、风能、地热能、海洋能和生物质能等。它们资源丰富,可以再生,没有污染或很少污染,是未来的主要能源。中和热桃源九中朱高林高二新授课课件1、概念:
在稀溶液中,酸与碱发生中和反应生1molH2O所放出的热量叫中和热。 若是强酸、强碱其中和热均为57.3KJ/mol。
这是因为强酸与强碱发生中和反应的实质是:
H+ +OH― ═H2O 三、中和热:注意:强酸与弱碱、强碱与弱酸、弱酸与弱碱反应的中和热均小于57.3KJ/mol。(是因为弱酸、弱碱的电离是吸热的)中和热是否就是酸、碱发生中和反应的反应热呢? 如:1mol/LHNO3 与1mol/LNaOH发生中和反应生成1molH2O。
放出的热量为57.3KJ。 一定要“稀溶液”
(这是因为浓溶液中离子之间
存在较强的牵制作用) H+(aq)+OH-(aq)=H2O (1) △H=-57.3kJ/mol
2、中和热的表示:例1、写出下列反应的热化学方程式:
实验测得:(1)1 L 1 mol/L 稀盐酸跟1 L 1 mol/L NaOH溶液起中和反应放出57.3 kJ热量。
(2)1 L 1 mol/L KOH 溶液中和1 L 1 mol/L HNO3溶液,放出57.3 kJ的热量。
(3)1 L 1 mol/L H2SO4溶液与2 L 1 mol/L NaOH 溶液完全反应,放出114.6 kJ的热量。(1)NaOH(aq)+HCl(aq)==NaCl(aq)+H2O(l);
ΔH=-57.3 kJ/mol
(2)KOH(aq)+HNO3(aq)==KNO3(aq)+H2O(l)
ΔH=-57.3 kJ/mol
(3)2NaOH(aq)+H2SO4(aq)==Na2SO4(aq)+2H2O(l)
ΔH=-114.6 kJ/mol[设问]第(1)个反应的反应热是多少?中和热是多少?第(2)个反应呢?第(3)反应的情况又怎样呢? [答]反应①②的反应热和中和热均为57.3 kJ/mol反应③的反应热为114.6 kJ/mol,中和热为57.3 kJ/mol为什么它的反应热与中和热不同呢?因为中和热要求反应生成的H2O为1 mol,而反应(3)生成H2O为2 mol,故其中和热应为反应热的二分之一。例2、已知H+(aq)+OH-(aq)=H2O(l); ?H= -57.3kJ/mol ,求下列中和反应中放出的热量。
(1)用20gNaOH配稀溶液跟足量稀盐酸反应放出____________ kJ的热量。
(2)用28gKOH配稀溶液跟足量稀硝酸反应,放出____________kJ的热量。
28.728.73、理解要点
①研究条件:稀溶液
②反应物:酸与碱
③生成物及其物质的量:1molH2O
④放出热量:ΔH<0 单位:kJ/mol 在书写物质在溶液中发生化学反应的方程式时,我们常用aq来表示稀溶液,稀溶液是指溶于大量水的离子。中和热不包括离子在水溶液中的生成热、物质的溶解热、电解质电离的吸热所伴随的热效应。小结:燃烧热和中和热的比较
下列各对酸与碱的中和热大于 57.3KJ/mol的是 ,小于 57.3KJ/mol的是 ,等于 57.3KJ/mol的是 。
(填序号)
A.盐酸与氢氧化钾 B.氨水与盐酸
C. 醋酸与氢氧化钠 D.硫酸与氢氧化钡 [练习]DBCA一、燃烧热
概念:
表示意义:
书写热化学方程式:
燃烧热的计算:
二、中和热
概念:
中和热的表示:溶液(aq)
中和热测定实验的注意事项
Q放=n(可燃物)ⅹ△H小结
燃烧热 能源桃源九中朱高林高二新授课课件1. 写出下列反应的热化学方程式(常温常压条件)1) 1molN2与适量O2反应生成NO2,吸收68kJ的热量课堂练习2) 1molCu与适量O2反应生成CuO(s),放出157kJ热量;N2(g)+2O2(g)==2NO2(g) △H=+68 kJ/mol2Cu(s)+ O2(g)== 2CuO(s) △H=-314 kJ/mol2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l)
△H=-4b kJ/mol
B. C2H2(g)+5/2O2(g)=2CO2(g)+H2O(l)
△H=+2b kJ/mol
C. 2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l)
△H=-2b kJ/mol
D. 2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l)
△H=+b kJ/mol2. 已知充分燃烧a g 乙炔(C2H2) 气体时生成 1 mol二氧
化碳气体和液态水,并放出热量b kJ,则乙炔燃烧的
热化学方程式正确的是( )A课堂练习3. 根据下面事实,写出热化学方程式。
实验测得在25℃、101kPa时,1molCH4完全燃烧放出890.31kJ的热量。CH4(g)+2O2 (g) =CO2 (g) +2H2O (l)
ΔH= - 890.31kJ/mol燃烧热、中和热、溶解热等都属于特殊条件下的反应热。 一、燃烧热:注意点2:2C8H18(l)+ 25O2(g)=16CO2+18H2O(l) △H=-11036KJ/mol思考:C8H18的燃烧热为多少? 在25℃、101KPa时,1mol纯物质完全燃烧生成稳定的氧化物时所放出的热量叫该物质的燃烧热。△H=-5518KJ/mol注意点1:C→CO2(g),H→H2O(l),S→SO2(g)1、定义:研究的条件燃烧物的量反应程度反应程度单位一般用kJ/mol 2、表示的意义: 如:CH4的燃烧热为890.3KJ/mol,
含义: 在101KPa时, 1molCH4完全燃烧时,放出
890.3KJ的热量。 3、燃烧热的热化学方程式的书写: 应以1mol物质的标准来配平其余物质的化学
计量数(常出现分数) H2(g)+1/2O2(g)=H2O(l) ΔH=-285.8 kJ/mol1、已知:
2H2(g)+O2(g)=2H2O(l),△H=-571.6KJ/mol
2H2(g)+O2(g)=2H2O(g),△H=-483.6KJ/mol
则氢气的燃烧热为( )
A.571.6KJ/mol B.483.6KJ/mol
C.285.8KJ/mol D.241.8KJ/mol C[练习]2、分析以下几个热化学方程式,哪两个分别是表示固
态碳和气态氢气燃烧时的燃烧热的?为什么?
A.C(s)+O2(g)=CO (g) ΔH=-110.5 kJ/mol
B.C(s)+O2(g)=CO2(g) ΔH=-393.5 kJ/mol
C. H2(g)+1/2O2(g)=H2O(l)ΔH=-285.8 kJ/mol
D.H2(g)+O2(g)=H2O(g) ΔH=-241.8 kJ/mol
C. H2(g)+1/2O2(g)=H2O(l)ΔH=-285.8 kJ/molB.C(s)+O2(g)=CO2(g) ΔH=-393.5 kJ/mol3、0.3mol的气态高能燃料乙炔(C2H2)
在氧气中完全燃烧,生成气态CO2和液态
水,放出389.88kJ热量,其热化学方程式
为 ;
其燃烧热为 。
表示燃烧热的热化学方程式为_________
___________________________________。 2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l) △H=-2599.2kJ/mol
1299.6kJ/molC2H2(g)+5/2O2(g)=2CO2(g)+H2O(l) △H=-1299.6kJ/mol 根据你对燃烧热的理解,参照课本表1-1数据,
任意写出三到四种物质燃烧反应的热化学方程式。4、可燃物完全燃烧时放出的热量Q放=n(可燃物) ×△H5、燃烧热的计算及应用[例题1]在101kPa时,1molCH4完全燃烧生成CO2和液态H2O,放出890.3 kJ的热量,CH4的燃烧热为多少?1000 L CH4(标准状况)燃烧后所产生的热量为多少?
解:(1)根据题意,在101 kPa时,1 molCH4完全燃烧的热化学方程式为:
CH4(g)+2O2(g)==CO2(g)+2H2O(l) ΔH =-890.3 kJ/mol
即CH4的燃烧热为890.3 kJ/mol。1mol CH4完全燃烧放出890.3kJ的热量,44.6 molCH4完全燃烧
放出的热量为:
44.6 mol×890.3kJ/mol=3.97×104kJ[例题1]在101kPa时,1molCH4完全燃烧生成CO2和液态H2O,放出890.3 kJ的热量,CH4的燃烧热为多少?1000 LCH4(标准状况)燃烧后所产生的热量为多少? 【例题2】葡萄糖是人体所需能量的重要来源之一。葡萄糖燃烧的热化学方程式为:
C6H12O6(s)+6O2(g)== 6CO2(g)+6H2O(l)
ΔH =-2 800 kJ/mol 葡萄糖在人体组织中氧化的热化学方程式与它燃烧的热化学方程式相同。计算100 g葡萄糖在人体中完全氧化时所产生的热量。解析:根据题意,葡萄糖的燃烧热为2800kJ/mol
100g葡萄糖的物质的量为:n(C6H12O6)==0.556mol
1molC6H12O6完全燃烧放出2800 kJ的热量,0.556 molC6H12O6完全燃烧放出的热量为:
0.556mol×2800 kJ/mol=1557kJ
答案:100g葡萄糖在人体中完全氧化时产生1557 kJ的热量。
若2.6g乙炔(C2H2,气态)完全燃烧生成液态水和CO2(g)时放热130kJ。则乙炔燃烧的热化学方程式为 C2H2(g)+ O2(g)= 2CO2(g)+H2O(l)ΔH=-1300 kJ/mol2C2H2(g)+5O2(g)= 4CO2(g)+2H2O(l) ΔH=-2600 kJ/mol练习应根据什么标准来选择燃料?举例说明。提示:可从物质的燃烧热、燃料的储量、
开采、运输、储存的条件、价格、对生态
环境的影响等各方面综合考虑。思考与交流二、能源阅读P8-P9,小组内展开讨论,弄清楚以下问题
什么是能源?可从能源的储量、在世界所占地位、
能源总消费与人均消费情况等方面
讨论我国目前的能源状况如何? 解决能源危机有哪些办法?能
源 ①化石燃料——煤、石油、天然气②阳光、风力、流水、潮汐、地热…③柴草二、能源1、能源能提供能量的资源定义:分类地位:是国民经济和社会发展的重要物质基础2、我国目前的能源状况(1)主要能源是化石燃料(2)化石燃料的特点蕴藏量有限不能再生污染严重最终将会枯竭(3)能源利用率低3、解决能源危机的方法(1)科学地控制燃烧反应,使燃料充分燃烧,提高能源的使用效率是节约能源的重要措施。(2)寻找新能源,现正在探索的新能源有太阳能、氢能、风能、地热能、海洋能和生物质能等。它们资源丰富,可以再生,没有污染或很少污染,是未来的主要能源。中和热桃源九中朱高林高二新授课课件1、概念:
在稀溶液中,酸与碱发生中和反应生1molH2O所放出的热量叫中和热。 若是强酸、强碱其中和热均为57.3KJ/mol。
这是因为强酸与强碱发生中和反应的实质是:
H+ +OH― ═H2O 三、中和热:注意:强酸与弱碱、强碱与弱酸、弱酸与弱碱反应的中和热均小于57.3KJ/mol。(是因为弱酸、弱碱的电离是吸热的)中和热是否就是酸、碱发生中和反应的反应热呢? 如:1mol/LHNO3 与1mol/LNaOH发生中和反应生成1molH2O。
放出的热量为57.3KJ。 一定要“稀溶液”
(这是因为浓溶液中离子之间
存在较强的牵制作用) H+(aq)+OH-(aq)=H2O (1) △H=-57.3kJ/mol
2、中和热的表示:例1、写出下列反应的热化学方程式:
实验测得:(1)1 L 1 mol/L 稀盐酸跟1 L 1 mol/L NaOH溶液起中和反应放出57.3 kJ热量。
(2)1 L 1 mol/L KOH 溶液中和1 L 1 mol/L HNO3溶液,放出57.3 kJ的热量。
(3)1 L 1 mol/L H2SO4溶液与2 L 1 mol/L NaOH 溶液完全反应,放出114.6 kJ的热量。(1)NaOH(aq)+HCl(aq)==NaCl(aq)+H2O(l);
ΔH=-57.3 kJ/mol
(2)KOH(aq)+HNO3(aq)==KNO3(aq)+H2O(l)
ΔH=-57.3 kJ/mol
(3)2NaOH(aq)+H2SO4(aq)==Na2SO4(aq)+2H2O(l)
ΔH=-114.6 kJ/mol[设问]第(1)个反应的反应热是多少?中和热是多少?第(2)个反应呢?第(3)反应的情况又怎样呢? [答]反应①②的反应热和中和热均为57.3 kJ/mol反应③的反应热为114.6 kJ/mol,中和热为57.3 kJ/mol为什么它的反应热与中和热不同呢?因为中和热要求反应生成的H2O为1 mol,而反应(3)生成H2O为2 mol,故其中和热应为反应热的二分之一。例2、已知H+(aq)+OH-(aq)=H2O(l); ?H= -57.3kJ/mol ,求下列中和反应中放出的热量。
(1)用20gNaOH配稀溶液跟足量稀盐酸反应放出____________ kJ的热量。
(2)用28gKOH配稀溶液跟足量稀硝酸反应,放出____________kJ的热量。
28.728.73、理解要点
①研究条件:稀溶液
②反应物:酸与碱
③生成物及其物质的量:1molH2O
④放出热量:ΔH<0 单位:kJ/mol 在书写物质在溶液中发生化学反应的方程式时,我们常用aq来表示稀溶液,稀溶液是指溶于大量水的离子。中和热不包括离子在水溶液中的生成热、物质的溶解热、电解质电离的吸热所伴随的热效应。小结:燃烧热和中和热的比较
下列各对酸与碱的中和热大于 57.3KJ/mol的是 ,小于 57.3KJ/mol的是 ,等于 57.3KJ/mol的是 。
(填序号)
A.盐酸与氢氧化钾 B.氨水与盐酸
C. 醋酸与氢氧化钠 D.硫酸与氢氧化钡 [练习]DBCA一、燃烧热
概念:
表示意义:
书写热化学方程式:
燃烧热的计算:
二、中和热
概念:
中和热的表示:溶液(aq)
中和热测定实验的注意事项
Q放=n(可燃物)ⅹ△H小结
