苏教版必修二12 微观之间的相互作用力(课件)
文档属性
| 名称 | 苏教版必修二12 微观之间的相互作用力(课件) |

|
|
| 格式 | rar | ||
| 文件大小 | 781.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2010-09-10 00:00:00 | ||
图片预览





文档简介
课件21张PPT。第二单元
(课时三)
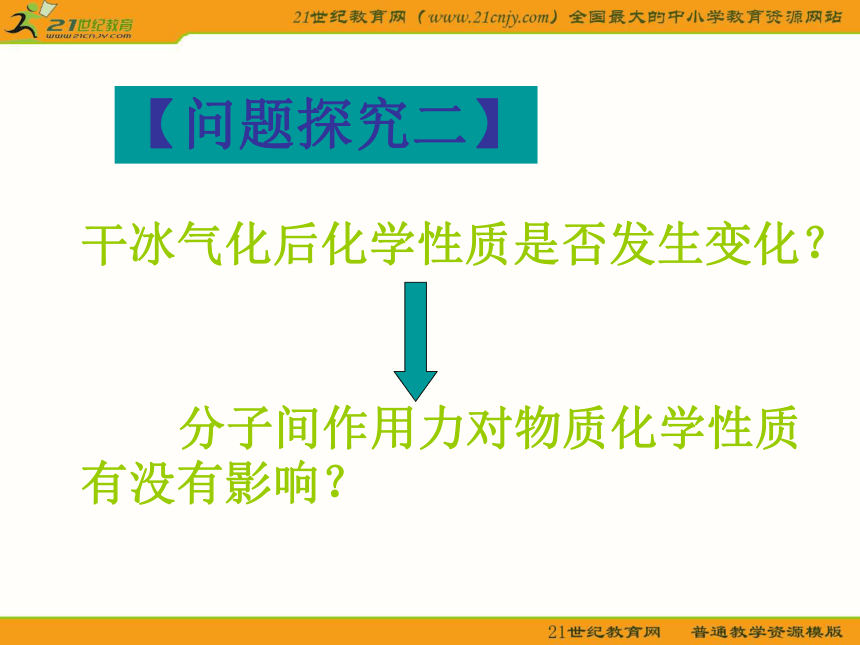
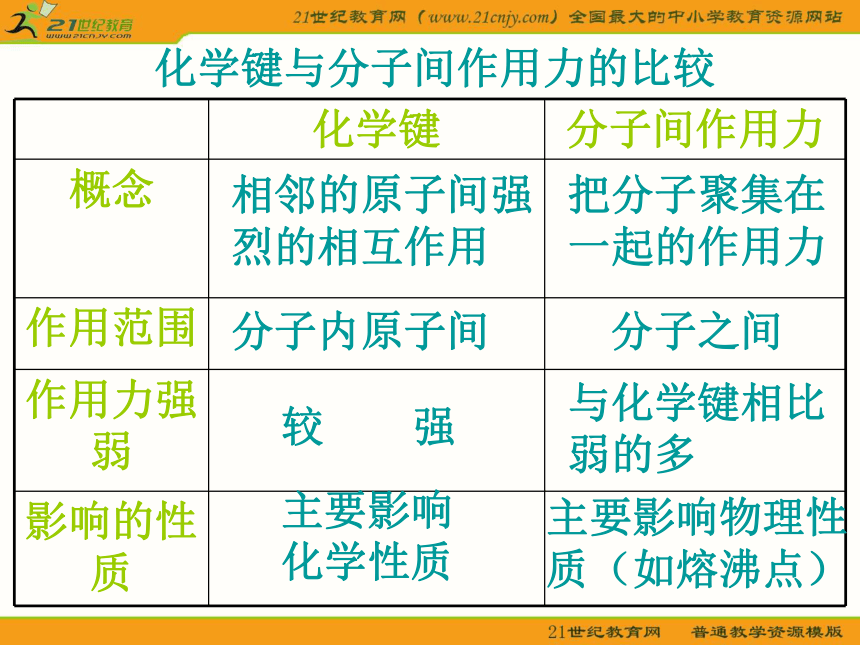
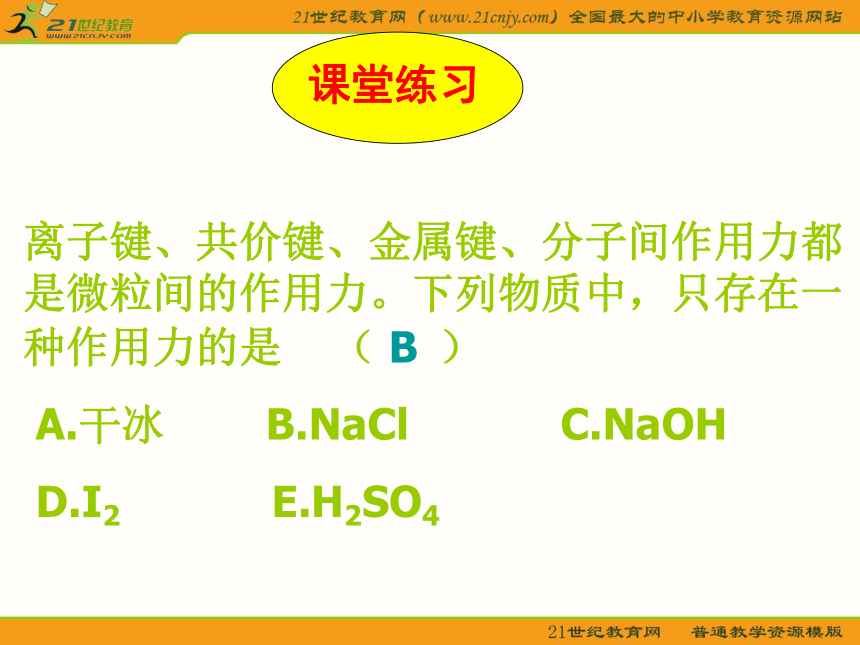
分子间作用力【问题探究一】干冰气化现象是物理变化还是化学变化?干冰气化过程中有没有破坏其中的化学键?那为什么干冰气化过程仍要吸收能量呢?分子间作用力 分子间存在着将分子聚集在一起的作用力,这种作用力称为分子间作用力又称为范德华力【问题探究二】干冰气化后化学性质是否发生变化? 分子间作用力对物质化学性质有没有影响?分子间作用力的特点1.广泛存在(由分子构成的物质)2.作用范围小3.作用力弱4.主要影响物质的物理性质(熔沸点)相邻的原子间强烈的相互作用把分子聚集在一起的作用力分子内原子间分子之间较 强与化学键相比弱的多主要影响化学性质主要影响物理性质(如熔沸点)化学键与分子间作用力的比较离子键、共价键、金属键、分子间作用力都是微粒间的作用力。下列物质中,只存在一种作用力的是 ( )
A.干冰 B.NaCl C.NaOH
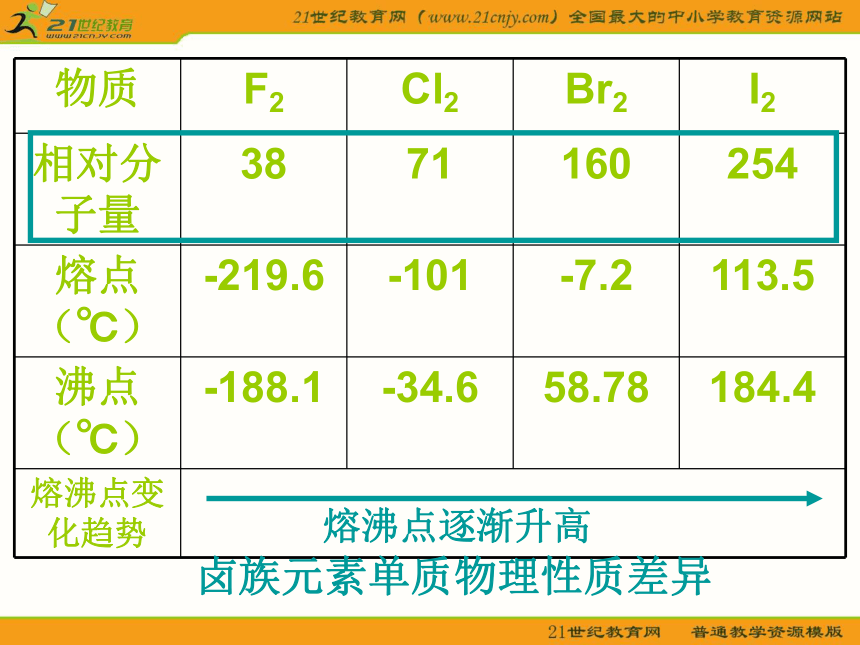
D.I2 E.H2SO4B【问题探究三】 分子间作用力如何影响物质的物理性质?卤族元素单质物理性质差异【拓展视野】比较下列物质的熔沸点的高低
CH4_ CF4 _ CCl4 _ CBr4 _ CI4
H2O_ H2S _ H2Se _ H2Te
HF_HCl_HBr _HI氢 键1.氢键是一种特殊的分子间作用力,不是化学键2.氢键的表示方法:X—H…Y3.氢键的形成条件:⑴有X-H共价键,X原子非金属性强,原子半径小,如F、O、N⑵ X—H…Y中的Y必须具有未共享电子对,原子半径小。X、Y可以相同,也可以不同。H2O中的氢键【问题探究三】冰中的氢键4.氢键对物质性质的影响⑴氢键的存在使物质的熔沸点相对较高⑵解释一些反常现象:如水结成冰时,为什么体积会膨胀。下列事实与氢键有关的是 ( )
A.水加热到很高的温度都难以分解
B.水结成冰体积膨胀,密度变小
C.CH4、SiH4、GeH4 、 SnH4的熔点随相对分子质量的增大而升高
D.HF、HCl、HBr、HI的热稳定性依次减弱B固体冰中不存在的作用力是 ( )
A.离子键 B.极性键
C. 氢键 D. 范德华力 A 氨气溶于水时,大部分NH3 与H2O以氢键(用…)表示结合成NH3 ·H2O分子。根据氨水的性质可推知NH3 ·H2O的结构式为( )B. H
│
N—H …H—O
│ │
H HA.H
│
N—H …O—H
│ │
H HC. H
│
H—N…O—H
│ │
H HD. H
│
H—N…H—O
│ │
H HD
(课时三)
分子间作用力【问题探究一】干冰气化现象是物理变化还是化学变化?干冰气化过程中有没有破坏其中的化学键?那为什么干冰气化过程仍要吸收能量呢?分子间作用力 分子间存在着将分子聚集在一起的作用力,这种作用力称为分子间作用力又称为范德华力【问题探究二】干冰气化后化学性质是否发生变化? 分子间作用力对物质化学性质有没有影响?分子间作用力的特点1.广泛存在(由分子构成的物质)2.作用范围小3.作用力弱4.主要影响物质的物理性质(熔沸点)相邻的原子间强烈的相互作用把分子聚集在一起的作用力分子内原子间分子之间较 强与化学键相比弱的多主要影响化学性质主要影响物理性质(如熔沸点)化学键与分子间作用力的比较离子键、共价键、金属键、分子间作用力都是微粒间的作用力。下列物质中,只存在一种作用力的是 ( )
A.干冰 B.NaCl C.NaOH
D.I2 E.H2SO4B【问题探究三】 分子间作用力如何影响物质的物理性质?卤族元素单质物理性质差异【拓展视野】比较下列物质的熔沸点的高低
CH4_ CF4 _ CCl4 _ CBr4 _ CI4
H2O_ H2S _ H2Se _ H2Te
HF_HCl_HBr _HI氢 键1.氢键是一种特殊的分子间作用力,不是化学键2.氢键的表示方法:X—H…Y3.氢键的形成条件:⑴有X-H共价键,X原子非金属性强,原子半径小,如F、O、N⑵ X—H…Y中的Y必须具有未共享电子对,原子半径小。X、Y可以相同,也可以不同。H2O中的氢键【问题探究三】冰中的氢键4.氢键对物质性质的影响⑴氢键的存在使物质的熔沸点相对较高⑵解释一些反常现象:如水结成冰时,为什么体积会膨胀。下列事实与氢键有关的是 ( )
A.水加热到很高的温度都难以分解
B.水结成冰体积膨胀,密度变小
C.CH4、SiH4、GeH4 、 SnH4的熔点随相对分子质量的增大而升高
D.HF、HCl、HBr、HI的热稳定性依次减弱B固体冰中不存在的作用力是 ( )
A.离子键 B.极性键
C. 氢键 D. 范德华力 A 氨气溶于水时,大部分NH3 与H2O以氢键(用…)表示结合成NH3 ·H2O分子。根据氨水的性质可推知NH3 ·H2O的结构式为( )B. H
│
N—H …H—O
│ │
H HA.H
│
N—H …O—H
│ │
H HC. H
│
H—N…O—H
│ │
H HD. H
│
H—N…H—O
│ │
H HD
