新课标人教版高中化学选修(4)第二章第一节化学反应速率
文档属性
| 名称 | 新课标人教版高中化学选修(4)第二章第一节化学反应速率 |

|
|
| 格式 | rar | ||
| 文件大小 | 1.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2010-09-10 16:44:00 | ||
图片预览







文档简介
课件22张PPT。第二章 化学反应速率和化学平衡
§2-1 化学反应速率
2019年2月24日星期日快!慢 1.实验中怎样判断化学反应 的快慢?
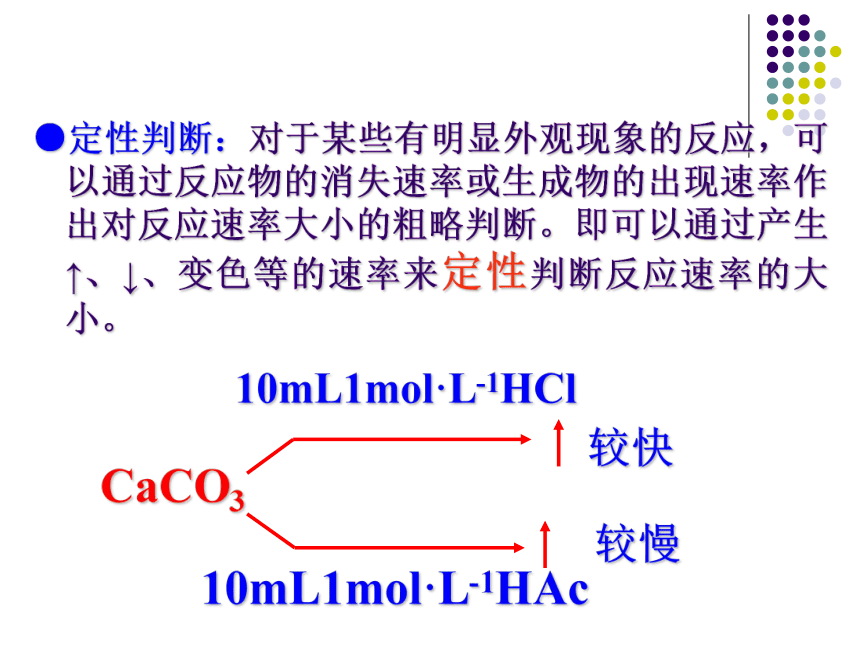
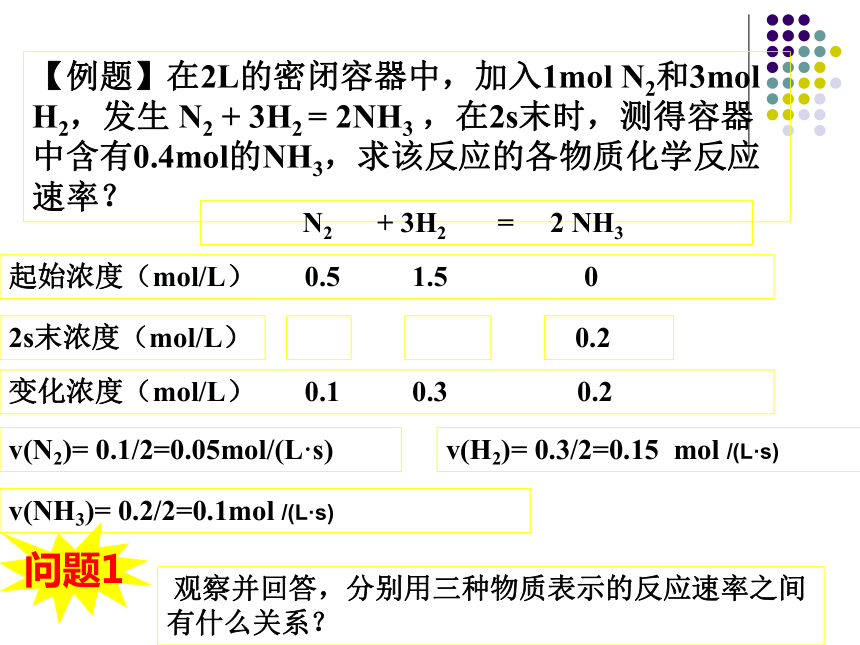
2.通过对实验现象的观察你能否判断出一个反应比另一个反应快么?那快多少呢?思考与交流●定性判断:对于某些有明显外观现象的反应,可以通过反应物的消失速率或生成物的出现速率作出对反应速率大小的粗略判断。即可以通过产生↑、↓、变色等的速率来定性判断反应速率的大小。CaCO310mL1mol·L-1HCl10mL1mol·L-1HAc较快较慢化学反应速率通常用单位时间内反应物浓度的减少或生成物浓度的增加来表示。化学反应速率常用单位 mol /(L·s)或 mol/(L·min)2.表达式: v = △c / △t一、化学反应速率1.定义:3.单位:【例题】在2L的密闭容器中,加入1mol N2和3mol H2,发生 N2 + 3H2 =?2NH3 ,在2s末时,测得容器中含有0.4mol的NH3,求该反应的各物质化学反应速率? N2 + 3H2 =? 2 NH3起始浓度(mol/L) 0.5 1.5 02s末浓度(mol/L) 0.2v(N2)= 0.1/2=0.05mol/(L·s)v(H2)= 0.3/2=0.15 mol /(L·s)v(NH3)= 0.2/2=0.1mol /(L·s) 观察并回答,分别用三种物质表示的反应速率之间有什么关系?问题1变化浓度(mol/L) 0.1 0.3 0.2 同一个反应,用不同的物质来表示反应速率,数值是不一样的,所以应注明是由哪种物质表示的。
同一反应中,各物质的速率之比等于他们在化学方程式中的化学计量数之比。如在N2 + 3H2 =?2NH3 中, v(N2):v(H2):v(NH3)=1:3:2 我们得到的速率是指什么时候的速率?结论2、我们所说的速率是指在整个过程中的平均速率。且均为正值结论1问题2应用1.比较反应速率的大小 ④﹥ ②= ③﹥ ①结论3、在同一反应中,反应速率的大小不能单纯地看数值大小,而应该转化成同一物质,同一单位后才能比较。应用2.根据各物质的反应速率之比写出化学方程式。例、某温度下,浓度都是1mol/L的两种气体X2和Y2,在密闭容器中反应生成气体Z,经过t min后,测得物质的量浓度分别为:c(X2)=0.4mol/L,c(Y2)=0.8mol/L ,c(Z)=0.4mol/L,则该反应的反应方程式可表示为:3X2 + Y2 === 2Z由此可推出Z的化学式为:X3Y根据下图回答:1、反应物是__________.2、2min内A的平均速率是________3、写出化学方程式A、B2.5mol/(L·min)2.注意:
a. v表示一段时间的平均反应速率,且为正值;b.同一反应中,各物质的速率之比等于它们在化学方程式中的化学计量数之比。c、在同一反应中,反应速率的大小不能单纯地看数值大小,而应该转化成同一物质,同一单位后才能比较。1.化学反应速率的定义及表达式d、固体和纯液体(不是溶液)的物质的量浓度可视为不变的常数,所以,一般不用固体或纯液体表示反应速率。小结:练习: 1、在2L的密闭容器中,发生下列反应: 3A(g)+ B(g)=2C(g)+D(g)。若最初加入的A 和B 都是4mol,在前10sA 的平均反应速率为0.12mol /(L·s) ,则10s时,容器中B的物质的量为 。 3.2mol 练习:在25℃时,向100mL含HCl 14.6g的盐酸中,放入5.6g铁粉,反应进行到2s时收集到氢气1.12L(标况),之后反应又进行了4s,铁粉全溶解。若不考虑体积变化,则:
(1)前2s内用FeCl2表示的平均反应速率为 ;
(2)后4s内用HCl表示的平均反应速率为 ;
(3)前2s与后4s比较,反应速率 较快,其原因可能 。0.25mol /(L·s)0.25mol /(L·s)前2s前2s时段盐酸浓度比后4s时段大 化学反应速率的实验测定测定方法有∶(P18)
1、直接观察某些性质(如释放出气体的体积和体系压强);
2、科学仪器测定(如颜色的深浅、光的吸收和发射、导电能力等);
3、溶液中,常利用颜色深浅和显色物质浓度间的正比关系来跟踪反应的过程和测量反应速率。(实验2一1)实验分析∶该实验所用的仪器和药品?锥形瓶分液漏斗 玻璃导管乳胶管注射器(50ml)铁架台量筒(50ml)胶头滴管 秒表锌粒、1mol/L硫酸、 4 mol/L硫酸按图安装两套装置,在锥形瓶里装有2g锌粒(颗粒大小相同),然后通过分液漏斗分别加入40mL1mol/L和40mL4mol/L硫酸,比较二者收集10ml氢气所需的时间。
操作:讨论:实验中为何规定锌粒颗粒大小相同?你还可以通过相同时间内收集到的氢气量多少来比较二者反应速率,请你设计方案,并继续实验。思考??1、如果没有注射器,用什么来代替?2、你还能根据反应速率相关的哪些变化来测定该反应的反应速率?测量氢气体积方法有哪些?本实验还可以如何测定锌和稀硫酸反应的速率
1、测量溶液中的H+的浓度的变化
2、测量溶液中的Zn2+的浓度变化
3、测量氢气的体积或氢气的质量的变化
4、测量体系的压强的变化
5、测量锌粒的质量的变化
6、测量反应体系的热量变化 定量表示:
v(A) = △c (A)/△t
=———
定性描述:
①冒气泡快慢
②颜色变化
③固体量减少
④浑浊程度
⑤温度变化 △t△n (A)V——小结:化学反应速率的概念和计算www.themegallery.comThank You !
§2-1 化学反应速率
2019年2月24日星期日快!慢 1.实验中怎样判断化学反应 的快慢?
2.通过对实验现象的观察你能否判断出一个反应比另一个反应快么?那快多少呢?思考与交流●定性判断:对于某些有明显外观现象的反应,可以通过反应物的消失速率或生成物的出现速率作出对反应速率大小的粗略判断。即可以通过产生↑、↓、变色等的速率来定性判断反应速率的大小。CaCO310mL1mol·L-1HCl10mL1mol·L-1HAc较快较慢化学反应速率通常用单位时间内反应物浓度的减少或生成物浓度的增加来表示。化学反应速率常用单位 mol /(L·s)或 mol/(L·min)2.表达式: v = △c / △t一、化学反应速率1.定义:3.单位:【例题】在2L的密闭容器中,加入1mol N2和3mol H2,发生 N2 + 3H2 =?2NH3 ,在2s末时,测得容器中含有0.4mol的NH3,求该反应的各物质化学反应速率? N2 + 3H2 =? 2 NH3起始浓度(mol/L) 0.5 1.5 02s末浓度(mol/L) 0.2v(N2)= 0.1/2=0.05mol/(L·s)v(H2)= 0.3/2=0.15 mol /(L·s)v(NH3)= 0.2/2=0.1mol /(L·s) 观察并回答,分别用三种物质表示的反应速率之间有什么关系?问题1变化浓度(mol/L) 0.1 0.3 0.2 同一个反应,用不同的物质来表示反应速率,数值是不一样的,所以应注明是由哪种物质表示的。
同一反应中,各物质的速率之比等于他们在化学方程式中的化学计量数之比。如在N2 + 3H2 =?2NH3 中, v(N2):v(H2):v(NH3)=1:3:2 我们得到的速率是指什么时候的速率?结论2、我们所说的速率是指在整个过程中的平均速率。且均为正值结论1问题2应用1.比较反应速率的大小 ④﹥ ②= ③﹥ ①结论3、在同一反应中,反应速率的大小不能单纯地看数值大小,而应该转化成同一物质,同一单位后才能比较。应用2.根据各物质的反应速率之比写出化学方程式。例、某温度下,浓度都是1mol/L的两种气体X2和Y2,在密闭容器中反应生成气体Z,经过t min后,测得物质的量浓度分别为:c(X2)=0.4mol/L,c(Y2)=0.8mol/L ,c(Z)=0.4mol/L,则该反应的反应方程式可表示为:3X2 + Y2 === 2Z由此可推出Z的化学式为:X3Y根据下图回答:1、反应物是__________.2、2min内A的平均速率是________3、写出化学方程式A、B2.5mol/(L·min)2.注意:
a. v表示一段时间的平均反应速率,且为正值;b.同一反应中,各物质的速率之比等于它们在化学方程式中的化学计量数之比。c、在同一反应中,反应速率的大小不能单纯地看数值大小,而应该转化成同一物质,同一单位后才能比较。1.化学反应速率的定义及表达式d、固体和纯液体(不是溶液)的物质的量浓度可视为不变的常数,所以,一般不用固体或纯液体表示反应速率。小结:练习: 1、在2L的密闭容器中,发生下列反应: 3A(g)+ B(g)=2C(g)+D(g)。若最初加入的A 和B 都是4mol,在前10sA 的平均反应速率为0.12mol /(L·s) ,则10s时,容器中B的物质的量为 。 3.2mol 练习:在25℃时,向100mL含HCl 14.6g的盐酸中,放入5.6g铁粉,反应进行到2s时收集到氢气1.12L(标况),之后反应又进行了4s,铁粉全溶解。若不考虑体积变化,则:
(1)前2s内用FeCl2表示的平均反应速率为 ;
(2)后4s内用HCl表示的平均反应速率为 ;
(3)前2s与后4s比较,反应速率 较快,其原因可能 。0.25mol /(L·s)0.25mol /(L·s)前2s前2s时段盐酸浓度比后4s时段大 化学反应速率的实验测定测定方法有∶(P18)
1、直接观察某些性质(如释放出气体的体积和体系压强);
2、科学仪器测定(如颜色的深浅、光的吸收和发射、导电能力等);
3、溶液中,常利用颜色深浅和显色物质浓度间的正比关系来跟踪反应的过程和测量反应速率。(实验2一1)实验分析∶该实验所用的仪器和药品?锥形瓶分液漏斗 玻璃导管乳胶管注射器(50ml)铁架台量筒(50ml)胶头滴管 秒表锌粒、1mol/L硫酸、 4 mol/L硫酸按图安装两套装置,在锥形瓶里装有2g锌粒(颗粒大小相同),然后通过分液漏斗分别加入40mL1mol/L和40mL4mol/L硫酸,比较二者收集10ml氢气所需的时间。
操作:讨论:实验中为何规定锌粒颗粒大小相同?你还可以通过相同时间内收集到的氢气量多少来比较二者反应速率,请你设计方案,并继续实验。思考??1、如果没有注射器,用什么来代替?2、你还能根据反应速率相关的哪些变化来测定该反应的反应速率?测量氢气体积方法有哪些?本实验还可以如何测定锌和稀硫酸反应的速率
1、测量溶液中的H+的浓度的变化
2、测量溶液中的Zn2+的浓度变化
3、测量氢气的体积或氢气的质量的变化
4、测量体系的压强的变化
5、测量锌粒的质量的变化
6、测量反应体系的热量变化 定量表示:
v(A) = △c (A)/△t
=———
定性描述:
①冒气泡快慢
②颜色变化
③固体量减少
④浑浊程度
⑤温度变化 △t△n (A)V——小结:化学反应速率的概念和计算www.themegallery.comThank You !
