二氧化硫的性质和作用
图片预览





文档简介
课件19张PPT。第一单元 含硫化合物的性质和应用二氧化硫的性质和作用专题4: 硫、氮和可持续发展学习目标1、通过对SO2的观察掌握其物理性质
2、通过对SO2性质实验的探究掌握其漂白性、还原性
3、通过对酸雨的了解增强环保意识学习重点
SO2物理性质、化学性质
学习难点
SO2的还原性探究1
一、物理性质 状态:
颜色:
气味:
毒性:
密度:
溶解度: 气体无色刺激性有毒比空气大易溶于水,常温、常压下,1体积水溶解40体积SO2探究2:SO2溶于水仅仅是溶于水吗?有没有发生化学反应?发生化学反应的判断依据是什么?知识再现:
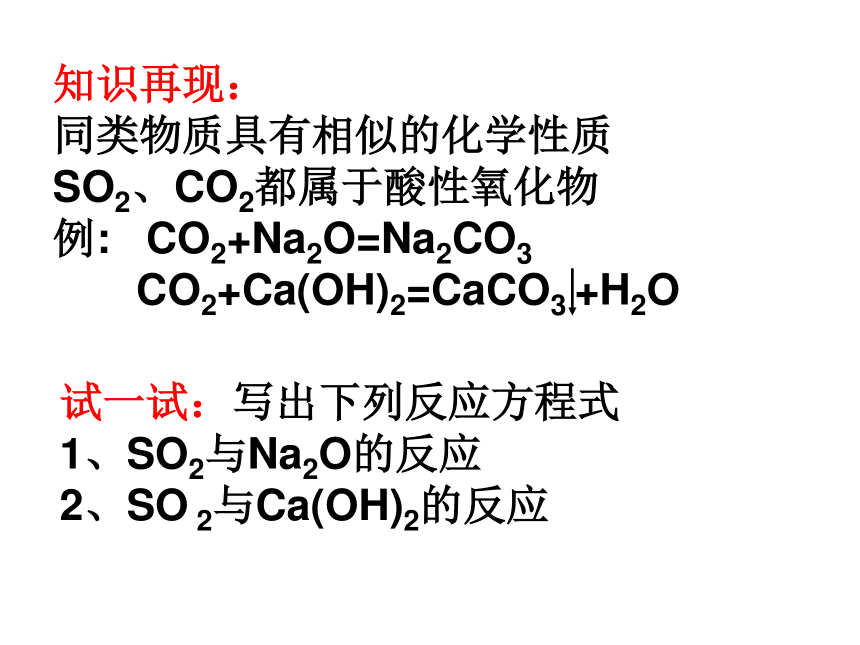
同类物质具有相似的化学性质
SO2、CO2都属于酸性氧化物
例: CO2+Na2O=Na2CO3
CO2+Ca(OH)2=CaCO3 +H2O 试一试:写出下列反应方程式
1、SO2与Na2O的反应
2、SO 2与Ca(OH)2的反应实验探究3:
向收集有SO2气体的试管中加入品红溶液,振荡,观察颜色变化;
然后加热试管,对比加热前后溶液颜色变化.联系生活1次氯酸和二氧化硫漂白性的比较 氯水中HClO将有色物质氧化成无色物质氧化还原反应永久性可漂白大多数有色物质,能使紫色石蕊试液褪色SO2与某些有色物质结合生成不稳定的无色物质非氧化还原反应暂时性漂白某些有色物质,
能使紫色石蕊试液褪色不 联系生活2实验探究4 向另一支试管中加入5mL二氧化硫水溶液,滴加氯化钡溶液,再滴加0.5mL 3%的过氧化氢溶液,振荡,放置片刻后滴加稀盐酸,观察实验现象。现象:加BaCl2溶液无明显现象,加H2O2溶液生成白色沉淀,加盐酸沉淀不溶解。H2SO3 + H2O2 = H2SO4 + H2O
H2SO4 + BaCl2 = BaSO4↓+2HCl结论:
SO2( H2SO3)具有较强的还原性,能被氧化剂(如H2O2、O2、氯水、溴水、酸性高锰酸钾等)氧化H2SO3 + H2O2 = H2SO4 + H2O
2H2SO3 + O2 = 2H2SO4二、酸雨的形成、危害与防治SO2 ?SO3 ?H2SO4O2+2H2SO3=2H2SO4SO3+H2O=H2SO4酸雨对环境的危害酸雨的防治so2是产生酸雨的主要原因。那么,so2是不是有百害而无一利呢?换个角度看问题:2.食品和干果防腐剂3.漂白剂1.制造硫酸1、下列关于二氧化硫的说法中不正确的是
A、SO2是硫及某些含硫化合物在空气中
燃烧的产物
B、 有漂白作用
C 、 溶于水后生成H2SO4
D、是一种大气污染物巩固练习:2、下列可以用来鉴别SO2 和CO2 的方法是[ ]
A、通入紫色石蕊试液 B、闻气味
C、通入澄清石灰水 D、通入品红溶液中
都是酸性氧化物,都可以使石蕊变红SO2有刺激性气味,而CO2没有都可以使澄清石灰水变浑浊SO2可使品红褪色,而CO2不能 B D巩固练习:
2、通过对SO2性质实验的探究掌握其漂白性、还原性
3、通过对酸雨的了解增强环保意识学习重点
SO2物理性质、化学性质
学习难点
SO2的还原性探究1
一、物理性质 状态:
颜色:
气味:
毒性:
密度:
溶解度: 气体无色刺激性有毒比空气大易溶于水,常温、常压下,1体积水溶解40体积SO2探究2:SO2溶于水仅仅是溶于水吗?有没有发生化学反应?发生化学反应的判断依据是什么?知识再现:
同类物质具有相似的化学性质
SO2、CO2都属于酸性氧化物
例: CO2+Na2O=Na2CO3
CO2+Ca(OH)2=CaCO3 +H2O 试一试:写出下列反应方程式
1、SO2与Na2O的反应
2、SO 2与Ca(OH)2的反应实验探究3:
向收集有SO2气体的试管中加入品红溶液,振荡,观察颜色变化;
然后加热试管,对比加热前后溶液颜色变化.联系生活1次氯酸和二氧化硫漂白性的比较 氯水中HClO将有色物质氧化成无色物质氧化还原反应永久性可漂白大多数有色物质,能使紫色石蕊试液褪色SO2与某些有色物质结合生成不稳定的无色物质非氧化还原反应暂时性漂白某些有色物质,
能使紫色石蕊试液褪色不 联系生活2实验探究4 向另一支试管中加入5mL二氧化硫水溶液,滴加氯化钡溶液,再滴加0.5mL 3%的过氧化氢溶液,振荡,放置片刻后滴加稀盐酸,观察实验现象。现象:加BaCl2溶液无明显现象,加H2O2溶液生成白色沉淀,加盐酸沉淀不溶解。H2SO3 + H2O2 = H2SO4 + H2O
H2SO4 + BaCl2 = BaSO4↓+2HCl结论:
SO2( H2SO3)具有较强的还原性,能被氧化剂(如H2O2、O2、氯水、溴水、酸性高锰酸钾等)氧化H2SO3 + H2O2 = H2SO4 + H2O
2H2SO3 + O2 = 2H2SO4二、酸雨的形成、危害与防治SO2 ?SO3 ?H2SO4O2+2H2SO3=2H2SO4SO3+H2O=H2SO4酸雨对环境的危害酸雨的防治so2是产生酸雨的主要原因。那么,so2是不是有百害而无一利呢?换个角度看问题:2.食品和干果防腐剂3.漂白剂1.制造硫酸1、下列关于二氧化硫的说法中不正确的是
A、SO2是硫及某些含硫化合物在空气中
燃烧的产物
B、 有漂白作用
C 、 溶于水后生成H2SO4
D、是一种大气污染物巩固练习:2、下列可以用来鉴别SO2 和CO2 的方法是[ ]
A、通入紫色石蕊试液 B、闻气味
C、通入澄清石灰水 D、通入品红溶液中
都是酸性氧化物,都可以使石蕊变红SO2有刺激性气味,而CO2没有都可以使澄清石灰水变浑浊SO2可使品红褪色,而CO2不能 B D巩固练习:
