从自然资源到化学品
图片预览











文档简介
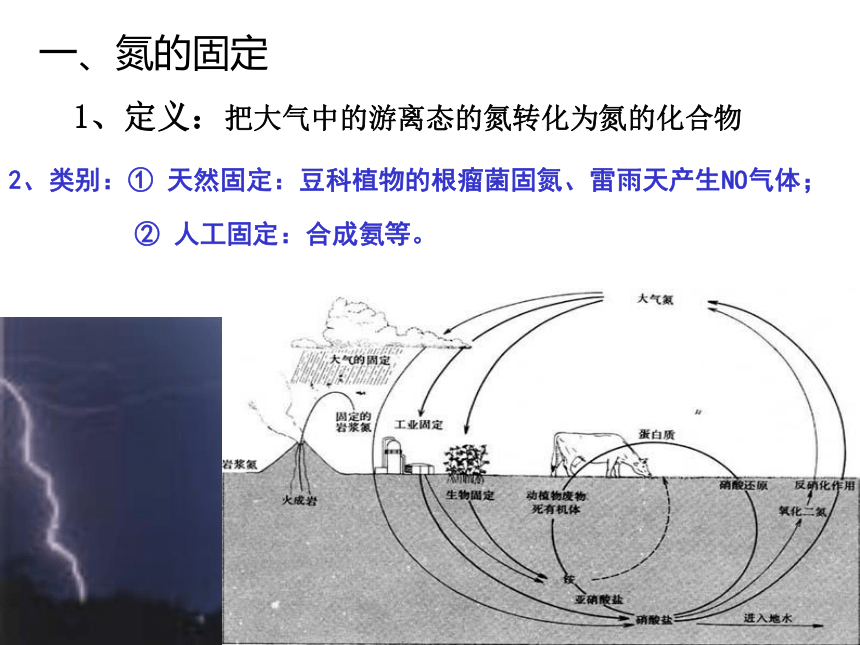
课件39张PPT。第一单元 氨的合成专题2 从自然资源到化学品智利硝石(NaNO3)缺氮的棉花 游离态的氮大量存在于___________地壳中的氮的含量只有0.04%,大气中氮气的体积分数为78%。大多数生物只能吸收氮的化合物。你——一位优秀的化学家,将如何拯救饱受饥饿之苦的劳动人民? 随着人口的增长,人们对粮食的需求越来越大,农业必须发展起来,随着农业的发展,对氮肥的需求量在迅速增长。在19世纪以前,农业上所需氮肥的来源主要来自有机物的副产品,如粪类、种子饼及绿肥。1809年在智利发现了一个很大的硝酸钠矿产地,并很快被开采。 大气 一、氮的固定1、定义:把大气中的游离态的氮转化为氮的化合物2、类别:① 天然固定:豆科植物的根瘤菌固氮、雷雨天产生NO气体;② 人工固定:合成氨等。问题1:请同学们分析工业生产主要要考虑哪些问题?首要:经济效益与社会效益(符合绿色化学理念)基本要求:
a、反应快
b、原料利用率高
c、单位时间内产量高高 温高 压高 压低 温使 用不 影 响问题2:请同学们分析下表(49页表2—5)。分别从化学反应速率和化学平衡两个角度分析合成氨的合适条件。 填 表从反应速度的角度看:温度越高、压强越大,化学反应越快, 使用催化剂反应加快,单位时间内生成的产品越多;
从化学平衡的角度看:高压低温,平衡时生成物NH3的百含量高。问题3:请同学们分析下表(49页表2—5)。分别从化学反应速率和化学平衡两个角度分析合成氨的合适条件。 结 论问题4:工业上合成氨的合适条件到底怎样?使用催化剂:铁触媒(以Fe为主体的多成分催化剂)这样可以大大加快化学反应速率,提高生产效率,也提高了经济效益;
选择合适的温度:450℃左右,该温度是为合成氨催化剂的活性温度;
选择合适的压强:20MPa~50MPa,该压强下进行生产,对动力、材料、设备等来说正合适。3、合成氨的适宜条件三、合成氨的生产工艺原料:空气、水、燃料原料气的制备净化压缩(防止催化剂中毒)合成分离液氨N2、H2中学化学资料网 http://www.e-huaxue.com/第二单元 氯碱生产专题2 从自然资源到化学品 于是,人们将目光投向海水、盐湖,这里蕴藏着丰富的食盐资源。食盐不仅来源广、价廉易得,从其组成看也是制取烧碱和氯气的理想原料。在反复研制的基础上,人们终于以食盐为主要原料制得了烧碱和氯气并由此形成了氯碱工业 随着纺织、造纸、石油化工以及有机合成工业的迅速发展,对烧碱和氯气的需求量剧增,而为了获取大量的烧碱和氯气,关键又在于寻求理想的原料和采用新的生产方法。
氯碱工业:通过电解饱和食盐水来生产烧碱、氯气和氢气,并以它们为原料生产一系列化工产品的工业一、氯碱生产的核心技术——电解 使电流通过电解质溶液或熔融态的电解质,在阴、阳两极分别发生还原反应和氧化反应的过程叫做电解(electrolysis)。 对电解槽结构进行优化设计,合理选用电极和隔膜材料,是电解生产的核心。石棉隔膜电解槽 离子膜电解槽1.离子膜电解槽的简单构造如何? 2.离子膜的作用是什么? 3.工业制碱的简单生产流程怎样?二、食盐水电解工艺——离子膜法电解 1、生产的主体设备:离子膜电解槽
简单构造:阳极:金属钛网(涂钛钌氧化物)
阴极:碳钢网(有镍涂层)
阳离子交换膜:只允许阳离子通过,
把电解槽隔成阴极室和阳极室。
2、添加原料
阳极室:精制的饱和食盐水
阴极室:添加纯水(加一定量的NaOH溶液)
3、离子交换膜的作用:
(1)防止Cl2和H2混合而引起爆炸
(2)避免Cl2与NaOH反应生成NaClO,影响NaOH的产量三、氯碱生产的流程1.用什么方法除去泥沙?
2.用什么试剂除去Ca2+、Mg2+、Fe3+、SO42-?
3.所用试剂只有过量才能除净这些杂质,试设计一个合理的顺序逐一除杂。
思考:粗盐水(Ca2+、Mg2+、Fe3+、SO42-)Ba2+ + SO42- =BaSO4Na+ 、 Ca2+、Mg2+、Fe3+、Ba2+ 、 Cl-BaSO4Ca2+ + CO32- = CaCO3
Ba2+ + CO32- = BaCO3CaCO3
BaCO3过量Na2CO3Na+、 Mg2+、 Ca2+ 、 Cl- 、 OH-Mg2+ + 2OH- = Mg(OH)2
Fe3+ + 3OH- = Fe(OH)3过量NaOHFe(OH)3
Mg(OH)2Mg2+、 Ca2+、 Na+、 Cl- 、 OH-、CO32-精制食盐水适量HCl,调节PH通过阳离子交换树脂Na+、 Cl-四、氯碱工业产品的应用第三单元
硫酸工业硫酸的消费量是一个国家工业发达水平的一种标志接触法制硫酸思考1、工业制硫酸的原料有哪些?如何选择?2、工业制硫酸分几个阶段? 每个阶段的反应原理是什么?用到什么典型设备?3、工业制硫酸生产流程?硫酸工业生产的原理第一步:造气第二步:接触氧化第三步:三氧化硫的吸收生产流程:造气→催化氧化→吸收 生产中原料选择 早期黄铁矿在储量比较大,而天然硫磺矿资源缺乏,又难以以从国外购进,并且,那时对环境保护也不够重视。 为什么早期我国是以黄铁矿为原料制硫酸?硫酸工业生产流程动画 硫酸的工业生产沸 腾 炉接 触 室吸 收 塔净化冷 却空气 炉气思考:
从沸腾炉出来的气体 SO2是否纯净?矿渣思考:黄铁矿为什么要粉碎?为什么通入强大的空气流?燃烧黄铁矿为什么不要多加燃料?沸腾炉思考:适宜条件的选择接 触 室思考:接触室中热交换器的作用?从接触室出来的气体成分是什么?催化剂:五氧化二矾(V2O5)
温度:400至500摄氏度
压强:常压温度:400~500℃催化剂活性较高压强:设备、成本和能源消耗(增大压强SO2的转化率提高不大)吸 收 塔
思考:吸收三氧化硫为什么不用水和稀硫酸,而用98.3%的浓硫酸?浓硫酸为什么必须从塔顶喷下?
(1) SO2+Ca(OH)2=CaSO3+H2O
CaSO3+H2SO4=CaSO4+SO2↑+H2O
(2) SO2+2NH3 +H2O =(NH4)2SO3
(NH4)2SO3 + H2SO4 =( NH4)2SO4 + SO2↑+ H2OCa(OH)2 + H2SO4 = CaSO4 + 2H2O 制石膏黄铁矿矿渣可用来制造水泥、砖和炼铁等。(1)在沸腾炉旁设置“废热锅炉”,产生蒸汽发电;
(2)在接触室中设热交换器,预热SO2和O2 。二、能量充分利用
“废热”利用:A、B、C、D四地的地理位置如图,交通均较为便利,其他地理条件如下:A地是风景旅游城市;B地是硫酸消费中心;C地有较为丰富的黄铁矿资源;D地有少量的硫酸消费。硫酸厂址应选择在 。三、生产规模:一般要求较大规模
厂址选择 :靠近硫酸消费中心的地区,避开人口稠密的居民区和环境保护要求高的地区。3.对于接触法制硫酸的生产操作与说明生产操作的主要理由两者都正确的是 ( )
A.硫铁矿燃烧前需要粉碎,因为大块的硫铁矿不能燃烧
B.三氧化硫的吸收采取逆流的形式,目的是增大其与吸收剂的接触面积
C.二氧化硫氧化成三氧化硫时需使用催化剂,这样可以提高二氧化硫的转化率
D.三氧化硫用98.3%的浓硫酸吸收,目的是防止形成酸雾,以便使其吸收更加充分 硫酸的工业制备和环境保护BD ▲接触氧化的三个适宜条件:压强用常压;温度为400℃~500℃;催化剂主要为V2O5。 硫酸工业总结硫酸工业生产的原理镁和铝的冶炼镁的工业常见制法——电解法流程: 海水 请写出上述过程中所涉及到的化学方程式 (2)铝的制备
铝土矿的提纯
Al2O3+2OH-=2AlO2-+H2O
AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-
2Al(OH)3=Al2O3+3H2O
电解
2Al2O3(熔融)=4Al+3O2(冰晶石Na3AlF6)2019/2/24从铝土矿中提取铝铝土矿的成分:要从铝土矿中提取铝,必须先制备较纯的氧化铝工艺流程图见课本P62主要成分:Al2O3少量:Fe2O3、SiO2等杂质从铝土矿制备铝的工艺流程Al2O3
Fe2O3
SiO2过量NaOH
溶液过滤①Fe2O3除去NaAlO2
Na2SiO3
NaOH
溶液过量盐酸过滤②
AlCl3
NaCl
HCl
溶液
过量氨水过滤③滤液除去H2SiO3除去△④Al2O3通电⑤Al 方法1:Al(OH)3碱溶法Al2O3
Fe2O3
SiO2过量盐酸过滤①SiO2除去
AlCl3
FeCl3
HCl
溶液
过量NaOH
溶液过滤②Fe(OH)3除去NaAlO2
NaCl
NaOH
溶液过量CO2过滤③滤液除去Al(OH)3△ ④Al2O3通电⑤Al 方法2:酸溶法再 见
a、反应快
b、原料利用率高
c、单位时间内产量高高 温高 压高 压低 温使 用不 影 响问题2:请同学们分析下表(49页表2—5)。分别从化学反应速率和化学平衡两个角度分析合成氨的合适条件。 填 表从反应速度的角度看:温度越高、压强越大,化学反应越快, 使用催化剂反应加快,单位时间内生成的产品越多;
从化学平衡的角度看:高压低温,平衡时生成物NH3的百含量高。问题3:请同学们分析下表(49页表2—5)。分别从化学反应速率和化学平衡两个角度分析合成氨的合适条件。 结 论问题4:工业上合成氨的合适条件到底怎样?使用催化剂:铁触媒(以Fe为主体的多成分催化剂)这样可以大大加快化学反应速率,提高生产效率,也提高了经济效益;
选择合适的温度:450℃左右,该温度是为合成氨催化剂的活性温度;
选择合适的压强:20MPa~50MPa,该压强下进行生产,对动力、材料、设备等来说正合适。3、合成氨的适宜条件三、合成氨的生产工艺原料:空气、水、燃料原料气的制备净化压缩(防止催化剂中毒)合成分离液氨N2、H2中学化学资料网 http://www.e-huaxue.com/第二单元 氯碱生产专题2 从自然资源到化学品 于是,人们将目光投向海水、盐湖,这里蕴藏着丰富的食盐资源。食盐不仅来源广、价廉易得,从其组成看也是制取烧碱和氯气的理想原料。在反复研制的基础上,人们终于以食盐为主要原料制得了烧碱和氯气并由此形成了氯碱工业 随着纺织、造纸、石油化工以及有机合成工业的迅速发展,对烧碱和氯气的需求量剧增,而为了获取大量的烧碱和氯气,关键又在于寻求理想的原料和采用新的生产方法。
氯碱工业:通过电解饱和食盐水来生产烧碱、氯气和氢气,并以它们为原料生产一系列化工产品的工业一、氯碱生产的核心技术——电解 使电流通过电解质溶液或熔融态的电解质,在阴、阳两极分别发生还原反应和氧化反应的过程叫做电解(electrolysis)。 对电解槽结构进行优化设计,合理选用电极和隔膜材料,是电解生产的核心。石棉隔膜电解槽 离子膜电解槽1.离子膜电解槽的简单构造如何? 2.离子膜的作用是什么? 3.工业制碱的简单生产流程怎样?二、食盐水电解工艺——离子膜法电解 1、生产的主体设备:离子膜电解槽
简单构造:阳极:金属钛网(涂钛钌氧化物)
阴极:碳钢网(有镍涂层)
阳离子交换膜:只允许阳离子通过,
把电解槽隔成阴极室和阳极室。
2、添加原料
阳极室:精制的饱和食盐水
阴极室:添加纯水(加一定量的NaOH溶液)
3、离子交换膜的作用:
(1)防止Cl2和H2混合而引起爆炸
(2)避免Cl2与NaOH反应生成NaClO,影响NaOH的产量三、氯碱生产的流程1.用什么方法除去泥沙?
2.用什么试剂除去Ca2+、Mg2+、Fe3+、SO42-?
3.所用试剂只有过量才能除净这些杂质,试设计一个合理的顺序逐一除杂。
思考:粗盐水(Ca2+、Mg2+、Fe3+、SO42-)Ba2+ + SO42- =BaSO4Na+ 、 Ca2+、Mg2+、Fe3+、Ba2+ 、 Cl-BaSO4Ca2+ + CO32- = CaCO3
Ba2+ + CO32- = BaCO3CaCO3
BaCO3过量Na2CO3Na+、 Mg2+、 Ca2+ 、 Cl- 、 OH-Mg2+ + 2OH- = Mg(OH)2
Fe3+ + 3OH- = Fe(OH)3过量NaOHFe(OH)3
Mg(OH)2Mg2+、 Ca2+、 Na+、 Cl- 、 OH-、CO32-精制食盐水适量HCl,调节PH通过阳离子交换树脂Na+、 Cl-四、氯碱工业产品的应用第三单元
硫酸工业硫酸的消费量是一个国家工业发达水平的一种标志接触法制硫酸思考1、工业制硫酸的原料有哪些?如何选择?2、工业制硫酸分几个阶段? 每个阶段的反应原理是什么?用到什么典型设备?3、工业制硫酸生产流程?硫酸工业生产的原理第一步:造气第二步:接触氧化第三步:三氧化硫的吸收生产流程:造气→催化氧化→吸收 生产中原料选择 早期黄铁矿在储量比较大,而天然硫磺矿资源缺乏,又难以以从国外购进,并且,那时对环境保护也不够重视。 为什么早期我国是以黄铁矿为原料制硫酸?硫酸工业生产流程动画 硫酸的工业生产沸 腾 炉接 触 室吸 收 塔净化冷 却空气 炉气思考:
从沸腾炉出来的气体 SO2是否纯净?矿渣思考:黄铁矿为什么要粉碎?为什么通入强大的空气流?燃烧黄铁矿为什么不要多加燃料?沸腾炉思考:适宜条件的选择接 触 室思考:接触室中热交换器的作用?从接触室出来的气体成分是什么?催化剂:五氧化二矾(V2O5)
温度:400至500摄氏度
压强:常压温度:400~500℃催化剂活性较高压强:设备、成本和能源消耗(增大压强SO2的转化率提高不大)吸 收 塔
思考:吸收三氧化硫为什么不用水和稀硫酸,而用98.3%的浓硫酸?浓硫酸为什么必须从塔顶喷下?
(1) SO2+Ca(OH)2=CaSO3+H2O
CaSO3+H2SO4=CaSO4+SO2↑+H2O
(2) SO2+2NH3 +H2O =(NH4)2SO3
(NH4)2SO3 + H2SO4 =( NH4)2SO4 + SO2↑+ H2OCa(OH)2 + H2SO4 = CaSO4 + 2H2O 制石膏黄铁矿矿渣可用来制造水泥、砖和炼铁等。(1)在沸腾炉旁设置“废热锅炉”,产生蒸汽发电;
(2)在接触室中设热交换器,预热SO2和O2 。二、能量充分利用
“废热”利用:A、B、C、D四地的地理位置如图,交通均较为便利,其他地理条件如下:A地是风景旅游城市;B地是硫酸消费中心;C地有较为丰富的黄铁矿资源;D地有少量的硫酸消费。硫酸厂址应选择在 。三、生产规模:一般要求较大规模
厂址选择 :靠近硫酸消费中心的地区,避开人口稠密的居民区和环境保护要求高的地区。3.对于接触法制硫酸的生产操作与说明生产操作的主要理由两者都正确的是 ( )
A.硫铁矿燃烧前需要粉碎,因为大块的硫铁矿不能燃烧
B.三氧化硫的吸收采取逆流的形式,目的是增大其与吸收剂的接触面积
C.二氧化硫氧化成三氧化硫时需使用催化剂,这样可以提高二氧化硫的转化率
D.三氧化硫用98.3%的浓硫酸吸收,目的是防止形成酸雾,以便使其吸收更加充分 硫酸的工业制备和环境保护BD ▲接触氧化的三个适宜条件:压强用常压;温度为400℃~500℃;催化剂主要为V2O5。 硫酸工业总结硫酸工业生产的原理镁和铝的冶炼镁的工业常见制法——电解法流程: 海水 请写出上述过程中所涉及到的化学方程式 (2)铝的制备
铝土矿的提纯
Al2O3+2OH-=2AlO2-+H2O
AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-
2Al(OH)3=Al2O3+3H2O
电解
2Al2O3(熔融)=4Al+3O2(冰晶石Na3AlF6)2019/2/24从铝土矿中提取铝铝土矿的成分:要从铝土矿中提取铝,必须先制备较纯的氧化铝工艺流程图见课本P62主要成分:Al2O3少量:Fe2O3、SiO2等杂质从铝土矿制备铝的工艺流程Al2O3
Fe2O3
SiO2过量NaOH
溶液过滤①Fe2O3除去NaAlO2
Na2SiO3
NaOH
溶液过量盐酸过滤②
AlCl3
NaCl
HCl
溶液
过量氨水过滤③滤液除去H2SiO3除去△④Al2O3通电⑤Al 方法1:Al(OH)3碱溶法Al2O3
Fe2O3
SiO2过量盐酸过滤①SiO2除去
AlCl3
FeCl3
HCl
溶液
过量NaOH
溶液过滤②Fe(OH)3除去NaAlO2
NaCl
NaOH
溶液过量CO2过滤③滤液除去Al(OH)3△ ④Al2O3通电⑤Al 方法2:酸溶法再 见
同课章节目录
- 专题一 多样化的水处理技术
- 第一单元 水的净化与污水处理
- 第二单元 硬水软化
- 第三单元 海水淡化
- 专题二 从自然资源到化学品
- 第一单元 氨的合成
- 第二单元 氯碱生产
- 第三单元 硫酸工业
- 第四单元 镁和铝的冶炼
- 专题三 让有机反应为人类造福
- 第一单元 有机药物制备
- 第二单元 合成洗涤济的生产
- 第三单元 纤维素的化学加工
- 第四单元 有机高分子合成
- 专题四 材料加工与性能优化
- 第一单元 材料的加工处理
- 第二单元 材料组成的优化
- 第三单元 复合材料的制造
- 专题五 为现代农业技术添翼
- 第一单元 土壤酸碱性的改良
- 第二单元 化肥的生产与合理使用
- 第三单元 无土栽培技术
- 第四单元 化学农药的发展
- 专题六 从污染防治到绿色化学
- 第一单元 环境污染的化学防治
- 第二单元 绿色化学与可持续发展
